2011~2016年耐碳青霉烯类抗菌药物肠杆菌科细菌的分布特点和耐药性分析
刘 刚 魏莲花▲ 邹凤梅 杨永清 陈晓青
1.甘肃省人民医院,甘肃兰州 730000;2.甘肃中医药大学,甘肃兰州 730020
由于碳青霉烯类抗菌药物具有广泛的抗菌谱、良好的抗菌活性及稳定性,长期以来,被认为是治疗革兰阴性菌感染、尤其是产超广谱β-内酰胺酶(Extended-spectrum β-Lactamses,ESBLs)及高产AmpC 酶革兰阴性菌感染的最后一道防线[1-2]。随着该药物在临床各科的广泛应用,国内外陆续出现了碳青霉烯类抗菌药物耐药细菌引起感染的报道[3],尤其是耐碳青霉烯类药物肠杆菌科细菌(CRE)的检出率逐渐升高。CRE细菌引起的感染除了比较严重外,由于抗菌药物选择比较困难而使抗感染治疗也较困难。给临床及时提供菌株的抗菌药物耐药情况与耐药基因的分布特征,可以提高患者的治愈情况等方面发挥重要的作用。本研究对我院的CRE分布及耐药特点进行总结,旨在为临床治疗该类细菌感染提供理论依据。
1 材料与方法
1.1 细菌来源
从本院临床各科室送检标本中分离的肠杆菌科细菌为本研究主要菌株,质控菌株采用大肠埃希菌ATCC 25922。
培养基和抗菌药物纸片:药敏试验培养基用所有的抗菌药敏纸片采用英国OXOID公司产品。
1.2 方法
1.2.1 药物敏感性试验 采用CLSI推荐的琼脂纸片扩散法(K-B法)进行,按2016版CLSI M100-S26标准判断结果[4]。
1.2.2 数据分析处理 采用WHONET5.6软件对计数资料进行统计,并对CRE细菌科室分布进行统计画图处理。
2 结果
2.1 CRE细菌分布情况
2.1.1 CRE细菌检出率 从2011年开始,到2016年对我院分离出的9667株肠杆菌科细菌进行耐药监测,筛选出657株CRE(对亚胺培南、美罗培南和厄他培南中任一种耐药者),剔除同一患者相同部位分离的重复菌株。见表1。
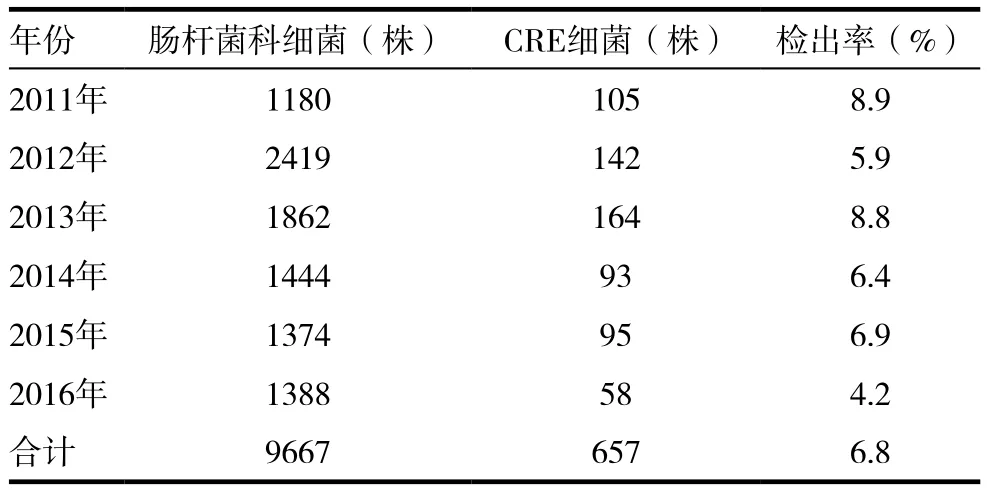
表1 2011 ~ 2016年CRE细菌检出率(%)
2.1.2 CRE细菌分布 在657株CRE菌株中,肠杆菌属280株(阴沟肠杆菌261株、产气肠杆菌17株、河生肠杆菌1株、阪崎肠杆菌1株)最多占42.6%(280/657);其次克雷伯菌属138株(肺炎克雷伯菌119株、产酸克雷伯菌19株),占21.0%(138/657);第三是是大肠埃希菌117株,占17.8%(117/657)。其他细菌依次为摩根摩根菌53株、枸橼酸杆菌属25株(弗劳地枸橼酸杆菌21株、布氏枸橼酸杆菌4株)、变形杆菌属30株(奇异变形杆菌20株、普通变形杆菌10株)、沙雷菌属9株(粘质沙雷菌6株、液化沙雷菌3株)、成团泛菌4株、小肠结肠耶尔森菌1株,占18.6%(122/657)。
2.1.3 CRE细菌标本类型分布 657株CRE菌株分布于不同类型的临床标本中,以痰液呼吸道标本为主,其次为脓液和分泌物标本,第三为尿液标本,三者占总数的79.3%(521/657)。见表2。
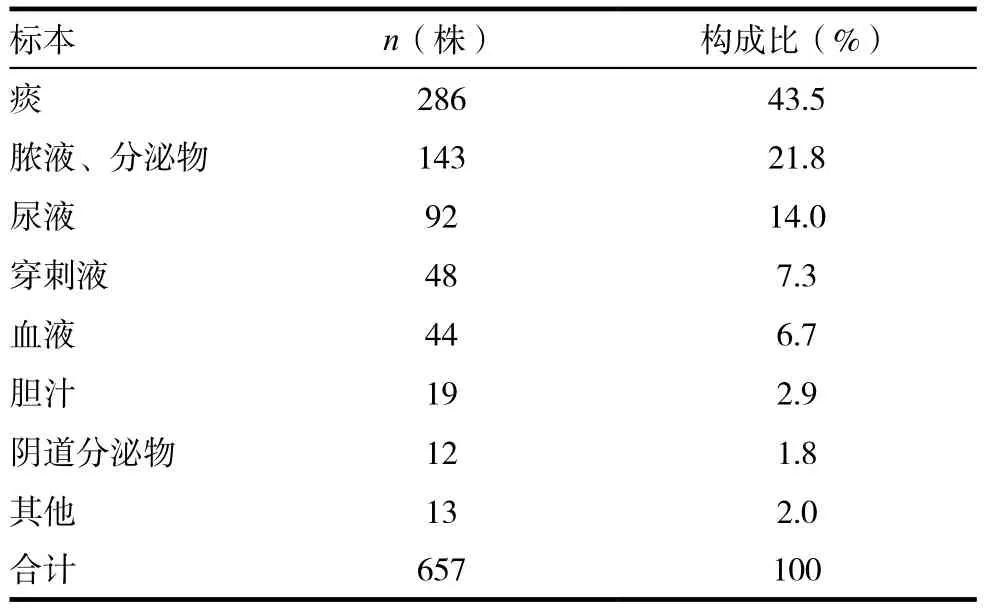
表2 657株CRE菌株标本类型构成比(%)
2.1.4 CRE细菌临床科室分布 657株CRE菌株分布在29个临床科室中,几乎分布在各个临床科室中,见图1。
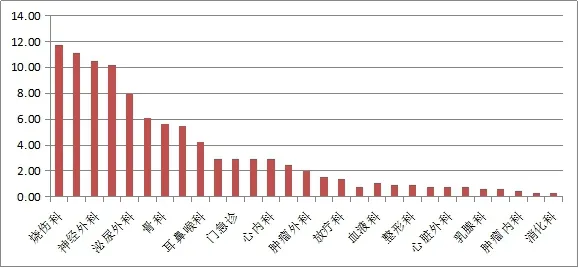
图1 657株CRE细菌科室分布(%)
2.1.5 CRE细菌年龄分布 657株CRE菌株随着年龄的增大,菌株数量也随之增加,其中≤20岁13.7%(90/657)、21 ~ 40 岁 14.5%(95/657)、41 ~60岁 31.2%(205/657)、≥ 61岁 40.6%(267/657)。
2.2 CRE菌株药敏实验结果
CRE菌株对大多数临床常用抗菌药物呈高度耐药,其细菌种属不同,耐药表型不同,耐药性也不同。 2011~2016年CRE菌株中最多的3个菌属和其他肠杆菌科细菌药敏试验。见表3。
3 讨论
碳青霉烯类抗菌药物在治疗肠杆菌科细菌重症感染中起重要作用,1998~2004年美国的SENTRY监测中,尚未发现对碳青霉烯类抗菌药物耐药肠杆菌科细菌[5]。但2005年后,对碳青霉烯类抗菌药物耐药的肠杆菌科细菌在美国、法国、希腊、南美和澳大利亚等多个国家和地区报道逐渐增多[6],及时掌握该类细菌的耐药动态势在必行。
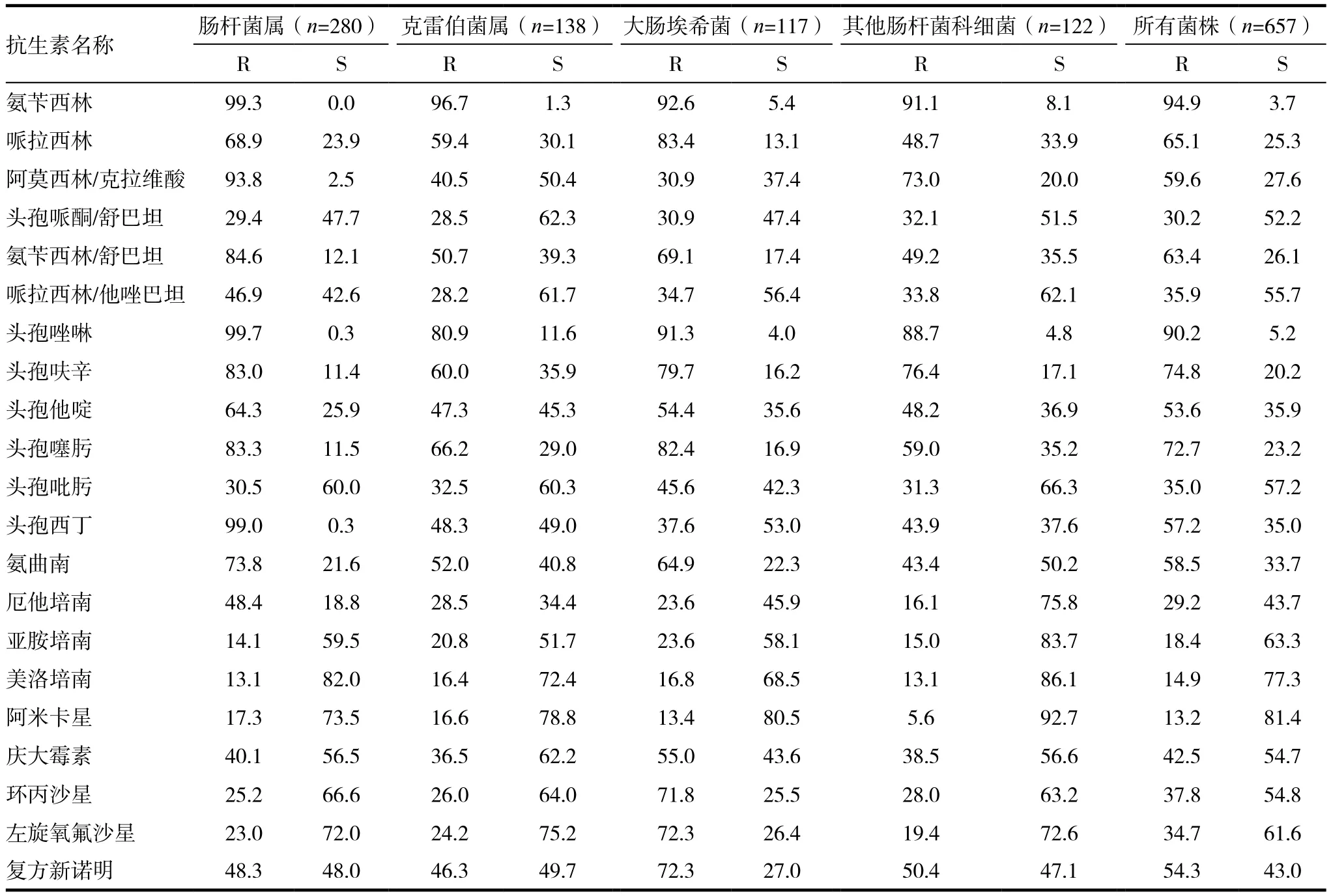
表3 2011 ~ 2016年不同种属CRE对临床常用抗菌药物的耐药率和敏感率(%)
本研究显示,2011~2016年,共检出657株CRE菌株(6.8%),CRE菌株的菌属呈现多样化,涉及肠杆菌科细菌中的9个种属。阴沟肠杆菌、肺炎克雷伯菌和大肠埃希菌为CRE菌株分离最多的3个种,占75.6%;CRE细菌分布在不同临床标本中,以痰液为主,其次为脓液、分泌物,第三为尿液,三者占总数的79.3%。说明CRE主要见于呼吸系统感染性疾病标本中;而人体皮肤、软组织黏膜受到损伤时,机体自身防御屏障的抵抗能力下降,使得CRE细菌易致感染。
CRE细菌分布在各个临床科室中,依次为烧伤科、呼吸科、神经外科、普外科、泌尿外科、儿科、骨科、ICU等各科室中。分析查阅病历,这些CRE细菌的主要分布科室大部分患者病情都比较严重,需要长时间的住院治疗;多次进行了侵入性的治疗操作,比如气管切开、留取导尿管、插入呼吸机、留置静脉导管等;长时间的使用治疗谱范围广的抗菌药物、免疫抑制剂或者肾上腺皮质激素等,甚至是出现了抗菌药物的滥用,使得人体内的正常菌群受到了抑制,内部的微生态环境紊乱,出现了菌群失调的现象,或者肠杆菌科细菌发生了位置转移[7-8]。
CRE细菌从年龄分布来看,随着年龄的增大,CRE菌株的检出率也随之增加。有研究显示,儿童患者的耐药率较低,而成人和老年患者的耐药率较高,可能是成人和老年患者体内对抗菌药物敏感的菌株不断被杀死,但不易被杀死的菌株逐渐在体内大量的繁殖,并逐渐对抗菌药物的活性减弱,最终形成耐药[9]。
碳青霉烯类抗菌药物作为目前最强的抗革兰阴性抗菌药物,在临床上应用广泛[10]。但是,伴随着临床使用,耐药的问题也随之而来。碳青霉烯类耐药菌在全球范围广泛传播,并且检出率呈现逐年升高的趋势[11]。而CRE菌株往往对多种临床常用的抗菌药物呈现耐药。本研究显示,657株CRE菌株除对阿米卡星、美洛培南和亚胺培南磷霉素的耐药率分别为13.2%,14.9%和18.4%小于20%外,β内酰胺类抗菌药物的耐药率基本上都大于70%。其他常见抗菌药在40%~60%之间。所以在临床治疗有CRE菌株引起的感染时,需要临床医生根据抗菌药物的敏感性实验结果科学选用抗菌药物,不然联合用药的效果并不明显。亚胺培南、美罗培南均出现了不同程度的耐药性,但其耐药率均较低,耐药率分别为18.4%、14.9%,碳青霉烯类药物依然可以作为治疗多重耐药菌感染的首选药物,或根据药敏试验结果联合使用氨基糖苷类抗菌药物和其它敏感药物[12]。所以给临床及时提供菌株的抗菌药物耐药情况与耐药基因的分布特征,可以提高患者的治愈情况等方面发挥重要的作用。
CRE菌株中耐药基因可以在菌株之间进行转移传递,采取及时、有效的预防措施时非常重要的。首先,要加强医务人员的感染相关知识,提高自身的防护意识,特别注意手卫生,严格执行医院的消毒隔离制度[13];其次,对临床检测确定为CRE菌株的患者,要早汇报、早隔离,减少交叉传染,并且要进行重点的监测;还要对全院各科室细菌耐药情况进行实时监测,这些措施都有助于减少CRE菌株的流行播散[14]。
抗菌药物的不合理使用,以及医院缺乏有效的感染防控措施,均易导致耐药株在医院内播散。研究表明,患者免疫缺陷、长期住院、侵袭性诊疗操作,以及广谱抗菌药物的应用是导致医院内多重耐药或泛耐药感染或定植的高危因素[15]。
由于经费有限,我们没有对本院临床分离的CRE菌株的来源、传播途径和导致感染或定植的危险因素等展开研究。儿科病房(6.1%,40/657)、门急诊(5.5%,36/657)CRE菌株在医院科室分布靠前,可能提示克隆菌株在病房环境内的流行播散,这将对患者的治疗和预后构成严重威胁[16]。下一步课题组将进行流行病学调查,进而采取有效的医院感染控制措施,遏制耐药菌株的播散。
[1] 吴俊,赵子文.耐碳青霉烯类革兰阴性菌感染的治疗药物与联合抗菌策略进展[J].中华医院感染学杂志,2016,26(9):2152-2156.
[2] 邹颖,徐晓刚,郭庆兰,等.革兰阴性杆菌血流感染的病原菌分布、耐药性及碳青霉烯酶基因的检测与分析[J].中国感染与化疗杂志,2016,16(2):214-220.
[3] Potron A,Poirel L,Nordmann P.Emerging broad-spectrum resistance in Pseudoomonas aeruginosa and Acinetobacter baumannii:Mechanisms and epidemiology[J].Int J Antimicrob Agents,2015,45(6):568-585.
[4] Solter E,Adler A,Rubinovitch B Israeli National Policy for Carbapenem-Resistant Enterobacteriaceae Screening,Carrier Isolation and Discontinuation of Isolation[J].Israel Ministry of Health,2017,10(15):1-5.
[5] Pfaller MA,Sader HS,Fritsche TR,et al.Antimicrobial activity of cefepime tested against ceftazidime-resistant Gram-negative clinical strains from North American Hospitals:report from the SENTRY Antimicrobial Surveillance Program (1998-2004)[J].Diagn Microbiol Infect Dis, 2007,57(4):471.
[6] Vivek Bhat,Sudeep Gupta,Rohini Kelkar,et al.Bacteriological profile and antibiotic susceptibility patterns of clinical isolates in a tertiary care cancer center[J]. Indian Journal of Medical & Paediatric Oncology,2016,37(1):20-25.
[7] 汪玥,孙自镛,陈中举,等.碳青霉烯类耐药的肠杆菌科细菌耐药机制研究[J].中华检验医学杂志,2012,35(4):339-344.
[8] 戴佳原,徐胜勇,徐军,等.急诊科病原菌的类型及耐药性分析 [J].临床急诊杂志,2017,18(11):830-834.
[9] 崔元侠.老年患者使用抗菌药物导致不良反应的特点及危险因素研究[J].中国处方药,2016,14(7):34-35.
[10] 刘涛,臧远胜,修清玉.碳青霉烯类抗生素研究进展[J].中国新药与临床杂志,2013,32(12):927-931.
[11] F- P Hu,Y Guo,D-M Zhu,et al.Resistance trends among clinical isolates in China reported from CHINET surveillance of bacterial resistance,2005–2014[J].Clinical Microbiology and Infection,2016,22(1):S9-S14.
[12] 高杰,李英,王文英.儿科患者感染大肠埃希菌耐药性及其对碳青霉烯类和氨基糖苷类药物耐药机制研究 [J].中国病原生物学杂志,2016,11(2):164-168.
[13] Namias N,Solomkin JS,Jensen EH,et al.Randomized,multicenter,double-blind study of efficacy,safety,and tolerability of intravenous ertapenem versus piperacillin/tazobactam in treatment of complicated intra-abdominal infections in hospitalized adults[J].Surgical Infections,2007,8(1):15-28.
[14] 陆文香,许倩,钟桥,等.耐碳青霉烯类肠杆菌科细菌临床感染现状分析[J].国际检验医学杂志,2015,36(13):1861-1863.
[15] Patel G,Huprikar S,Factor SH,et al.Outcomes of carbapenem-resistant Klebsiella pneumoniaeinfection and theimpact of antimicrobial and adjunctive therapies[J]Infect Control Hosp Epidemiol,2008,29(12):1099-1106.
[16] Rolain JM,Parod P,Cornaglia G.New Delhi metalloblactamase(NDM-1):towards a new pandemia[J].Clin Microbiol Infect,2010,16(12):1699-1701.

