乌司他丁对水下爆炸所致兔急性肺损伤的保护作用
吴海燕 黄勍栋 唐婷玉 李志军 郝建 马宏昊
随着社会工业化的发展,爆炸事故频频发生,从2013年青岛、2015年天津,到2017年杭州,每次爆炸事件均有不同程度的人员伤亡。动物实验及临床经验证实爆炸冲击波对人体损伤的靶器官主要为肺组织、鼓膜和胃肠道[1]。水下爆炸对生物的杀伤效应强,肺部损伤发生率高,病死率高,临床上急性肺损伤(ALI)病死率可高达35%~40%[2]。乌司他丁作为一种蛋白酶抑制剂,可以抑制多种酶的活性,减少各种炎症因子的生成和释放,从而保护肺组织[3-4]。本研究通过水下爆炸建立兔ALI模型,并给予乌司他丁干预治疗,观察兔血清、肺泡灌洗液(BALF)的炎症指标变化,探讨乌司他丁对兔ALI保护作用及机制,现将结果报道如下。
1 材料和方法
1.1 材料 健康清洁新西兰兔40只,雌雄不限,体重(2.0±0.5)kg,由安徽长临河医药科技有限公司提供;合格证号:SYXK(皖)2007-002,自由喂养,给予正常饮食饮水。乌司他丁注射液(广东天普生化医药股份有限公司),DNM-9602酶标分析仪(北京普朗公司),兔核转录因子-κB(nuclear factor-κB,NF-κB)ELISA 试剂盒、兔TNF-α ELISA试剂盒(上海江莱生物科技有限公司),兔IL-6 ELISA试剂盒(上海朗顿生物科技有限公司)。
1.2 方法
1.2.1 动物分组 按照随机数字表法将兔分为正常对照(N)组、ALI(A)组、乌司他丁低剂量(B)组、乌司他丁高剂量(C)组,每组10只。所有兔称重,做好分组标记。
1.2.2 模型制备 实验前予禁食12h、禁水4h。于左侧气管旁作一反“L”形切口,充分暴露颈总动脉和颈外静脉,放置24G套管针并固定;胸部脱毛,固定于自制木板上。将木板置于钢质兔箱中,兔箱一侧设置有粘贴塑料薄膜的U型缺口,调节实验兔胸部与缺口大小一致。木板背面通过泡沫支撑与兔箱固定,以及泡沫缓冲作用,保护头颈部、四肢等部位,兔箱示意图见图1。爆炸装置及实施全程由中国科技大学近代力学系专业人员研制、操作,依据预实验结果及力学相关公式设定爆炸剂量1.0g,爆炸距离1.8m,采用标准雷管(专利号:ZL200710019659.1),爆速 8 600m/s,爆温(3 400±400)K,爆热6.28 MJ/kg。爆炸装置示意图见图2。A、B、C组分别进行爆炸试验,起爆后,立即取出兔并实施简单的急救,清理呼吸道分泌物,检查并缝合胸壁破口,做好保暖措施,观察记录实验兔的一般表现、精神状态、应激反应等。各组兔均模型制作成功,予不同剂量的乌司他丁注射液(溶于0.9%氯化钠注射液)经颈外静脉套管针缓慢注射,B、C组分别注射2.5、10×104U/kg乌司他丁注射液5ml,N、A组注射等量0.9%氯化钠注射液。
1.3 检测指标
1.3.1 血清NF-κB、TNF-α、IL-6水平测定 爆炸后,予氯胺酮40mg/kg肌肉注射麻醉固定,分别于0、4、12、24h 采集静脉血 5ml,室温下离心(3 000r/min,10min),上清液于-80℃保存待用。按试剂盒说明书ELISA法检测。

图1 兔箱示意图
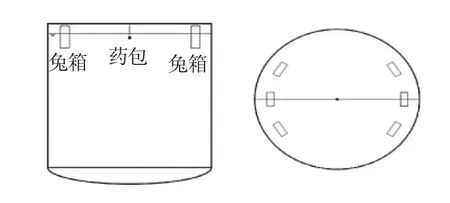
图2 爆炸装置示意图
1.4 统计学处理 应用SPSS 21.0统计软件,计量资料以表示。方差齐性检验采用Levene检验,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 兔的一般情况 实验前安静环境中,所有兔呼吸平稳,活动自如,自由饮食饮水。爆炸致伤后,A、B、C组兔表现为呼吸频率加快,口唇发绀,口鼻腔黏膜充血、少量泡沫状分泌物,伴烦躁不安、呼吸窘迫等症状,部分家兔短暂性昏迷。
2.2 肺组织病理学改变
2.2.1 大体表现 N组肺组织表面呈粉红色,无破损病
1.3.2 BALF中NF-κB、TNF-α、IL-6水平测定 爆炸后24h收集左肺BALF,采用氯胺酮40mg/kg肌肉注射麻醉固定,开胸分离气管和双侧肺叶,仔细剔除肺外组织后结扎右肺,自制灌洗针插入左主支气管并固定,左肺注入37℃0.9%氯化钠注射液10ml,反复抽吸3次,回收BALF 量约为 6ml,室温下离心(3 000r/min,10min),上清液于-80℃保存待用,ELISA法检测。
1.3.3 肺湿干重比测定 经耳缘静脉注射空气20ml将兔处死,开胸分离右肺中叶,0.9%氯化钠注射液冲洗、吸去水分后称湿重(wet weight,W),湿肺置于80℃烤箱内72h,烘干后称干重(dry weight,D)。计算湿干重比,公式为:W/D=湿重/干重,可反应肺组织水肿的程度。
1.3.4 肺组织病理学观察 右肺下叶中部置于10%中性甲醛中固定48h,石蜡包埋、切片,HE染色,光镜下观察组织病理学改变。灶,包膜光滑完整、有弹性,切面无液体溢出。A组肺组织明显充血水肿,表面呈暗红色,体积显著增大,可见多发分布的片状瘀血斑,切面及气管有富含蛋白质的粉红色泡沫状液体溢出。B、C组肺组织充血水肿明显减轻,仅少量瘀血斑,切面及气管内分泌物明显减少。
2.2.2 镜下观察 N组肺组织结构基本正常,肺泡壁完整,肺泡腔和间质无出血、水肿及炎细胞浸润。A组部分肺泡壁断裂、融合,肺泡大小不均,上皮细胞受损,肺泡腔和间质可见大量红细胞、炎症细胞及浆液性渗出物浸润,局部偶见透明膜,肺泡间隔明显增厚。与A组相比,B、C组出血、水肿、炎性浸润明显减轻,以C组最为明显。见图3(插页)。

图3 各组兔肺组织病理学改变(HE染色,×400)
2.3 各组兔血清 NF-κB、TNF-α、IL-6水平的比较A、B、C组血清NF-κB水平,致伤4h较0h均明显增高(均P<0.05)。致伤12h,B、C组较A组降低,差异有统计学意义;B组与C组相比,差异无统计学意义(P>0.05)。致伤24h,B、C组均较A组降低,以C组降低最为显著(P<0.05),其中C组致伤24h与0h比较差异无统计学意义(P>0.05)。A、B、C组血清 TNF-α水平致伤 4h比较 0h明显升高(均P<0.05)。致伤 12、24h,B、C组均较A组降低,以C组降低最为显著(均P<0.05)。致伤4h,A、B、C组血清IL-6水平均较0h明显升高(均P<0.05)。致伤 12、24h,B、C 组均较 A 组降低,以 C 组降低最为显著(P<0.05)。C组致伤24h与0h相比,差异无统计学意义(P>0.05)。见表1~3。

表1 各组兔不同时点血清NF-κB水平比较(ng/L)

表2 各组兔不同时点血清TNF-α水平比较(ng/L)

表3 各组兔不同时点血清IL-6水平比较(ng/L)
2.4 各组兔肺W/D及BALF中NF-κB、TNF-α、IL-6水平的比较 BALF 中 NF-κB、TNF-α、IL-6 水平,A、B、C组水平均较N组升高,乌司他丁干预后,B、C组均较A组降低,以C组降低最为显著(均P<0.05)。W/D与上述因子表达趋势相同,以C组最显著(P<0.05)。见表4。
3 讨论
同距离同质量TNT当量的水下爆炸压力值约为空气爆炸的200倍,其中造成生命威胁主要是爆炸产生的巨大冲击波。爆炸后的冲击波以波阵面形式向四周传播,可对人体脏器造成严重损伤,轻者听力下降、鼓膜破裂,重者肺肝脾破裂,甚至直接死亡。不同于空气爆炸导致的ALI,水下爆炸的冲击波具有更强的生物破坏力,如未能得到早期积极救治,肺损伤病死率可高达70%。但当前水下爆炸致伤的相关研究甚少。
NF-κB作为调控多种炎症介质转录的核心[5],作用于下游基因,表达并释放TNF-α、IL-6,导致炎症反应无限扩大,进而作用于肺毛细血管内膜,使其通透性增高、通气/血流比例失调。临床上则表现为肺充血水肿、低氧血症等。若未能进行早期有效干预,病死率明显升高。全氟异丁烯(PFIB)吸入引起的大鼠肺损伤,炎症因子通过NF-κB信号通路表达增加并释放入血[6]。脓毒血症导致的急性肺损伤时肺组织内炎症指标的表达明显上升,而急性重度脓毒血症导致的急性肺损伤中,NF-κB p65活性表达与肺损伤严重程度呈正相关[7],多项动物模型实验证实NF-κB信号途径的激活可能是ALI的发病机制。炎症因子激活NF-κB信号途径,下游基因TNF-α、IL-6的持续表达,导致炎症反应及肺损伤加重。也有研究显示[8]LPS诱导产生ALI中,小鼠的肺泡灌洗液NF-κB、TNF-α、IL-6 表达水平均较高,与 Xiao 等[9]研究结果一致。本实验通过水下爆炸建立小鼠急性肺损伤模型,测得A组爆炸后4、12、24h血清炎症因子,以及肺泡灌洗液中NF-κB、TNF-α、IL-6均较爆炸前表达水平升高。

表4 各组兔肺W/D及BALF中NF-κB、TNF-α、IL-6、水平比较
直接或间接的危险因素导致的ALI发病机制可能是炎症的过度反应。针对高发生率、高病死率,临床上治疗手段包括肺保护性通气,机械通气,体外膜肺氧,糖皮质激素及其他药物治疗,但尚无确切有效的方法。通过抑制NF-κB活性能够缓解ALI严重程度,下调TNF-α、IL-6。无论是动物实验中抑肽酶减轻肺损伤的严重程度[6],还是甲泼尼龙、地塞米松在急性肺损伤的治疗作用[10-11],均提示通过抑制NF-κB信号途径来减轻肺部炎症。而蛋白酶抑制剂乌司他丁在空气爆炸引起的急性肺损伤的动物模型中起到抑制炎症反应,减轻肺水肿的作用,同时脓毒血症、LPS诱导产生的急性肺损伤中也有类似报道[7,12]。本实验建立兔急性肺损伤模型后分别给予高、低剂量的乌司他丁干预治疗,测得4、12、24h血清炎症因子及24h BALF中炎症因子表达水平均较N组下降,提示治疗有效,且高剂量治疗C组较低剂量B组炎症因子表达水平低;以及镜下病理及肺W/D提示治疗后肺水肿较对照组好转,提示乌司他丁治疗可以抑制肺部炎症反应,减轻肺水肿,高剂量治疗组效果更显著。
综上所述,水下爆炸引起的急性肺部损伤与炎症的过度反应有关,蛋白酶抑制剂乌司他丁可以减少炎症因子的表达释放,减轻肺部炎症和肺水肿,起到辅助治疗的作用,为临床中水下爆炸致ALI的治疗提供实验依据。仍需进一步研究并探讨确切的发病机制,期待有学者能提出更好的治疗方案。
[1]张连阳.爆炸冲击伤的诊断[J].创伤外科杂志,2017,19(2):157-160.
[2]Dushianthan A,Grocott MPW,Postle AD,et al.Acute respiratory distress syndrome and acute lung injury[J].Postgraduate medical journal,2011,87(1031):612-622.
[3]Shu H,Kuanzhi Liu QH,Zhong F,et al.Ulinastatin,a protease inhibitor,may inhibitallogeneic blood transfusion-associated pro-inflammatory cytokines and systemic inflammatory response syndrome and improve postoperative recovery[J].Blood Transfusion,2014,12(Suppl1):s109.
[4]Zhang Y,Zeng Z,Cao Y,et al.Effect of urinary protease inhibitor(ulinastatin)on cardiopulmonary bypass:a meta-analysis for China and Japan[J].PloS one,2014,9(12):e113973.
[5]崔雯雯,金鑫,王宏涛,等.NF-κB信号通路与肺部炎症疾病[J].中国急救医学,2015,35(003):283-287.
[6]王丽君,郝建,赵建,等.抑肽酶对全氟异丁烯致大鼠急性肺损伤的作用[J].中国急救医学,2014,34(6):533-537.
[7]张慧慧,蔡国龙,胡才宝,等.乌司他丁对脓毒症大鼠急性肺损伤的保护作用及其机制研究[J].中华危重症医学杂志(电子版),2017,10(3):153-158.
[8]Kim KY,Lee HS,Seol GH.Eucalyptol suppresses matrix metalloproteinase‐9 expression through an extracellular signal‐regulated kinase‐dependent nuclear factor‐kappa B pathway to exert anti‐inflammatory effects in an acute lung inflammation model[J].Journal of Pharmacy and Pharmacology,2015,67(8):1066-1074.
[9]Xiao M,Zhu T,Zhang W,et al.Emodin ameliorates LPS-induced acute lung injury,involving the inactivation of NF-κB in mice[J].International journal of molecular sciences,2014,15(11):19355-19368.
[10]唐琳娜,吴大玮,杨洁,等.不同剂量地塞米松对脓毒症小鼠肺组织糖皮质激素受体-α表达及肺损伤的影响[J].山东大学学报(医学版),2013,51(10):19-23.
[11]王蔚琛,夏永富,石磊,等.浅析甲泼尼龙用于急性肺损伤患者治疗中的临床效果[J].世界最新医学信息文摘(电子版),2016,15(30):86-87.
[12]李琴,樊佳,陈斌,等.自噬对脂多糖致大鼠急性肺损伤模型的炎症调控[J].中华实用诊断与治疗杂志,2017,31(4):328-331.

