沉默β-catenin表达对黑色素瘤A375细胞增殖与凋亡的影响研究
杨跃 曹毅 刘伟 杨晓红
皮肤恶性黑色素瘤(cutaneous malignant melanoma,CMM)多由痣或色素斑发展而来,一旦进入快速生长期,患者预后极差,平均生存期约30.3个月,且易发生转移、复发。CMM在皮肤恶性肿瘤死亡病例中占80%[1]。现已证明,信号转导通路在恶性黑色素瘤的发病机制中起至关重要的作用,提示干扰信号通路可能成为治疗恶性黑色素瘤的新途径[2]。Wnt/β-catenin是一条公认与肿瘤相关的信号通路,与肿瘤细胞的增殖、侵袭、凋亡等生物学行为均密切相关[3]。β-catenin蛋白是Wnt/β-catenin信号通路中关键的效应器,其在细胞内表达水平的高低可反映Wnt信号通路的活化状态[4-5]。基于此,本研究旨在通过干扰慢病毒沉默黑色素瘤A375细胞中β-catenin蛋白的表达,探讨β-catenin蛋白对A375细胞增殖与凋亡的影响,以期为临床研制恶性黑色素瘤的治疗药物提供参考,现报道如下。
1 材料和方法
1.1 细胞 人恶性黑色素瘤A375细胞(以下简称A375细胞),购自中国科学院细胞库。
1.2 主要试剂 鼠抗人β-actin单克隆抗体、兔抗人β-catenin单克隆抗体(美国abcam公司);羊抗兔IgGHRP、羊抗鼠IgG-HRP(北京中杉金桥生物技术有限公司);MTT、FBS、胰酶(美国 Gibco公司);二甲基亚砜(北京Solarbio公司);细胞凋亡试剂盒(南京凯基生物有限公司);DMEM细胞培养基(北京全式金公司)。
1.3 主要仪器 自动酶标仪(芬兰雷勃公司);荧光显微镜(日本OLYMPUS公司);流式细胞仪(美国BD公司);蛋白电泳装置(美国BD公司);细胞恒温培养箱(日本SANYO公司)。
1.4 方法
1.4.1 细胞培养 A375细胞使用DMEM完全培养基常规培养,培养条件:5%二氧化碳、37℃恒温。细胞传代3次后用于实验。
1.4.2 慢病毒载体siRNA制作 慢病毒载体siRNA构建由上海吉玛公司负责包装。干扰β-catenin靶基因CTNNB 1 mRNA siRNA β-catenin-RNAi-LV 干扰序列:5′-GGATGTGGATACCTCCCAAGT-3′,并提供对应的慢病毒对照β-catenin-negative-LV,序列为:5′-TTCTCCGAACGTGTCACGT-3′。
1.4.3 慢病毒感染A375细胞 将A375细胞进行常规消化、离心、重悬后计数,将细胞悬液稀释至1×104/ml。将细胞接种于6孔板中,每孔2×104个,体积2ml。显微镜下观察细胞融合度约为30%~40%时,分别往对应的孔内加入病毒液3μl,8h后观察细胞状态,并给细胞换液,4d后荧光倒置显微镜下观察细胞荧光染色情况。经β-catenin-RNAi感染的A375细胞记作A375-RNAi细胞;经β-catenin-negative感染的A375细胞记作A375-negative细胞,作为阴性对照;未经任何病毒感染的A375细胞作为空白对照。当转染效率>70%时,细胞分别继续传代、培养。
1.4.4 Western blot法检测细胞β-catenin表达水平常规细胞总蛋白提取后,进行蛋白电泳,转膜(200mA,90min),将NC膜在脱脂奶粉封闭1h,在一抗溶液中4℃过夜,TBST清洗3遍,将NC膜放入1∶2 500配置好的羊抗兔、羊抗鼠IgG二抗中室温下孵育1h。TBST清洗3遍,曝光,胶片晾干,扫描后应用Image J软件分析不同细胞中β-catenin蛋白表达水平的差异。
1.4.5 MTT法检测细胞增殖活性 分别将3组细胞制成0.75×104/ml的细胞悬液,接种于 96孔板,200μl/孔,培养24h,加入20μl/孔MTT工作溶液,4h后终止培养,加入150μl DMSO/孔,低速振荡10min,用酶联免疫检测仪测量各孔的吸光度值,48、72h后分别取出一块96孔板,按相同的步骤测量各孔的吸光度值并记录,吸光度值越大代表增殖活性越强。以上实验重复3次。
1.4.6 流式细胞术检测细胞凋亡率 分别将3组细胞消化、离心,用适量1×Buffer A重悬,制成1×106/ml的细胞悬液,加乙醇,于-20℃固定16h;1×Buffer A洗细胞2次,用0.25mg/ml RNaseA重悬,37℃作用30min;加PI 5μl,室温避光染色30 min;流式细胞仪激发波长488nm检测细胞凋亡率。
1.5 观察指标 观察并比较A375、A375-RNAi、A375-negative细胞倒置荧光显微镜下所见、β-catenin表达水平、增殖活性及凋亡率。
1.6 统计学处理 应用SPSS 17.0统计软件;计量资料以表示,3组比较采用单因素方差分析,组间两两比较采用SNK检验;P<0.05为差异有统计学意义。
2 结果
2.1 A375、A375-RNAi、A375-negative 细胞倒置荧光显微镜下所见比较 A375-RNAi细胞倒置荧光显微镜下见带绿色荧光,A375-negative细胞见带绿色荧光,未经任何病毒感染的A375细胞无荧光,说明A375-RNAi、A375-negative细胞慢病毒感染成功。
2.2 A375、A375-RNAi、A375-negative 细胞 β-catenin表达水平比较 见图1。
由图1 可见,A375、A375-RNAi、A375-negative 细胞β-catenin表达水平比较差异有统计学意义(P<0.05)。A375-RNAi细胞β-catenin表达水平较A375细胞与A375-negative细胞明显下调,差异均有统计学意义(均P<0.05)。A375细胞与A375-negative细胞β-catenin表达水平比较差异无统计学意义(P>0.05),β-catenin在A375细胞中高表达,β-catenin在A375-RNAi细胞中的表达量下降约55.1%,即β-catenin被干扰慢病毒液有效沉默。
2.3 A375、A375-RNAi、A375-negative 细胞增殖活性比较 见表1。
由 表1 可见 ,24、48、72h 时 ,A375、A375-RNAi、A375-negative细胞增殖活性比较差异均有统计学意义(均P<0.05)。A375-RNAi细胞增殖活性较A375-negative细胞与A375细胞减弱(均P<0.05),A375-negative细胞与A375细胞增殖活性比较差异无统计学意义(P>0.05)。

图1 A375、A375-RNAi、A375-negative细胞 β-catenin 表达水平比较(a:蛋白电泳图比较;b:表达水平比较;与A375-negative细胞比较,*P<0.05)

表1 A375、A375-RNAi、A375-negative 细胞增殖活性比较
2.4 A375、A375-RNAi、A375-negative 细胞凋亡率比较 见图2。
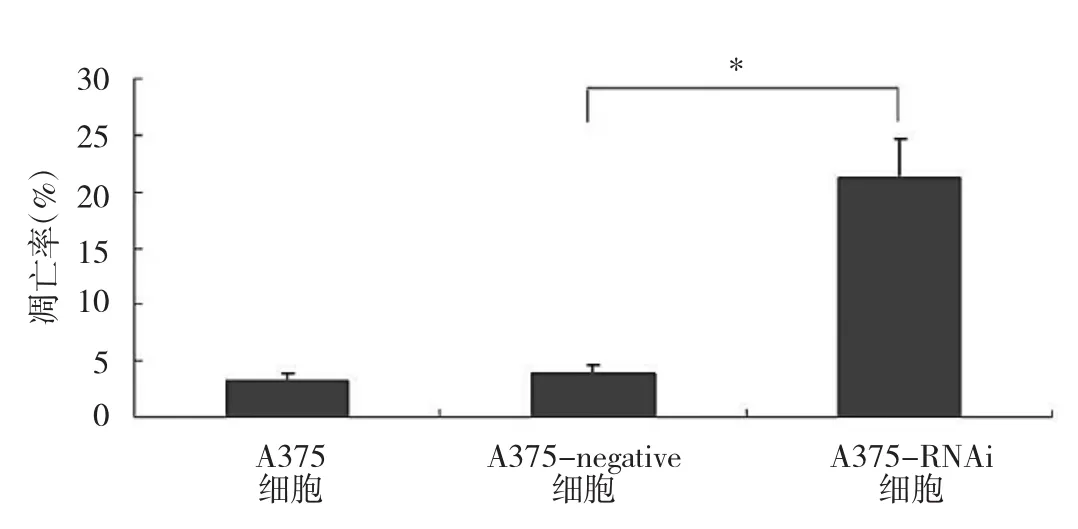
图2 A375、A375-RNAi、A375-negative细胞凋亡率比较(与 A375-negative 细胞比较,*P<0.05)
由图2 可见,A375、A375-RNAi、A375-negative细胞凋亡率比较差异有统计学意义(P>0.05)。A375-RNAi细胞凋亡率较A375-negative细胞与A375细胞明显增高(均P<0.05);A375-negative细胞与A375细胞凋亡率比较差异无统计学意义(P>0.05)。A375-RNAi细胞凋亡率为(21.17±3.41)%。
3 讨论
恶性黑色素瘤是一种发展迅速、高侵袭性、易转移、易复发的肿瘤,现已成为皮肤常见恶性肿瘤之一。因患者对皮肤肿瘤重视程度不够,确诊时多属于中晚期,这也成为CMM预后极差、病死率极高的原因之一。
信号转导通路可揭示肿瘤发生、发展的分子机制。经典Wnt/β-catenin信号通路在胚胎发育和细胞内环境稳定,调控细增殖、分化及干细胞、祖细胞自我更新中起重要作用[6]。β-catenin蛋白是Wnt/β-catenin信号通路中的关键蛋白,它通过与酪蛋白激酶1α(CK1α)、糖原合成酶激酶 3(GSK 3)、腺瘤性结肠息肉病(APC)和轴蛋白(Axin)形成的降解复合体结合,使β-catenin磷酸化并降解[7-8]。β-catenin蛋白在细胞内异常聚集或高表达会持续激活Wnt信号[9],可能使得信号通路中的其他分子发生突变,从而促进肿瘤的发展[10]。
RNAi技术能特异性剔除或关闭特定基因的表达以达到沉默靶基因目的,已成为一种功能非常强大的工具[8]。本实验所使用的慢病毒载体携带有绿色荧光蛋白基因,转染成功后在宿主细胞内显示绿色荧光;并能将靶基因片段融合至宿主基因内,能稳定的传递给子代细胞。通过观察带绿色荧光细胞比例及Western blot分析转染效率。结果显示,在倒置荧光显微镜下,A375-RNAi、A375-negative 细胞见带绿色荧光,A375-RNAi、A375-negative细胞慢病毒感染成功;Western blot显示A375-RNAi细胞内β-catenin的表达水平下调约55.1%,而A375-negative细胞无明显下调。这可以说明本实验运用慢病毒干扰成功沉默了β-catenin的表达。
Sinnberg等[11]利用 β-catenin干扰剂 PKF115-584作用于正常黑色素细胞和原位恶性黑色素瘤细胞WM35、WM115、WM793及转移性恶性黑色素瘤细胞451LU、SkMel28、1205LU、Mewo,结果显示:上述所有细胞在PKF115-584作用3d后细胞存活率均下降,并随PKF115-584浓度升高,细胞存活率下降。紧接着,Sinnberg等[11]又用慢病毒载体介导shRNA转染上述所有细胞,沉默β-catenin表达。在感染慢病毒2d后,检测细胞增殖情况,发现所有细胞增殖活性降低,且随感染时间延长,细胞存活率逐渐减低。此研究证实,无论是从干扰β-catenin表达还是阻断β-catenin转录活性,均会对恶性黑色素瘤细胞增殖起到抑制作用。
细胞凋亡过程主要受Bcl-2蛋白家族的蛋白调控。现已证实,Bcl-2基因是一个典型的原癌基因,在Bcl-2蛋白家族中,参与凋亡作用的主要是Bcl-2、Bax及Bak[12]。Bcl-2能通过阻断Bax和Bak活化而阻止细胞应对各种变化导致的凋亡。即Bax蛋白能促进细胞凋亡,而Bcl-2却能负调控细胞凋亡。研究发现,β-catenin作为转录因子能够调控Bax及Bcl-2蛋白的表达而参与凋亡过程[13]。c-Myc是一个公认的原癌基因,已经被证实是β-catenin的靶基因之一。c-Myc作为转录因子,是细胞内最重要转录因子之一,通过激活或抑制基因转录,最终能影响细胞增殖与凋亡,当缺乏营养剂生长刺激的情况下,c-Myc蛋白过表达,诱导细胞凋亡[14]。
综上所述,β-catenin转录活性提高是伴随恶性黑色素瘤发展,并可作为黑色素瘤细胞生存的标志之一。抑制β-catenin表达或活性可抑制细胞增殖、诱导抗凋亡基因下调,促进细胞凋亡,但其具体的作用机制有待于进一步的研究。
[1]Crocetti E,Mallone S,Robsahm TE,et al.Survival of patients with skin melanoma in Europe increases further:Results of the EURO-CARE-5 study[J].EuropeanJournalofCancer,2015,51(15):2179-2190.
[2]Merlino G,Noonan FP.Modeling gene-environment interactions in malignant melanoma[J].Trends in molecular medicine,2003,9(3):102-108.
[3]Nan S,Wang P,Yan L.Role of Wnt/β-catenin pathway in induc-ing autophagy and apoptosis in multiple myeloma cells[J].Onco-logy Letters,2016,12(6):4623-4629.
[4]Behrens J,von Kries JP,Kühl M,et al.Functional interaction of β-catenin with the transcription factor LEF-1[J].Nature,1996,382(6592):638-642.
[5]Chon E,Thompson V,Schmid S,et al.Activation of the Canonical Wnt/β-Catenin Signalling Pathway is Rare in Canine Malignant Melanoma Tissue and Cell Lines[J].Journal of Comparative Pathol-ogy,2013,148(2-3):178-187.
[6]Sinnberg T,Menzel M,Ewerth D,et al.β-Catenin signaling incr-eases during melanoma progression and promotes tumor cell su-rvival and chemoresistance[J].PloS one,2011,6(8):e23429.
[7]He H,Ding F,Li Y,et al.Migfilin Regulates Esophageal Cancer Cell Motility through Promoting GSK-3β-Mediated Degradation of β-Catenin[J].Molecular Cancer Research,2012,10(3):273-281.
[8]Wang J,Chen H,Cao P,et al.Inflammatory cytokines induce caveolin-1/β-catenin signalling in rat nucleus pulposus cell apop-tosis through the p38 MAPK pathway[J].Cell Proliferation,2016,49(3):362-372.
[9]Bellei B,Flori E,Izzo E,et al.GSK3β inhibition promotes melanogenesis in mouse B16 melanoma cells and normal human melan-ocytes[J].Cellular signalling,2008,20(10):1750-1761.
[10]Figeac N,Zammit PS.Coordinated action of Axin1 and Axin2 suppresses β-catenin to regulate muscle stem cell function[J].Cellular signalling,2015,27(8):1652-1665.
[11]Sinnberg T,Lasithiotakis K,Niessner H,et al.Inhibition of PI3KAKT-mTOR Signaling Sensitizes Melanoma Cells to Cisplatin and Temozolomide[J].Journal of Investigative Dermatology,2009,129(6):1500-1515.
[12]Long J,Menggen Q,Wuren Q,et al.MiR-219-5p Inhibits the Growth and Metastasis of Malignant Melanoma by Targeting BCL-2[J].Biomed Research International,2017,2017(9):1-7.
[13]Moon RT,Bowerman B,Boutros M,et al.The promise and perils of Wnt signaling through β-catenin [J].Science,2002,296(5573):1644-1646.
[14]Xia Y,Wu S.Tissue inhibitor of metalloproteinase 2 inhibits activ-ation of the beta-catenin signalling in melanoma cells[J].Cell Cy-cle,2015,14(11):1666-1674.

