肝星状细胞对肝癌SMMC-7721细胞增殖、侵袭的影响及作用机制研究
段建文 陈永胜 吴雯斐 张启瑜 熊聪
原发性肝癌是我国最常见的消化道恶性肿瘤之一,手术治疗是唯一能达到根治标准的方法。但由于肝癌细胞具有高度侵袭转移性,部分类型肝癌术后极易复发,使得肝癌的治疗难度加大[1]。我国肝癌患者大多合并乙型肝炎后肝硬化,肝星状细胞的活化被证实是肝纤维化的重要环节[2]。本研究将肝星状细胞条件培养基与人肝癌细胞株SMMC-7721细胞间接共培养,应用CCK-8细胞增殖检测、Transwell小室侵袭实验、Western blot等方法,探讨肝星状细胞对人肝癌SMMC-7721细胞增殖、侵袭的影响及可能的作用机制,现报道如下。
1 材料和方法
1.1 材料 人肝癌细胞株SMMC-7721、人正常肝细胞株LO2、人肝星状细胞株LX-2均购自中科院上海细胞库;二甲基亚砜(DMSO)购自索莱宝北京公司;CCK-8购自日本同仁化学公司;FBS、1640培养液、PBS均购自美国GIBCO公司;Transwell小室购自美国Coring公司;增殖细胞核抗原(PCNA)、血管内皮生长因子(VEGF)、核因子κB(NF-κB)、基质金属蛋白酶 2(MMP-2)均购自英国Abcam公司;680型全自动酶标仪购自美国伯乐公司。
1.2 方法
1.2.1 细胞培养 人肝癌细胞株SMMC-7721、人正常肝细胞株LO2及人肝星状细胞株LX-2接种于含10%体积分数FBS的1640培养液中,置于37℃,5%二氧化碳(CO2)培养箱中培养,细胞贴壁生长1~2d换液1次,按1:3消化传代,至对数生长期后收集条件培养基。
1.2.2 条件培养基制备 取对数生长期的肝星状细胞LX-2、正常肝细胞LO2,分别制成细胞悬液,调整细胞浓度为5×105/ml,取1ml细胞悬液于75ml培养瓶,置于37℃,5%CO2培养箱中培养,每隔24h后收集上清液,离心过滤掉细胞碎片,并更换新的含1%FBS的1640培养液15ml,分别收集24、48、72h条件培养基,分别记为HSC-CM、LO2-CM,用以培养肝癌SMMC-7721细胞。
1.2.3 细胞增殖检测 采用CCK-8法。取对数生长期的肝癌SMMC-7721细胞,用胰酶消化后细胞计数调整至密度为5×104/L;接种于96孔培养板,各取5个复孔,每孔加100μl细胞悬液,置于37℃,5%CO2培养箱中培养过夜,吸去上清液后分别加入100μl制备的HSCCM、LO2-CM及1%FBS 1640培养液,记为HSC-CM组、LO2-CM组(阴性对照)、1%FBS组(空白对照),分别培养 24、48、72h;每孔加入 CCK-8 10μl后置于37℃,5%CO2培养箱中培养,用酶标仪在450nm波长处分别检测24、48、72h各孔吸光度(OD值),OD值越大代表增殖能力越强。
1.2.4 Transwell小室侵袭实验 取Transwell小室12孔板,HSC-CM组上层加入2×104个SMMC-7721细胞及 HSC-CM 200μl,LO2-CM 组 上 层 加 入 2×104个SMMC-7721 细胞及 LO2-CM 200μl,1%FBS 组上层加入 2×104个SMMC-7721细胞及1%FBS 1640培养液200μl,各组下层均加入含15%FBS的1640培养液600μl;置于细胞培养箱内培养48h,弃上层小室内液体,用甲醇棉签拭去未透膜细胞,下室面细胞用4%多聚甲醛固定30min,结晶紫染色10min后,细胞于显微镜下(×400)计数5个不同视野,取平均值,穿膜细胞数越多代表侵袭能力越强。
1.2.5 PCNA、VEGF、NF-κB、MMP-2 蛋白表达检测采用Western blot法。各组分别培养肝癌SMMC-7721细胞48h后,加含苯甲基磺酰氟(PMSF)的PBS刮取细胞,离心后加RIPA裂解液,超声裂解提取细胞蛋白,用BCA试剂盒检测蛋白浓度,计算上样量;制8%的十二烷基硫酸钠聚丙烯酰胺(SDS-PAGE)胶,上样后以60mV恒压跑胶至样品进入分离胶后,改为110mV恒压至电泳结束;根据目的蛋白的分子量大小切胶,以350mA恒流湿转膜90min,使目的蛋白转移至聚偏氟乙烯(PVDF)膜;用5%脱脂奶粉封闭1h,一抗4℃过夜孵育,所用一抗浓度为1:1 000稀释;TBST洗3次,每次10min后,加5%脱脂奶粉配制二抗,常温下孵育1h后,TBST洗3次,每次10min,于暗室中加ECL发光剂发光,曝光。目的蛋白与β-actin的灰度比值代表目的蛋白的表达水平。
1.3 观察指标 观察HSC-CM组肝癌SMMC-7721细胞共培养前后形态的变化;比较HSC-CM组、LO2-CM组、1%FBS组肝癌SMMC-7721细胞的增殖能力、侵袭能力及 PCNA、VEGF、NF-κB、MMP-2 蛋白表达水平。
1.4 统计学处理 应用SPSS 16.0统计软件;计量资料以,多组间比较用单因素方差分析,两两比较采用LSD-t检验;P<0.05为差异有统计学意义。
2 结果
2.1 HSC-CM组肝癌SMMC-7721细胞形态的变化共培养前,肝癌SMMC-7721细胞生长旺盛,细胞核与细胞质比例失调,见多个核分裂象;培养后,HSC-CM组肝癌SMMC-7721细胞的细胞核质比失调比例增大,异常核分裂象较前明显增多,且随共培养时间延长,此趋势逐渐明显。
2.2 HSC-CM组、LO2-CM组、1%FBS组肝癌SMMC-7721细胞增殖能力比较 见表1。

表1HSC-CM组、LO2-CM组、1%FBS组肝癌SMMC-7721细胞增殖能力比较(OD值)
由表1可见,共培养24、48、72h后,HSC-CM组、LO2-CM组、1%FBS组肝癌SMMC-7721细胞增殖能力比较差异有统计学意义(P<0.05);与LO2-CM组、1%FBS组比较,HSC-CM组肝癌SMMC-7721细胞增殖能力增强(均P<0.05);LO2-CM组肝癌SMMC-7721细胞增殖能力较1%FBS组增强(P<0.05)。
2.3 HSC-CM组、LO2-CM组、1%FBS组肝癌SMMC-7721细胞侵袭能力比较 见表2。

表2 HSC-CM组、LO2-CM组、1%FBS组肝癌SMMC-7721细胞侵袭能力(穿膜细胞数)比较(个)
由表2可见,HSC-CM组、LO2-CM组、1%FBS组肝癌SMMC-7721细胞侵袭能力比较差异有统计学意义(P<0.05);与 LO2-CM 组、1%FBS组比较,HSC-CM组肝癌SMMC-7721细胞侵袭能力增强(均P<0.05);LO2-CM组肝癌SMMC-7721细胞侵袭能力较1%FBS组增强(P<0.05)。
2.4 HSC-CM组、LO2-CM组、1%FBS组肝癌SMMC-7721细胞 PCNA、VEGF、NF-κB、MMP-2 蛋白表达水平比较 见图1-5。

图1 HSC-CM组、LO2-CM组、1%FBS组肝癌SMMC-7721细胞 PCNA、VEGF、NF-κB、MMP-2 蛋白电泳图比较

图2 HSC-CM组、LO2-CM组、1%FBS组肝癌SMMC-7721细胞PCNA蛋白表达水平比较(与1%FBS组比较,*P<0.05;与LO2-CM 组比较,△P<0.05)
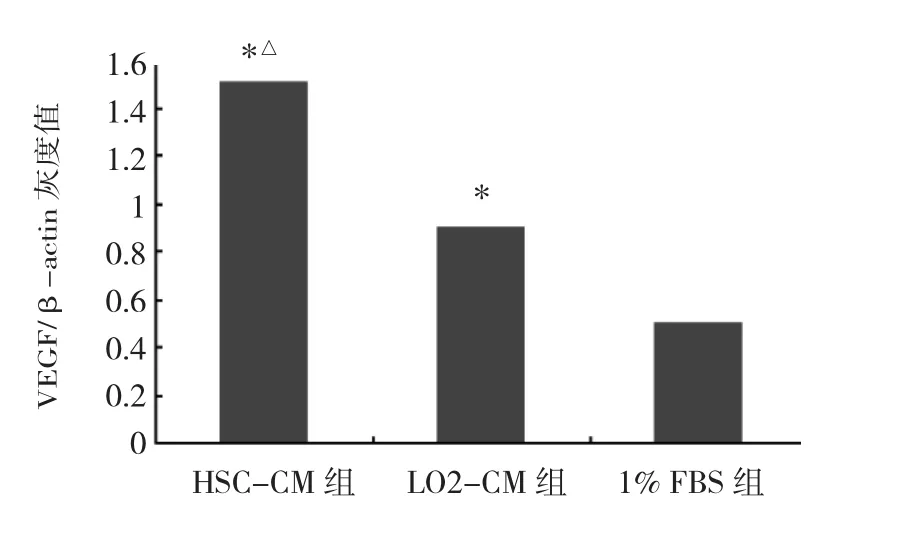
图3 HSC-CM组、LO2-CM组、1%FBS组肝癌SMMC-7721细胞VEGF蛋白表达水平比较(与1%FBS组比较,*P<0.05;与LO2-CM 组比较,△P<0.05)

图4 HSC-CM组、LO2-CM组、1%FBS组肝癌SMMC-7721细胞NF-κB蛋白表达水平比较(与1%FBS组比较,*P<0.05;与LO2-CM 组比较,△P<0.05)

图5 HSC-CM组、LO2-CM组、1%FBS组肝癌SMMC-7721细胞MMP-2蛋白表达水平比较(与1%FBS组比较,*P<0.05;与LO2-CM 组比较,△P<0.05)
由图1-5可见,HSC-CM组、LO2-CM组、1%FBS组肝癌 SMMC-7721 细胞 PCNA、VEGF、NF-κB、MMP-2蛋白表达水平比较差异均有统计学意义(均P<0.05);与 LO2-CM组、1%FBS组比较,HSC-CM组肝癌SMMC-7721细胞 PCNA、VEGF、NF-κB、MMP-2蛋白表达水平均上调(均P<0.05);LO2-CM组肝癌SMMC-7721细胞 PCNA、VEGF、NF-κB、MMP-2 蛋白表达水平较1%FBS组亦均上调(均P<0.05)。
3 讨论
正常肝组织中静息状态的肝星状细胞贮存体内80%的维生素A;当肝脏受到物理、化学、生物等因素的刺激后,肝星状细胞被激活,构成肿瘤间质的主要成分,间质细胞通过细胞外基质、肿瘤新生血管形成等,促进肿瘤实质的生长;实质细胞和间质细胞的共同作用是肝癌发生、发展的重要基础[3]。目前关于活化的肝星状细胞在原发性肝癌发生、发展过程中的作用及其机制研究也主要局限在转化生长因子β(TGF-β)和血小板衍生因子(PDGF)等方面[4]。Mikula 等[5]研究发现,相较于对照组裸鼠皮下共移植正常肝细胞和肝癌细胞,实验组中共移植活化肝星状细胞和肝癌细胞更易形成肿瘤,且实验组中肝癌细胞侵袭力更强。本研究主要通过体外间接共培养,观察了肝星状细胞对肝癌细胞增殖、侵袭的影响,旨在探究其可能机制。
恶性肿瘤侵袭、转移是多步骤、多因素的序贯过程,肿瘤细胞首先突破细胞外基质与基底膜,才能向邻近组织及远处脏器浸润转移[6]。MMP家族是恶性肿瘤侵袭、转移过程中最重要的蛋白水解酶,不仅能降解细胞外基质和基底膜,而且能促进肿瘤新生血管形成,维持肿瘤微环境的稳定,与肿瘤的侵袭、转移关系密切[7]。其中,Ⅳ型胶原酶(MMP-2和MMP-9)与肿瘤侵袭、转移关系最为密切[8];研究发现具有侵袭表型的肝癌细胞系能产生和活化高水平的MMP-2[9]。本研究通过Transwell侵袭试验,肝癌SMMC-7721细胞与HSC-CM间接共培养48h后发现,穿膜细胞数较LO2-CM组、1%FBS组增加,MMP-2蛋白的表达水平也较与LO2-CM组、1%FBS组上调。这提示肝星状细胞可能是通过上调MMP-2的表达从而加强肝癌细胞的侵袭能力。
NF-κB几乎存在于所有细胞中,是多种信号通路的交汇点。NF-κB主要通过抗凋亡、促增殖和免疫激活等功能促进肿瘤发生、发展;其中NF-κB/Rel家族在HBV和HCV介导的肝癌发生、发展过程中起重要作用,国人肝癌患者中80%合并HBV感染,NF-κB能激活炎症反应,激活后导致多种炎症介质转录水平增加(如TNF-α、IL-1β 等),炎症介质又正反馈调节 NF-κB,由此引发炎症级联反应,为肝细胞癌的发展提供潜在的微环境[10];NF-κB通过调节细胞黏附与血管生成等相关蛋白(VEGF及MMPs)转录结果的表达,影响肿瘤的侵袭、转移,通过上调NF-κB的活性可发现MMP-2等因子的表达明显上调,肿瘤的侵袭、转移能力明显增强[11]。
本研究采用CCK-8法测定细胞增殖,结果显示,与LO2-CM组、1%FBS组比较,HSC-CM组肝癌SMMC-7721细胞增殖能力增强;Western blot结果显示HSCCM组肝癌SMMC-7721细胞NF-κB及PCNA蛋白的表达水平也较LO2-CM组、1%FBS组明显上调,这与Thomas等[12]研究结果一致。笔者猜测活化的肝星状细胞对肝癌SMMC-7721细胞增殖及侵袭能力的影响主要通过调节特定信号通路过程中的转录结果,改变相应蛋白,如NF-κB、PCNA等的表达水平,最终实现促进肿瘤细胞增殖与抑制凋亡的双重干预效应。这与Thomas等[12]研究结果一致。肝癌主要为富血供肿瘤,VEGF是目前已知作用最强的促进肿瘤新生血管形成的血管生成因子[13]。肝癌细胞大量增殖,挤压肿瘤间质,使间质内微血管受挤、阻塞,局部血管缺氧,诱导肿瘤细胞分泌VEGF等血管生成因子,促进内皮细胞增生;内皮细胞能分泌大量的生长因子,促进肿瘤细胞增殖,肿瘤局部微血管密度增高,为肿瘤细胞增殖、侵袭提供充足的能量。肿瘤新生血管形成过程一旦启动,便不受机体制约,无限制地增生[14]。本研究通过CCK-8增殖及Transwell侵袭试验,显示出肝星状细胞能促进肝癌细胞的增殖,并增强其侵袭能力;Western blot实验结果显示HSC-CM组肝癌SMMC-7721细胞VEGF蛋白表达水平较LO2-CM组、1%FBS组上调。
综上所述,本研究结果显示,活化的肝星状细胞可促进肝癌SMMC-7721细胞增殖、侵袭等生物学行为,其作用机制可能与上调 PCNA、VEGF、NF-κB、MMP-2表达水平有关。
[1]肖蕾,杨颖,毛睿,等.用于肝癌诊断和预后的新型肿瘤分子标志物[J].癌症进展,2012,10(2):141-144.
[2]Atzori L,Poli G,Perra A.Hepatic stellate cell:a star cell in the liver[J].Int J Biochem Cell Biol,2009,4l(8-9):1639-1642.
[3]Witz IP,Levy-Nissenbaum O.the tumor microenvironment in the post-PAGET era[J].Cancer Lett,2006,242(1):1-10.
[4]Yoshida K,Matsuzaki K.Differential regulation of TGF-beta/Smad signaling in hepatic stellate cells between acute and chronic 1iver injuries[J].Front Physiol,2012,3(3):53.
[5]Mikula M,Proell V,Fischer AN,et al.Activated hepatic stellate cells induce tumor progression of neoplastic hepatocytes in a TGF-β dependant fashion[J].J Cell Physiol,2006,209:560-567.
[6]Edge SB,Byrd DR,Compton CC,et al.AJCC cancer staging manual[M].7th ed.New York:Springer,2010.
[7]Bauvois B.New facets of matrix metalloproteinases MMP-2 and MMP-9 as cell surface transducers:Outside-in signaling and relationship to tumor progression[J].Biochim Biophys Aeta,2011,1825(1):29-36.
[8]Yeh HC,Lin SM,Chen MF,et al.Evaluation of serum matrix metalloproteinase (MMP)-9 to MMP-2 ratio as a biomarker in hepatocellular carcinoma[J].Hepatogastroenterology,2010,57(97):98-102.
[9]Giannelli R,Bergamini C,Fransvea E,et al.Human hepatocellar carcinoma(HCC)cells require both alpha3 betal integrin and matrix metalloproteinases activity for migration and invasion[J].Lab Invest,2001,81(4):613-627.
[10]Vallabhapurapu S,Karin M.Regulation and function of NF-κB transcription factors in the immune system [J].Ann Rev Immunol,2009,27(1):693-733.
[11]胡海燕,邹典斌,孙惠,等.NF-κB与肿瘤细胞增殖及转移关系的研究进展[J].生命科学,2003,15(5):293-298.
[12]Thomas A,Frauke B,Thilo S,et al.Blackwell Publishing Asia Activated hepatic stellate cells promote tumorigenicity of hepatocellular carcinoma[J].Cancer Sci,2009:1-8.
[13]Davies EJ,Blackhall FH,Shanks JH,et al.Distribution and clinical significance of heparin sulfate proteoglycans in ovarian cancer[J].Clin Cancer Res,2004,10(15):5178-5186.
[14]Kerbel RS.Tumor angiogenesis:past,present and the near future[J].Carcinogenesis,2000,21(3):505-515.

