海参胶原低聚肽对抗结核药物性肝损伤改善效果
陈 娅,蔡 静,李 勇,马爱国
(1青岛大学公共卫生学院,山东青岛 266021;2北京大学公共卫生学院,北京 100191)
肝毒性药物,包括非甾体类抗炎药、抗感染药物、抗肿瘤药物、激素类药物、某些生物制剂等[1]。利福平和异烟肼作临床治疗肺结核的一线药物,具有潜在的肝毒性。在我国,水飞蓟宾已作为包括药物性肝损伤在内的多个指南的推荐用药[2]。由于药物性肝损伤的机制复杂,多是多种机制共同作用的结果,且保肝药物本身也会有不良反应,可能会加重肝脏的负担,因此对临床的保肝治疗争议不断[1-3]。
近年来,营养干预越来越受到人们的关注,已有大量的研究表明,天然食品的成分中具有抗氧化、免疫、抗炎等功效。肽的市场前景非常大,截至2016年2月,美国食品和药物管理局(FDA)批准了60多种多肽药物[4],超过400种肽疗法在临床前或临床试验阶段[5]。目前已经可以从动物、植物、微生物中提取具有生物活性的肽。海参是一种丰富的海洋资源,海参干体壁含有多种生物活性物质和营养物质[6-7],它还含有多种维生素(维生素A、B1、B2、B3)和矿物质(尤其是钙、镁、铁、锌等)[7]。海参肽是一种经生物酶解得到的以小分子短链肽为主、多种功效成分共存的蛋白质水解产物,具有使用稳定性好、便于机体的消化吸收、毒副作用小、使用安全等优点,且具有抗氧化、免疫调节、抗菌抗肿瘤等生物活性[8-9]。已有研究表明,海参提取物对非药物性肝损伤具有一定的保护作用,但未见其对药物性肝损伤作用的相关研究。本研究拟通过利福平和异烟肼灌胃建立大鼠肝损伤模型,探讨补充海参胶原低聚肽对利福平和异烟肼所致大鼠肝损伤的作用,为开发海参胶原低聚肽的临床应用奠定基础。
1 材料与方法
1.1 材料及仪器
海参胶原低聚肽(SCCOPs),淡黄色粉末,利用生物酶解技术从海参中提取的小分子生物活性肽,由吉林肽谷生物工程有限责任公司提供,使用时按浓度以蒸馏水配制溶液进行灌胃。
利福平胶囊和异烟肼片,沈阳红旗制药有限公司;超氧化物歧化酶、丙二醛试剂盒、过氧化氢酶试剂盒、谷胱甘肽试剂盒、考马斯亮蓝蛋白定量测试试剂盒,南京建成生物工程研究;3K30型低温离心机,美国Sigma公司;ELx808型酶标仪,美国BioTek公司;7 500cx型电感耦合等离子质谱仪,ICP-MS,美国Agilent公司;7600型全自动生化分析仪,日本日立公司;普通光学显微镜,日本Olympus公司。
1.2 实验方法
1.2.1 动物及分组 SPF 级Wistar雄性大鼠72只,4w龄,体质量200±20g,购自山东鲁抗医药股份有限公司,动物合格证号:SCXK (鲁)20140007。
大鼠适应性喂养1w后,按体质量随机分为6组,每组12只,分别为正常对照组(A)、模型组(B)、阳性对照组(C)、海参肽低剂量组(D)、海参肽中剂量组(E)和海参肽高剂量组(F)。除A组给予0.9%生理盐水(20mg/kg)外,其余5组分别给予异烟肼+利福平各50 mg/kg·BW,2h后,A、B组给予灌胃等体积生理盐水,C组给予水飞蓟宾22.1mg/kg·BW,D组给予SCCOPs 346 mg/kg·BW,E组给予SCCOPs 692 mg/kg·BW,F组给予SCCOPs 1 038 mg/kg·BW。实验周期为4w,所有组都喂养普通饲料和清水,保持笼内环境整洁。每周称量体质量,并观察大鼠生存情况。
1.2.2 样品采集与处理 于适应性喂养1w后,禁食12 h,断尾取血,3 000 r/min离心10 min分离血清,-80 ℃冰箱保存备用。实验2w后,再次禁食12 h,断尾取血,3 000 r/min离心10 min分离血清,-80 ℃冰箱保存备用。4w实验结束,禁食12 h,3%戊巴比妥钠0.3 mL/kg腹腔麻醉,腹主动脉取血,3 000 r/min离心10 min分离血清和血浆,-80 ℃冰箱保存备用。完整分离肝脏并称重,计算肝脏指数。取肝脏大叶组织进行固定用于观察形态结构,剩余组织于-80 ℃冰箱保存备用。
1.2.3 血清ALT、AST、ALP测定 用全自动生化分析仪测量每组大鼠血清中的谷氨酸氨基转氨酶(ALT)、天冬氨酸氨基转氨酶((AST)、碱性磷酸酶(ALP)。
1.2.4 肝脏组织形态结构观察及组织学评分 采用HE染色法,将肝脏用10%中性甲醛固定后,常规石蜡包埋,切片,脱蜡,HE染色,中性树胶封片,光学显微镜(×200)下观察各组大鼠肝脏组织形态结构改变。组织病理学评分标准参考文献[10-11]。
1.2.5 肝脏系数 完整分离动物肝脏后,用生理盐水冲洗表面血污,滤纸吸干,称重,计算肝脏指数。
肝脏指数(%)=肝重(g)/体重(g)×100
(1)
1.2.6 大鼠肝组织中氧化应激指标测定 采用考马斯亮蓝法测定肝组织蛋白浓度、用丙二醛(MDA)试剂盒测定大鼠肝匀浆脂质过氧化情况、用超氧化物歧化酶(SOD)试剂盒测定大鼠肝匀浆抗氧化能力、用过氧化氢酶(CAT)试剂盒测定大鼠肝匀浆抗氧化能力、用谷胱甘肽(GSH)试剂盒测定大鼠肝匀浆抗氧化能力。
1.3 统计分析

2 结果与分析
2.1 血清ALT、AST、ALP测定
4w实验后,各组大鼠血清ALT、AST、ALP变化情况见表1。与正常对照组相比,模型组的血清ALT和ALP水平均升高(P<0.05),分别升高了6.46%和17.70%,而AST水平也有升高,但无显著差异(P>0.05);与模型组相比,海参低聚肽各剂量组和水飞蓟宾组的ALT水平分别降低了28.89%、27.77%、18.56%和25.36%,ALP水平分别降低了14.84%、24.78%、21.08%和21.00%,差异均有显著性(P<0.05),而各干预组的血清AST水平也都有所下降,但无显著性(P>0.05)。

表1 各组实验大鼠血浆ALT、AST和ALP水平
注:a与A组比较,P<0.05;b与B组比较,P<0.05
2.2 肝脏组织形态结构观察及组织学评分
4w实验后,HE染色结果显示,在相同放大倍数光学显微镜下观察发现,正常对照组大鼠肝脏组织无损伤改变,肝索排列整齐,无炎性浸润;与正常对照组相比,模型组大鼠肝脏组织以中央静脉周围的中度和重度肝细胞变性为特征,呈现大部分肝细胞浊肿变性,分界不清;肝小叶排列不齐,肝窦道受压变窄;肝脏组织脂肪变性广泛,伴有炎性细胞浸润。与模型组相比,海参低聚肽组与水飞蓟宾组干预能显著改善上述病变,肝细胞损伤明显减轻,肝小叶结构也有所恢复,肝窦道排列整齐,部分可见脂肪变性(附图)。

附图 各组实验大鼠肝脏组织病理学变化(HE染色,×200)A正常对照组;B模型组;C水飞蓟宾组;D海参肽低剂量组;E海参肽中剂量组;F海参肽高剂量组
通过光学显微镜下观察,对肝组织切片进行数值分级,评估肝组织损伤的病理学程度。在组织病理学检查中,可通过观察肝细胞坏死、脂肪变性、透明变性、气球样变性、Kupffer细胞和淋巴细胞浸润的范围来评估损伤程度(表2)。
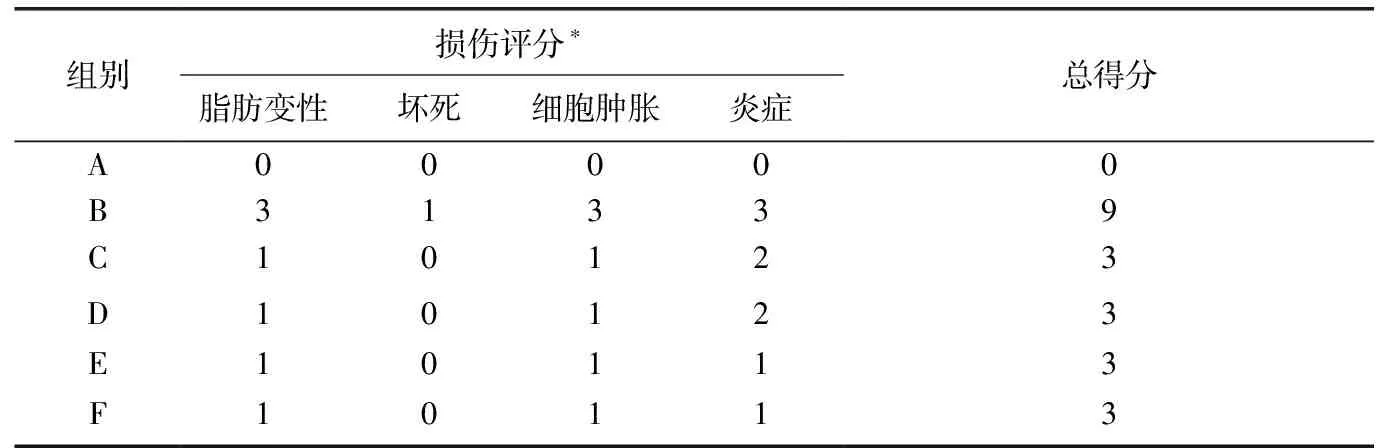
表2 各组实验大鼠肝脏组织损伤评分
注:*肝损伤通过光镜观察进行评分:0分=无可见细胞损伤、1分=灶性肝细胞损伤小于25%的组织、2分=肝组织中25%~50%的局灶性肝细胞损伤、3分=广泛但局限性肝细胞病变、4分=肝细胞整体坏死
2.3 肝脏指数
4w实验后,正常对照组、模型组、阳性药物组及低、中、高剂量组大鼠肝脏指数分别为2.86%±0.25%、3.28%±0.15%、2.86%±0.23%、2.98%±0.29%、2.83%±0.21%、2.92%±0.27%,组间有差异(P<0.01)。进一步两两比较发现,与正常对照组相比,模型组大鼠的肝脏指数升高(P<0.05);与模型组相比,中高剂量组和阳性药物组的肝脏指数降低(P<0.05)。
2.4 大鼠肝组织中氧化应激指标测定
4w实验后,与正常对照组相比,模型组大鼠肝匀浆MDA平均含量升高了25.17%(P<0.05),SOD活性降低了5.44%(P<0.05),CAT、GSH活性也有降低,但无显著差异(P>0.05)。与模型组相比,海参低聚肽各剂量组和水飞蓟宾组MDA含量有所降低,但无显著性(P>0.05);水飞蓟宾组的SOD、GSH活性显著增强(P<0.05),分别上升了14.14%、12.70%,但是中高剂量的海参低聚肽SOD活性却降低(P<0.05),海参低聚肽各剂量组CAT和GSH活性有所上升,但无显著性(P>0.05)(表3)。
3 讨论
抗结核药物引起的肝毒性具有严重的毒副作用,且利福平和异烟肼联用对药物性肝损伤具有协同作用[12-14]。

表3 各组实验大鼠肝组织MDA含量、SOD活性、CAT活性、GSH活性
注:a与A组比较,P<0.05;b与B组比较,P<0.05。MDA:丙二醛;SOD:总超氧化物气化酶;CAT:过氧化氢酶;GSH:谷胱甘肽
本研究拟通过利福平和异烟肼灌胃建立大鼠肝损伤模型,给药剂量参考Baskaran[15],利福平和异烟肼的给药剂量均定为50mg/(kg·d)。这与肺结核患者接受治疗时服药剂量相近,灌胃的方法与人类通常给药方式相同,持续4w。
血清ALT、AST和ALP是肝损伤最常用的生化标志物。血清转氨酶活性一直被认为是肝损伤的敏感指标。肝细胞的损伤改变了它们的运输功能和肝细胞膜通透性,导致肝细胞内的酶被释放到血液循环中。因此,血清中高表达的AST和ALT表明肝细胞膜受到损害。所以肝损伤的生化结果表现为ALT、AST和ALP水平升高。本实验中,模型组大鼠血清ALT、AST和ALP含量高于正常对照组,表明大鼠药物性肝损伤模型建立成功,且模型组大鼠的肝脏出现了病理损伤;与模型组相比,阳性药物组和海参低聚肽各剂量组的血清ALT、ALP含量均有所下降。可见大鼠肝功能有所改善,海参低聚肽表现出一定的活性。这一结果与王寅等[16]研究结果一致。
HE染色结果以及组织学评分显示,机体长期联合用抗结核药物可引起肝损伤,而海参低聚肽组能改善上述病变,如肝细胞肿胀、炎细胞浸润、脂肪变性等。上述结果表明,海参低聚肽通过保护肝细胞和减少潜伏性、渐进性炎症损伤而抑制利福平和异烟肼联用引起的药物性肝损伤。同时,肝脏指数作为反应肝组织肿胀严重程度的指标,与正常对照组相比,模型组大鼠的肝脏指数升高;与模型组相比,中高剂量组和阳性药物组的肝脏指数降低,说明海参低聚肽能减轻药物性肝损伤。这与国内外学者研究结果一致。Esmat等[17]研究发现,海参提取物能够降低大鼠硫代乙酰胺中毒引起的血清转氨酶升高,病理切片结果也显示有所改善。王丹等[18]也发现,海参提取物对脂肪肝具有保护作用。
另外,肝细胞具有许多抗活性自由基的酶防御机制,抗氧化酶活性的测定是评价抗氧化防御状态的一种间接方法[19]。研究发现,利福平和异烟肼联用,对通过损伤细胞膜、增加脂质过氧化作用的内源性酶促氧化-抗氧化失衡、增强CYP2E1介导的生物活化机制而导致的肝毒性有协同作用,能降低SOD、CAT和GSH的活性,生成包括MDA在内的脂质过氧化产物,导致严重后果[20-21]。因此,抗氧化酶在解毒方面也起着重要的作用。本次试验中,与正常对照组相比,模型组的MDA含量升高,SOD、CAT、GSH活性降低,这说明利福平和异烟肼能引起细胞脂质过氧化增强,细胞清除自由基的能力下降,细胞氧化与抗氧化系统失衡。与模型组相比,水飞蓟宾组与海参低聚肽各组的SOD、CAT、GSH、MDA水平均有改善的趋势,但是改变并不显著,仍需进一步的实验证实。
综上所述,海参胶原低聚肽可以改善利福平和异烟肼联用所致的药物性肝损伤,为药物性肝损伤治疗中的潜在临床应用提供科学依据。但是有关海参肽对人体保健作用的研究还比较少,其具体机制和功能学评价还需进一步实验探讨。◇
[1]中华医学会肝病学分会药物性肝病学组.药物性肝损伤诊治指南 [J]. 中华肝脏病杂志,2015,23(11):1752-1769.
[2]邵爽,刘春燕,高沿航.水飞蓟宾治疗药物性肝损伤的研究进展 [J]. 临床肝胆病杂志,2017,33(6):1179-1182.
[3]钱锡芬,马雪莲.不同保肝药物预防性治疗对抗结核药所致肝损伤的影响 [J]. 实用临床医药杂志,2016,20(17):67-70.
[4]Fosgerau K,Hoffmann T.Peptide therapeutics:current status and future directions [J]. Drug Discovery Today,2015,20(1):122-128.
[5]Ghosh S.Peptide therapeutics market:advancements in the field of Synthetic Peptides and emergence of prominent biopharmaceutical companies are fuelling the growth:global industry analysis and opportunity assessment,2015—2025[J].Future Market Insights,2016.
[6]Oliveracastillo L P Rezvega J G Mezruiz J á,et al.Release of bioactive peptides by simulated gastrointestinal digestion of sea cucumber protein (Isostichopus Badionotus)[J]. 2011.
[7]Sara B,Farooq A,Nazamid S.High-value components and bioactives from sea cucumbers for functional foods--a review [J]. Marine Drugs,2011,9(10):1761-1805.
[8]何丽霞,李勇.海参肽生物学功能研究进展 [J]. 食品科学,2015,36(9):215-218.
[9]Chen J,Ren Y,Wang G,et al.Dietary supplementation of biofloc influences growth performance,physiological stress,antioxidant status and immune response of juvenile sea cucumber Apostichopus japonicus (Selenka)[J]. Fish & Shellfish Immunology,2018,72:143-152
[10]French S W,Miyamoto K,Ohta Y,et al.Pathogenesis of experimental alcoholic liver disease in the rat [J]. Methods & Achievements in Experimental Pathology,1988,13(13):181-207.
[11]Kieiner D E.The histopathological evaluation of drug-induced liver injury[J]. Histopathology,2017,70(1):81-93.
[12]Vidyasagar R,Aithal G P.Hepatotoxicity related to anti-tuberculosis drugs:mechanisms and management [J]. Journal of Clinical & Experimental Hepatology,2013,3(1):37-49.
[13]Metushi I G,Cai P,Zhu X,et al.A fresh look at the mechanism of isoniazid-induced hepatotoxicity [J]. Clinical Pharmacology & Therapeutics,2011,89(6):911-914.
[14]Nakajima A,Fukami T,Kobayashi Y,et al.Human arylacetamide deacetylase is responsible for deacetylation of rifamycins:Rifampicin,rifabutin,and rifapentine [J]. Biochemical Pharmacology,2011,82(11):1747-1756.
[15]Baskaran U L,Sabina E P.The food supplement coenzyme Q10 and suppression of antitubercular drug-induced hepatic injury in rats:the role of antioxidant defence system,anti-inflammatory cytokine IL-10 [J]. Cell Biology & Toxicology,2015,31(4-5):211-219.
[16]王寅,李园园,郝海波,等.干酪乳杆菌对利福平和异烟肼联用所致大鼠肝损伤的保护作用 [J]. 中国防痨杂志,2017,39(6):614-619.
[17]Esmat A Y,Said M M,Soliman A A,et al.Bioactive compounds,antioxidant potential,and hepatoprotective activity of sea cucumber (Holothuria atra)against thioacetamide intoxication in rats [J]. Nutrition,2013,29(1):258-67.
[18]王丹,丁琳,董平,等.海参皂苷对脂肪肝大鼠胆固醇代谢的调节作用 [J]. 营养学报,2016,38(1):67-70.
[19]Dakrory A I,Fahmy S R,Soliman A M,et al.Protective and curative effects of the sea cucumber holothuria atra extract against DMBA-induced hepatorenal diseases in rats [J]. Biomed Research International,2015.
[20]Dai N,ZOou Y,Zhu L,et al.Antioxidant properties of proanthocyanidins attenuate carbon tetrachloride (CCl4)-induced steatosis and liver injury in rats via CYP2E1 regulation [J]. Journal of Medicinal Food,2014,17(6):663-69.
[21]Shih T Y,Young T H,Lee H S,et al.Protective effects of kaempferol on isoniazid- and rifampicin-induced hepatotoxicity [J]. Aaps Journal,2013,15(3):753-762.

