辅酶Q10和维生素E配伍的抗氧化作用研究
孙红梅,罗 蓉,徐 东
(1安利(中国)日用品有限公司,广州 510613;2北京联合大学,北京 100191)
辅酶Q10具有增强免疫力、缓解体力疲劳和清除自由基等作用[1-3]。维生素E在动物和人体的抗氧化过程中发挥着重要作用[4-5]。实验研究表明,辅酶Q10和维生素E具有显著提高机体抗氧化和缓解体力疲劳等功能[6-7]。褪黑素和维生素E、维生素C联用能明显增强抗氧化作用[8]。胡萝卜素和维生素E联用比单独用类胡萝卜素的效果更好等[9]。本文在辅酶Q10和维生素E配伍的稳定性和食用安全性研究基础上[10],通过动物实验研究辅酶Q10和维生素E软胶囊的抗氧化作用,为开发维生素E、辅酶Q10抗氧化产品提供参考。
1 材料和方法
1.1 样品描述
受试物由安利(中国)日用品有限公司提供,主要由辅酶Q10和维生素E为原料制成,内容物为粘稠状红色液体的软胶囊,塑料瓶装,样品核准内容物的净含量是0.414g/粒,60粒/瓶。人体推荐日服量为每天1粒,即0.414g/60kg·BW。冷藏或贮存于30℃以下的阴凉干燥处,保存期24个月,受试样品用玉米油配制。
1.2 实验动物
选用中国食品药品检定研究院[许可证号:SCXK-(京)2009-0017]繁殖的SPF级8月龄昆明种雌性小鼠共40只。实验动物饲养于北京联合大学应用文理学院保健食品功能检测中心SPF级动物室。实验动物使用许可证号:SYXK(京)2012-0031。选用北京华阜康生物科技股份有限公司[许可证号:SCXK(京)2009-0008]生产的维持饲料。
1.3 剂量
按照人体推荐量的5、10、30倍,即每日0.034、0.069、0.207g/kg·BW,设低、中、高3个剂量组。受试样品用玉米油配制。每日1次经口给予,连续灌胃45d后检测各项指标。小鼠灌胃体积为0.1mL/10g鼠重。同时设1个空白对照组(0g/kg·BW),用玉米油代替受试样品,每日灌胃体积与受试样品各剂量组相同。
1.4 仪器与试剂
1.4.1 仪器 UV2450分光光度计(2004001)、BS223S电子天平(2008007)、ES-1000E电子天平(2003004)、H2F-B3000电子天平(2013002)、80-2型台式离心机(2001001)、Elx808酶标仪(2008001)、恒温水浴锅(2004009)、高速离心机(2012001)。
1.4.2 试剂 超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、蛋白质羰基(CPP)试剂盒、还原性谷胱甘肽(GSH)试剂盒、考马斯亮蓝测定试剂盒和双缩脲蛋白测定试剂盒(均由南京建成生物工程研究所生产),8-表氢氧-异前列腺素(8-ISO-PG)酶联免疫试剂盒。
1.5 实验方法
取SPF 级8月龄昆明种雌性小鼠40只,按体重随机分为4组,每组10只,空白对照组,受试样品为低、中、高剂量组0.034、0.069、0.207g/kg·BW,每日灌胃1次,连续45d。实验结束时,取小鼠血清及肝组织,测定血清中丙二醛(MDA)和8-表氢氧-异前列腺素(8-ISO-PG)的含量,肝组织中蛋白质羰基含量(PCC)、血清超氧化物歧化酶(SOD)活力、全血中谷胱甘肽过氧化物酶(GSH-Px)活力及还原性谷胱甘肽(GSH)含量[11]。
1.6 数据处理
2 结果与分析
2.1 血清中丙二醛(MDA)含量测定
由表1可见,经口给予小鼠不同剂量的受试样品45d后,与空白对照组间比较,血清MDA含量在0.069g/kg·BW剂量组有显著差异(P<0.05),血清MDA含量在0.207g/kg·BW剂量组有极显著差异(P<0.01),即该受试样品在中、高剂量组均能降低小鼠的血清MDA含量。
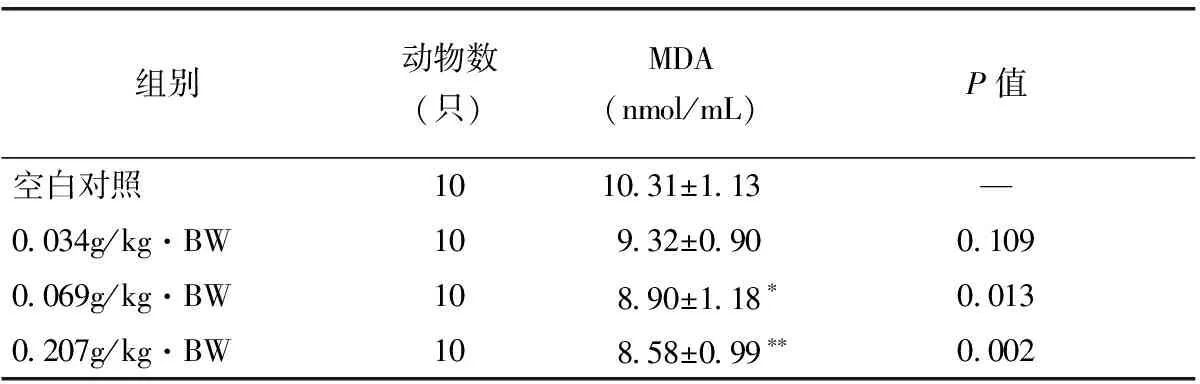
表1 小鼠血清MDA含量测定结果
注:*与空白对照组比较,有显著性差异;**与空白对照组比较有极显著性差异
2.2 8-表氢氧-异前列腺素含量(8-ISO-PG)测定
由表2可见,经口给予小鼠不同剂量的受试样品45d后,与空白对照组间比较,8-ISO-PG含量在0.207g/kg·BW剂量组有显著差异(P<0.05),即该受试样品在高剂量组能降低8-ISO-PG含量。
2.3 肝组织蛋白质羰基(PCC)含量测定结果和分析
由表3可见,经口给予小鼠不同剂量的受试样品45d后,其肝组织PCC含量在实验各剂量组均无明显变化,与空白对照组间比较,差异均无显著性(P>0.05),即该受试样品在各剂量组均不能降低肝组织PCC含量。

表2 小鼠8-ISO-PG含量测定结果
注:*与空白对照组比较,有显著性差异

表3 小鼠肝组织PCC含量测定结果
2.4 血清超氧化物歧化酶(SOD)活力测定
由表4可见,经口给予小鼠不同剂量的受试样品45d后,其血清SOD活力在实验各剂量组均无明显变化,与空白对照组间比较,差异均无显著性(P>0.05),即该受试样品在各剂量组均不能提高血清SOD活力。

表4 小鼠血清SDD活力测定结果
2.5 全血中谷胱甘肽过氧化物酶(GSH-Px)活力测定
由表5可见,经口给予小鼠不同剂量的受试样品45d后,与空白对照组间比较,小鼠全血GSH-Px活力在0.069g/kg·BW剂量组和0.207g/kg·BW剂量组有极显著性差异(P<0.01),即该受试样品在中、高剂量组均能提高小鼠全血GSH-Px活力。
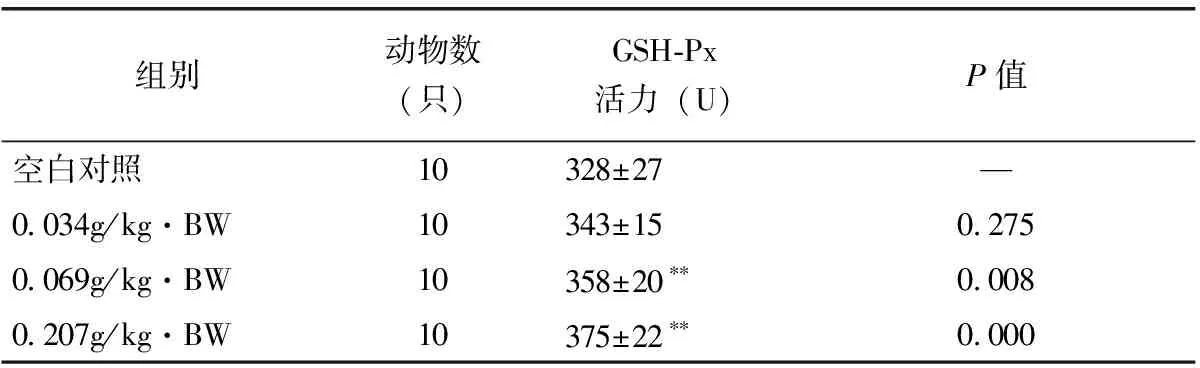
表5 小鼠全血GSH-Px活力测定结果
注:**与空白对照组比较,有极显著性差异
2.6 肝组织还原型谷胱甘肽(GSH)含量测定
由表6可见,经口给予小鼠不同剂量的受试样品45d后,与空白对照组间比较,小鼠肝组织GSH含量在0.207g/kg·BW剂量组有显著性差异(P<0.05),即该受试样品在高剂量组能提高小鼠肝组织GSH含量。
2.7 受试样品对小鼠体重的影响
由表7可见,小鼠给予受试样品前后,与空白对照比较,各剂量组小鼠体重的差异均无显著性(P>0.05),表明该受试样品对小鼠的体重无不良影响。

表6 小鼠肝组织GSH含量测定结果
注:*与空白对照组比较,有显著性差异
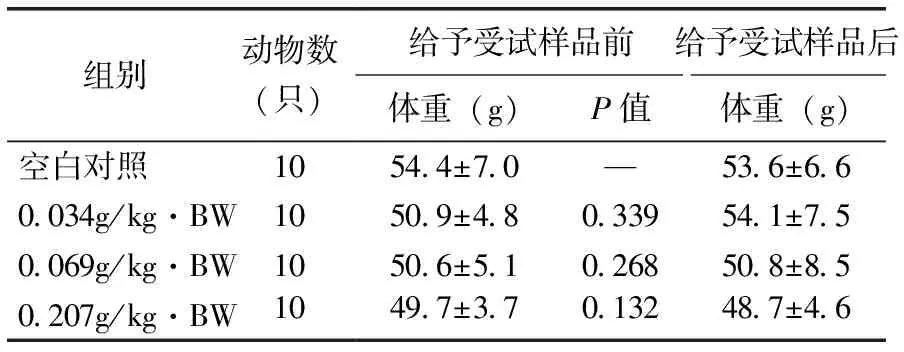
表7 受试样品对小鼠体重的影响
3 讨论
由实验结果可见,服用以辅酶Q10和维生素E为原料制成的软胶囊45d后,与空白对照组比较,受试样品的中、高剂量组能够降低小鼠血清丙二醛含量(P<0.05),提高全血谷胱甘肽过氧化物酶活力(P<0.01);高剂量组还可以降低血清8-表氢氧-异前列腺素含量(P<0.05),提高肝组织还原型谷胱甘肽含量(P<0.05);并且受试样品各剂量组均对小鼠体重增长无不良影响。从而说明辅酶Q10和维生素E软胶囊具有明显抗氧化作用,且对小鼠体重增长无不良影响。但是辅酶Q10和维生素E软胶囊对人体的抗氧化作用还有待进一步研究。◇
[1]陈玉满,鹿伟,陈苘,等.辅酶Q10对不同性别小鼠缓解体力疲劳作用的实验研究[J].中国卫生检验杂志,2014,3(6):794-796.
[2]薛建安,王可莉,魏敏吉.辅酶Q10的抗氧化与抗疲劳作用及临床应用[J].中国医药导刊,2014,16(7):1167-1168.
[3]袁根泉,蒋丽,殷光玲,等.辅酶Q10软胶囊增强免疫力功能的试验研究[J].食品研究与开发,2014,4(8):111-114.
[4]贺瑞坤,殷光玲,黄远英.小麦胚芽油维生素E 软胶囊抗氧化功效研究[J].生物技术世界,2016(1):14-18.
[5]仓宝成,宫璀璀,王莉,等.维生素E 在体内外具有抗氧化作用[J]. 基础医学与临床,2016,36(1):80-84.
[6]孔维佳,韩月臣,王莹,等.维生素E和辅酶Q10对大鼠内耳组织线粒体DNA4834bp缺失突变的预防作用[J].中华耳鼻喉科杂志,2004,39(12):707-711.
[7]王虹玲,武婷茹,战秀梅.辅酶Q10抗氧化性及应用研究进展[J].食品研究与开发,2015(19):188-190.
[8]Dreher F,Gabard B,Schwindt DA,et al.Topical melatonin in combination with vitamins E and C protects skin from ultraviolet-inducederythema:a human study in vivo[J].Br J Dermatol,1998,139(2):332-339.
[9]Stahl W,Hein rich U,Jungmann H,et al.Carotenoids andcarotenoids plus vitamin E protect against ultraviolet light-inducederythema in humans [J]. Am J ClinNutr,2000,71(3):795-798.
[10]孙红梅,罗蓉,李冬梅.辅酶Q10和维生素E配伍的稳定性和食用安全性研究[J].中国食物与营养,2016,22(6):17-20.
[11]国家食品药品监督管理局.抗氧化功能检验方法[S].2012:107.

