penA和mtrR基因突变在体外诱导淋球菌对头孢曲松耐药作用的研究
其木格 董磊 张秀丽 张立忠 李艳飞 王杰
010017呼和浩特,内蒙古自治区人民医院皮肤科(其木格、张秀丽、张立忠、李艳飞、王杰);内蒙古医科大学研究生院[董磊(现在郑州大学附属郑州中心医院皮肤科)]
头孢曲松是治疗淋病的一线药物,但近年来对头孢曲松敏感性下降或耐药的淋球菌在全球多个国家和地区出现[1-3],亦有数个头孢曲松治疗咽部淋球菌感染失败的报道[4-5]。我国目前尚无头孢曲松耐药相关的淋病治疗失败报道,但头孢曲松低敏的淋球菌阳性率逐年升高[6-7]。淋球菌对头孢菌素低敏或耐药的分子机制涉及青霉素结合蛋白2基因(penA)、调节MtrCDE外排泵功能的基因(mtrR)、孔蛋白基因(porB/penB)、青霉素结合蛋白1基因(ponA)以及pilQ基因等在内的多个耐药基因决定子以及其他未知的耐药基因,其中编码青霉素结合蛋白2(PBP2)转肽酶的penA基因突变起主导作用[8]。为进一步探讨penA和mtrR基因突变在淋球菌对头孢曲松耐药机制中的作用,我们通过对原代及子代耐药淋球菌株penA和mtrR基因测序,了解靶位基因突变与菌株耐药的关系。
一、材料与方法
1.菌株来源:所用4株淋球菌均由中国医学科学院皮肤病研究所性病实验室提供,体外次抑菌浓度诱导头孢曲松耐药过程亦在该实验室完成。1株为标准菌株ATCC-49226(头孢曲松敏感菌株),3株为临床分离株,分别为头孢曲松低敏菌株(2012-5616)、头孢曲松敏感菌株(2012-4052和2012-15361)。4株菌均经糖发酵试验确认,药物敏感性试验已在前期完成[9],菌株的药物敏感性特征见表1。
2.主要试剂:头孢曲松钠标准粉为美国Sigma公司产品,淋球菌培养基GC基础粉和增菌剂(1%IsoVitaleX)均为美国BD公司产品,淋球菌氧化酶、DNA提取液、PCR试剂、引物等由生工生物工程(上海)股份有限公司提供,基因测序由北京博迈德基因技术有限公司完成。
3.体外次抑菌浓度诱导试验:将选取的4株试验菌株进行头孢曲松体外次抑菌浓度(1/2最低抑菌浓度,1/2 MIC)诱导,在36℃、5%CO2及80%湿度条件的培养箱中培养,24 h时于抗生素培养基转种传代1次,待菌株生长稳定后,连续传代培养,MIC浓度依次递增为1/2、1、2、4、8、16……直至最后1次的培养基上有菌落稳定生长(MIC≥1 mg/L)。在无抗生素培养基中继续传代培养耐药突变菌株,研磨洗脱于20%甘油的胰酶大豆肉汤冻存培养基中,-70℃冰箱保存备用。
4.penA和mtrR基因引物:采用Lee等[10]设计的引物,penA基因片段较长,将其分成3个片段penA-1、penA-2和penA-3,测序后再用基因软件DNAStar进行拼接分析。引物序列见表2。
5.penA和mtrR基因测序:提取诱导前原代菌株及诱导后子代耐药菌株的DNA进行PCR扩增,反应总体系50 μl,其中缓冲液5 μl,dNTP 1 μl,正反向引物各1 μl,DNA模板1 μl,DNA聚合酶(Taq酶)0.3 μl,双蒸水 41 μl;反应条件:95℃预变性1 s,94℃变性30 s,50℃退火30 s,72℃延伸1 min,共35个循环。扩增产物以1.5%琼脂糖凝胶电泳,凝胶成像系统观察并照相。之后将ATCC-49226、2012-5616、2012-4052、2012-15361菌株诱导前后的原代和子代耐药株的DNA扩增产物纯化后进行测序。

表1 研究所用4株淋球菌菌株的药物敏感性

表2 penA和mtrR基因引物序列
二、结果
1.4株耐药淋球菌的PCR结果:ATCC-49226、2012-5616、2012-4052、2012-15361菌株诱导前后均有目的基因表达,penA基因分段扩增出的阳性片段长度分别为620、580和870 bp,mtrR基因为400 bp。见图1。
2.体外次抑菌浓度诱导试验结果:ATCC-49226从1/2 MIC诱导至64 MIC产生耐药共诱导了28代,临床低敏菌株2012-5616诱导至4 MIC共传代了26代,临床敏感菌株2012-15361诱导至16 MIC共传代了36代,临床敏感菌株2012-4052诱导至16 MIC共传代了22代。见表3。

图 1 淋球菌株 ATCC-49226、2012-5616、2012-4052、2012-15361诱导耐药前后penA和mtrR基因凝胶电泳图 -:阴性对照;M:标准参照物
3.基因测序结果:
(1)penA基因测序结果:ATCC-49226诱导耐药前PBP2序列为标准序列,2012-5616、2012-4052、2012-15361菌株诱导前后以及ATCC-49226诱导后耐药菌株的PBP2序列都是ⅩⅧ序列(含A501T和G542S);ATCC-49226诱导耐药后在penA编码区发生A501T、G542S突变,另3株菌诱导后penA基因均未出现新的突变位点;未检测到penA镶嵌状结构模式。penA基因测序获得的波形图符合标准基因测序分析的要求。见图2。
(2)mtrR基因测序结果:2012-5616和ATCC-49226菌株在诱导前后均为A39T突变模式,2012-15361菌株诱导前后均无突变,2012-4052诱导后耐药菌株在mtrR编码区发生A39T突变。
三、讨论
淋球菌对头孢曲松耐药涉及多个耐药基因决定子及其相互作用,包括penA基因、mtrR基因等[8]。penA的镶嵌状突变模式和非镶嵌状penA的A501位的突变被证实与头孢曲松的耐药相关[11-13]。mtrR基因表达主要与淋球菌外排系统有关,发生突变时可以导致mtrCDE外排泵系统表达增加,使淋球菌内部有效药物浓度下降而引起耐药[14]。
Unemo等[15]研究临床分离的高度耐头孢曲松淋球菌菌株H401,发现含有penA-CI镶嵌状结构,该结构同时合并PBP2发生A501P突变,可能引起淋球菌对头孢曲松敏感性下降。Sethi等[16]对大样本临床敏感淋球菌进行MIC检测及penA基因测序分析发现,所有敏感菌株未发现镶嵌状结构及PBP2的A501突变,从而认为镶嵌状结构或PBP2的A501突变可能只发生在淋球菌对头孢曲松低敏或耐药的菌株。Lee等[10]对46株头孢克肟和头孢曲松敏感性降低的淋球菌进行测序分析发现,头孢菌素敏感性降低的大多数菌株,penA突变模式以A501V突变为主。Olsen等[17]对2011年越南地区收集的淋球菌进行药敏及耐药基因研究显示,78%的淋球菌PBP2的A501位氨基酸出现突变,其中A501V突变模式占44%,A501T突变模式占34%。还有研究发现,A501突变和G542S与非镶嵌状PBP2菌株的头孢曲松耐药或敏感性下降有关[18-20]。我们的研究中,头孢曲松敏感菌株诱导耐药后出现A501T和G542S突变,提示penA基因中的A501T和G542S突变可能在头孢曲松耐药中起重要作用。
Liao等[21]对淋球菌临床敏感菌株及低敏菌株研究发现,当mtrR基因编码区特定位点突变(如A39T、G45D)和(或)启动子区的13 bp反向重复序列的单碱基A缺失突变时,MtrR蛋白减少,引起MtrCDE外排泵系统过度表达,增加药物外排,从而导致包括头孢曲松在内的抗生素敏感性下降。我们的研究中,菌株2012-5616(头孢曲松低敏并对青霉素、四环素、阿奇霉素和环丙沙星耐药)和ATCC-49226(头孢曲松和环丙沙星敏感,但对青霉素、四环素和阿奇霉素低敏)在诱导前已出现A39T突变;而菌株2012-4052(头孢曲松敏感,对四环素和环丙沙星耐药,对青霉素和阿奇霉素低敏)只在诱导耐药后在mtrR编码区发生A39T突变。这些结果提示,在mtrR编码区发生A39T突变可能在头孢曲松耐药中发挥作用,另外,mtrR基因可能与多重耐药相关。
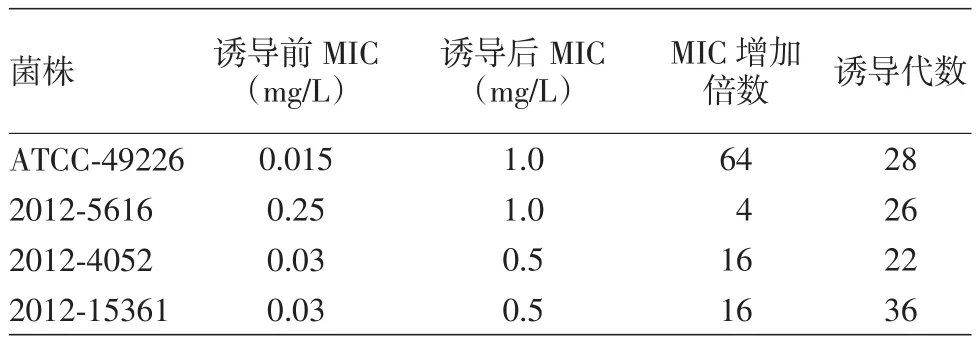
表3 4株淋球菌诱导耐药前后头孢曲松最低抑菌浓度(MIC)变化情况
图2 penA基因片段测序波形图
本研究中penA、mtrR基因主要是针对体外诱导头孢曲松耐药菌株进行的研究,很遗憾未能进行临床分离头孢曲松耐药菌株的基因突变的研究。
综上所述,penA基因中的A501T和G542S突变可能在头孢曲松耐药中起重要作用;而mtrR基因发生A39T突变的作用有待于进一步研究。
志谢中国医学科学院皮肤病研究所性病科苏晓红教授及性病实验室乐文静、李赛等

