梅毒螺旋体诱导巨噬细胞分泌的外泌体特征及其对人脐静脉内皮细胞增殖的影响
许卜方 王千秋 张瑞丽 张津萍
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所 中国疾病预防控制中心性病控制中心性病防治室(许卜方、王千秋),性病科(张津萍);南京医科大学附属无锡第二医院皮肤科(张瑞丽)
近年研究发现,外泌体作为一种直径30~150 nm的胞外囊泡[1],参与机体的免疫应答、抗原提呈、细胞迁移分化、肿瘤侵袭等[2]。外泌体携带的mRNA、miRNA、蛋白不仅可以作为细胞间通讯的重要介质传递信号以调节细胞组织的功能[3-4],还可以作为疾病的生物标记物辅助诊断[5-6]、治疗[7]、预后评估[8]。虽然梅毒的致病机制在免疫学方面已取得一些进展,但是外泌体在梅毒中的研究未见相关报道,因此在本研究中,我们通过研究Tp诱导巨噬细胞分泌的外泌体特征及其对人脐静脉内皮细胞(HUVEC)增殖的影响,从分子学角度为梅毒的致病机制提供线索。
材料与方法
一、材料
1.细胞系和致病菌:人单核巨噬细胞(human acute monocytic leukemia cell line,THP-1)为本实验室保存,HUVEC来自北京协和医学院基础所细胞库。梅毒螺旋体(Tp)Nichol株为本实验室保存。动物实验在南京军区疾病预防控制中心开展[许可证号SYXK(军)2012-0048]睾丸发育成熟的健康成年(3月余,2.5~3 kg)新西兰雄兔来源于江苏省农业科学院六合动物科学基地实验兔场(动物合格证号201615918),在接种前后不接触任何抗生素,质量等级普通级,在18~20℃环境中饲养;所有兔在接种前进行非螺旋体试验(VDRL或RPR),检测均为阴性。
2.主要试剂及仪器:RPMI 1640、DMEM培养基(美国Gibco公司),CCK8试剂(日本同仁化学研究所),PKH67(美国Sigma公司),外泌体提取试剂盒(德国Qiagen公司,cat 76164),BCA蛋白浓度测定试剂盒、Western印迹检测试剂盒(上海碧云天生物技术有限公司),CD63、CD9、CD81一抗及二抗(美国CST公司),OLYMPUS IX81激光共聚焦显微镜,JEM1230透射电镜(日本JEOL公司),qNano Gold粒径测试仪(新西兰Izon Science公司)。
二、方法
1.Tp的获取:将Tp标准菌株接种于新西兰雄兔双侧睾丸,饲养2周后开始每2天抽取兔耳缘静脉血1 ml进行RPR测定,待滴度上升至1∶64左右且睾丸硬、肿时,将兔予以安乐死,无菌摘取双侧睾丸,剪碎、萃取、离心、沉淀,获得较纯的Tp用于后续实验。
2.巨噬细胞和HUVEC培养:THP-1细胞在RPMI 1640培养基(含10%胎牛血清)中培养至对数生长期时,收集所有THP-1细胞悬液,取10 μl滴于细胞计数板在显微镜下计数,离心弃上清液,将THP-1细胞沉淀在RPMI 1640(含10%胎牛血清)中重悬,按1×106/孔接种于100 mm×20 mm细胞培养皿,加入50 μg/L丙二醇甲醚醋酸酯(PMA),37℃、5%CO2孵箱中孵育约24 h后细胞贴壁,呈多角形,即分化为巨噬细胞用于后续实验[9-10]。在DMEM(含10%胎牛血清)中培养HUVEC,处于对数生长期时用于后续实验。
3.外泌体的提取:被PMA刺激分化的巨噬细胞在RPMI 1640(含10%胎牛血清)新鲜培养基中37℃、5%CO2继续孵育24 h。用RPMI 1640重悬Tp,取10 μl于暗视野显微镜下观察活力并计数,取1×107Tp按照10∶1(Tp与巨噬细胞)的感染数加入接种有巨噬细胞的100 mm×20 mm培养皿,刺激12 h[11]。更换培养基为含10%无外泌体的胎牛血清RPMI 1640培养液,置于37℃、5%CO2孵箱中继续培养48 h。多次高速离心,弃沉淀,按照外泌体提取试剂盒手册操作,加入外泌体洗脱液XE制成外泌体悬液作为实验组外泌体(EXOTp)。自未加Tp刺激的巨噬细胞提取的外泌体悬液为对照组外泌体(EXO)。
4.外泌体鉴定:
(1)透射电镜观察:吸取外泌体悬液约50 μl于26 cm×19 cm×2 cm解剖盘上。取一有支持膜的铜网与解剖盘上的外泌体悬液接触,静置3~5 min,取出铜网,晾干。取3%磷钨酸溶液约50 μl滴于蜡盘上,将铜网放置于3%磷钨酸染液表面染色3~5 min,取出铜网,白炽灯下晾干,电镜拍照。
(2)Western印迹检测:BCA蛋白定量法测定外泌体蛋白含量。制胶(12%分离胶,5%浓缩胶),取15 μl样品在80 V恒压下电泳30 min,120 V恒压电泳1 h。转膜2 h。5%牛血清白蛋白封闭2 h,分别加入兔抗人CD63(1∶1 000稀释)、CD9(1∶1 000稀释)、CD81(1∶1 000稀释)、β微管蛋白(1∶1 000稀释)单克隆抗体4℃过夜孵育,TBST洗膜3次,室温孵育羊抗兔二抗(1∶2 000稀释)2 h,TBST洗膜,配制显影液,凝胶成像系统下显影曝光[12]。
5.纳米颗粒跟踪分析技术(nanoparticle tracking analysis,NTA)定量测定外泌体[13]:将外泌体样品1∶100稀释后,取40 μl注入样品槽中,加压约700 Pa,让样品匀速通过纳米孔。清洗样品槽,在所有参数不变的情况下,再次注入已知浓度和直径大小的标准样品CPC100(平均直径114 nm,浓度1× 1013颗粒/ml,稀释倍数1∶1 000)作为参比条件,与待测样品进行比对。运用软件Izon Control Suite 3.3.2.2000对样品和标准样品数据进行校准。
6.外泌体体外活化HUVEC:将HUVEC(1×105个)悬液接种于激光共聚焦小皿中,于37℃、5%CO2孵箱培养24 h后,细胞贴壁生长。用荧光染料PKH67对外泌体避光染色5 min,取染色后的外泌体(1×106颗粒)与HUVEC(1×105个)共培养5 h,弃培养基上清液,用PBS冲洗2遍,于激光共聚焦显微镜下观察拍照。
7.HUVEC吞噬外泌体后的增殖水平:将100 μl(1×104个细胞/孔)HUVEC悬液接种于96孔板,于37℃、5%CO2孵箱孵育24 h,将细胞分为对照组、实验组、外泌体洗脱液组,根据NTA测得的浓度分别加入10 μl EXO、EXOTp(4.5 × 108颗粒)、外泌体洗脱液(XE),孵育12、24、48、72 h,孵育完毕后加入CCK8 试剂10 μl,37 ℃避光孵育2 h。每组6个复孔,同时设置空白组(只加培养基,无细胞),酶标仪检测波长450 nm处吸光度(A值)。
8.统计学分析:采用SPSS 22.0统计软件。两组外泌体粒径大小符合正态分布,数据用x±s表示,采用u检验;两组外泌体浓度不符合正态分布,数据用M(P25,P75)表示,采用配对样本Wilcoxon符号秩检验进行统计学分析;各组HUVEC增殖水平数据符合正态分布,用x±s表示,数据方差不齐采用两独立样本Mann-Whitney检验进行统计学分析。P<0.05为差异有统计学意义。
结 果
一、细胞和Tp形态学观察
倒置显微镜下,由THP-1细胞分化来的巨噬细胞形态饱满,贴壁生长,圆形或椭圆形,有伪足,胞质颗粒较多,细胞之间排列较为紧密。含血清DMEM培养的HUVEC呈扁平多角形,贴壁生长,铺路石状镶嵌排列,细胞状态可。Tp于暗视野显微镜下呈纤细、白色、有折光的螺旋状微生物。雄兔睾丸接种Tp 2周左右,出现睾丸肿大等炎症症状。
二、外泌体鉴定
透射电镜下实验组外泌体为直径30~100 nm的微小囊泡,呈杯托样结构。Western印迹显示实验组和对照组外泌体膜蛋白分子(CD63、CD9、CD81)的清晰条带,三者相对分子质量分别为45 000、24 000、26 000。见图1。图1两组外泌体3种膜蛋白分子中CD63表达量最高,CD81次之,CD9表达量最低。
三、NTA定量测定外泌体
NTA检测两组外泌体囊泡直径50~150 nm,其中对照组外泌体颗粒直径(104 ± 29)nm,浓度[M(P25,P75)]为2.93×1010(1.465×1010,4.395×1010)颗粒/ml;实验组外泌体直径(97±35)nm,浓度为3.8×1010(1.9 × 1010,5.7 × 1010)颗粒/ml。两组外泌体颗粒直径(u=1.90,P>0.05)、浓度(z=-1.604,P=0.109)差异均无统计学意义。
四、HUVEC吞噬外泌体
PKH67染色后的两组外泌体与HUVEC共培养5 h后,激光共聚焦显微镜下观察,两组HUVEC形态皆正常,呈鹅卵石样排列。胞质内散在分布的绿色荧光颗粒即为染色后被HUVEC吞噬的外泌体,见图2。
五、外泌体对HUVEC增殖水平的影响
见图3。12 h时实验组、对照组HUVEC增殖水平均高于外泌体洗脱液组,差异均有统计学意义(P<0.05);24 h和48 h时对照组细胞增殖水平仍高于外泌体洗脱液组,在48 h达到峰值,差异均有统计学意义(P<0.05),而实验组与外泌体洗脱液组细胞在这两个时间点增殖水平差异无统计学意义(P>0.05);72 h时实验组、对照组与外泌体洗脱液组细胞增殖水平差异无统计学意义(P>0.05)。
讨 论

图1 巨噬细胞分泌的外泌体鉴定 1A:透射电镜下观察外泌体为直径30~100 nm的微小囊泡,呈杯托样结构;1B:Western印迹测定实验组和对照组外泌体膜蛋白CD63、CD9、CD81的表达
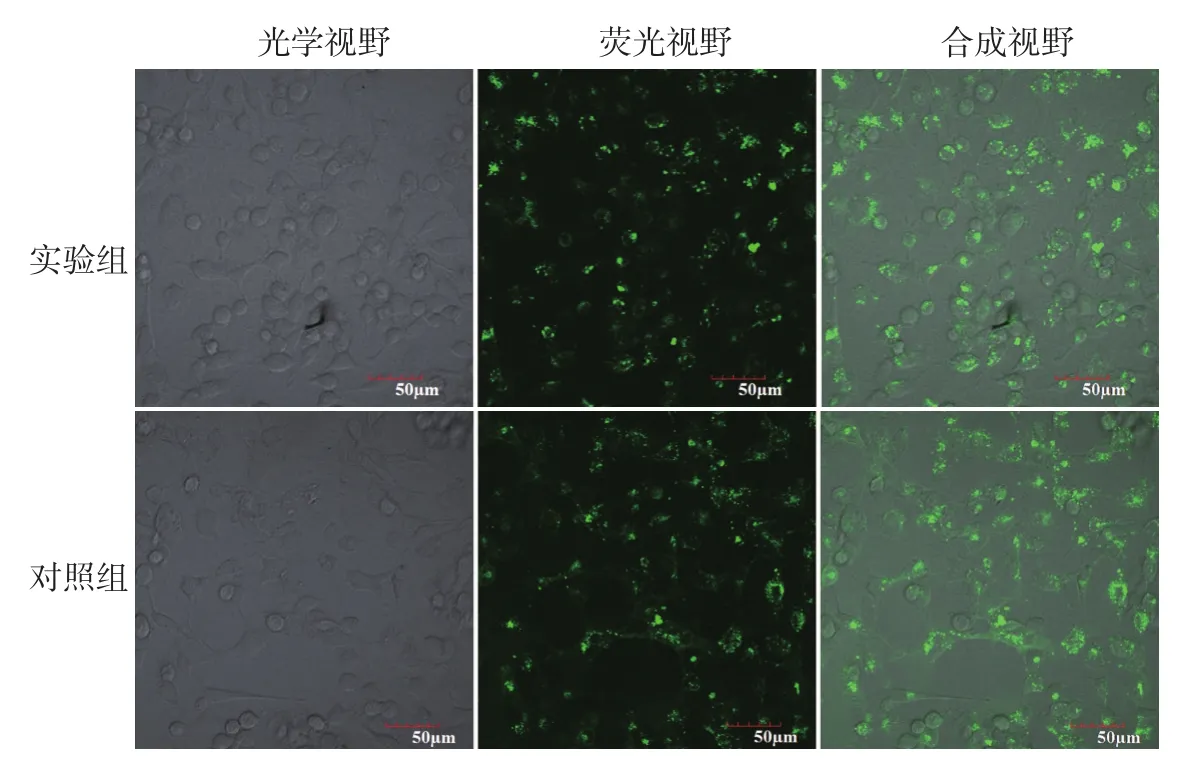
图2 PKH67染色后的外泌体与人脐静脉血管内皮细胞(HUVEC)共培养5 h后激光共聚焦显微镜下的内吞现象,绿色荧光颗粒为染色后的外泌体(×400)
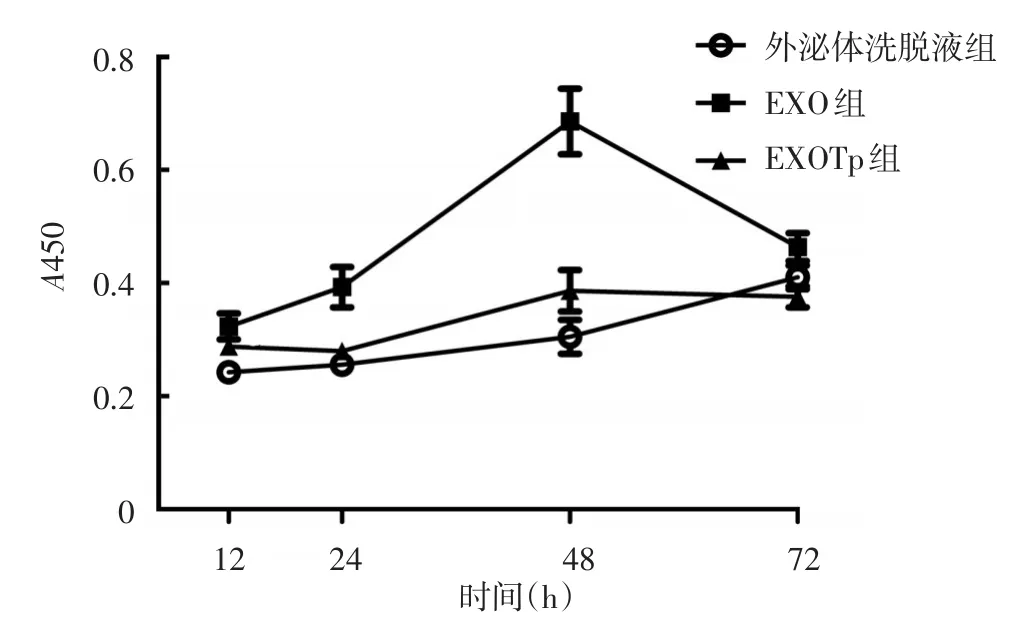
图3 CCK8法检测人脐静脉血管内皮细胞(HUVEC)被外泌体刺激12、24、48、72 h后的增殖水平 EXO:未用梅毒螺旋体刺激的巨噬细胞分泌的外泌体;EXOTp:梅毒螺旋体刺激的巨噬细胞分泌的外泌体。HUVEC吞噬外泌体后12 h时,EXO、EXOTp两组的HUVEC增殖水平均高于外泌体洗脱液组(均P<0.05);24 h和48 h时EXO组细胞增殖水平仍高于对照组(P<0.01),而EXOTp与外泌体洗脱液组细胞增殖水平差异无统计学意义(P>0.05);72 h时实验组、对照组与外泌体洗脱液组细胞增殖水平差异无统计学意义(P>0.05)
既往研究证实,Tp膜蛋白在梅毒致病过程中发挥重要作用。Tp借其表面的黏多糖酶吸附于细胞表面的受体,解离血管内皮细胞间的黏附连接,使组织坏死、炎症发生、溃疡形成、血管塌陷[14]。Tp对HUVEC的黏附性是上皮细胞的2倍,99%的HUVEC在Tp刺激后6 h仍有活性[15],继而趋化淋巴细胞和单核细胞黏附血管内皮细胞[11],从而发生一系列血管炎症反应致组织免疫病理损伤。
近年在炎症性疾病的研究中发现,高血压患者的巨噬细胞分泌的外泌体可以上调冠脉内皮细胞间黏附分子和纤溶酶原激活物抑制剂的表达,诱导冠脉内皮细胞发生炎症反应[9]。Diaz等[10]运用蛋白组学分析发现,THP-1来源的巨噬细胞感染结核分支杆菌后释放的外泌体膜蛋白组成中有41种蛋白表达升高,其中63%的蛋白与细胞膜功能相关。
提取外泌体有许多方法,其中较好的是超高速离心法。本研究中,我们因受限于设备条件,退而选择膜亲和试剂盒提取外泌体,该试剂盒提取的外泌体存在纯度问题,我们在实验过程中尽量保证实验组和对照组的条件一致以减少实验误差。在细胞增殖实验中设置外泌体洗脱液组作用于HUVEC,是为了评估外泌体洗脱液本身对HUVEC增殖水平的影响。
已知Tp膜蛋白直接影响血管内皮细胞的黏附、炎症、通透性,因此Tp作用于巨噬细胞后分泌的外泌体中是否具有Tp膜蛋白的相关遗传信息非常值得研究。但目前限于Tp不能体外培养,无法提取Tp源性外泌体,因此我们从功能学层面探讨Tp刺激巨噬细胞分泌的外泌体对血管内皮细胞的影响,为梅毒血管炎的分子机制研究提供一定的思路。本研究结果显示,在体外实验中,Tp诱导巨噬细胞分泌的外泌体在大小、浓度方面与正常巨噬细胞分泌的外泌体无异,但其作用于HUVEC后使得HUVEC的增殖水平下降,提示Tp刺激巨噬细胞后分泌的外泌体可能参与梅毒血管炎的致病过程,该结论还需体内实验进一步验证。
我们推测,Tp侵入宿主最初激活固有免疫应答,巨噬细胞被活化[14],吞噬Tp后分泌的外泌体携带着Tp和巨噬细胞的遗传信息,在体内输送至血管,血管内皮细胞接收了外泌体携带的信号,调节自身的增殖水平,以削弱血管内皮细胞的再生修复能力,继而为Tp致血管内皮细胞炎症的发生及进展提供有利条件。研究证明,外泌体可以传递信号,改变信号通路,影响蛋白的组成,导致下游细胞的功能发生改变[9-10,16]。本研究显示,HUVEC吞噬外泌体后12~48 h内,对照组HUVEC细胞增殖水平高于外泌体洗脱液组,在48 h达到峰值;实验组HUVEC仅在外泌体作用12 h内增殖水平高于外泌体洗脱液组,随着时间的推移,实验组细胞增殖水平趋于正常。推测THP-1来源的巨噬细胞可能分泌携有促进细胞增殖信号的外泌体作用于HUVEC使其增殖水平升高,而EXOTp可能携有抑制/阻断细胞增殖信号表达的相关遗传信息,使其作用于HUVEC后仅在12 h内提高增殖水平,后恢复至正常水平。在72 h时3组间细胞增殖水平无明显差异,说明外泌体在体外与HUVEC共培养72 h后不再影响HUVEC的增殖水平。这其中EXOTp影响HUVEC增殖的原因究竟是Tp本身的遗传信息作用,还是巨噬细胞受Tp刺激后发生应答反应的相关信号作用,以及EXOTp对HUVEC增殖的影响与血管内皮细胞炎症反应的发生是否相关,目前都尚不能明确,我们将在以后的研究中对此进行深入探讨。

