梅毒螺旋体对人脑微血管内皮细胞趋化因子配体6、8、10表达的影响
吴凡 胡文龙 许卜方 王千秋
210042南京,中国医学科学院 北京协和医学院 皮肤病研究所性病防治室(第一作者现在南京医科大学附属逸夫医院皮肤科,211100)
最新研究结果显示,神经梅毒患者脑脊液中多种趋化因子配体(CXCL13、CXCL8、CXCL10等)浓度显著高于无神经梅毒的梅毒患者,且驱梅治疗后浓度恢复正常,脑脊液中的这些CXCL具有成为诊断神经梅毒标志物的潜力[1]。CXCL6也被称为粒细胞趋化蛋白2,具有激活中性粒细胞、诱导T细胞迁徙和促血管生成等作用。Linge等[2]发现CXCL6自身也具有极高的抗菌活性,可通过附着于细菌表面导致细菌膜破裂。CXCL8即白细胞介素8,是一种促炎细胞因子,在招募中性粒细胞进入中枢神经系统(CNS)的过程中发挥重要作用,同时CXCL8直接参与中性粒细胞在内皮细胞表面的移动[3]。机体中CXCL10表达水平变化与感染、免疫功能异常和肿瘤等诱导的炎症有关,在多种疾病中,CXCL10被公认为预测疾病严重程度的生物标志物[4]。Brissette等[5]报道伯氏螺旋体刺激后人脑微血管内皮细胞(human brain microvascular endothelial cell,HBMEC)中CXCL1、CXCL2、CXCL6和CXCL8等多种趋化因子配体表达升高。我们前期研究[6]证实,梅毒螺旋体可以依附于体外培养的HBMEC。本研究中,我们利用新鲜提取的有活性梅毒螺旋体刺激HBMEC,观察该细胞中CXCL6、CXCL8和CXCL10基因和蛋白表达水平,进一步探讨HBMEC在神经梅毒发病中的作用。
材料与方法
一、材料
1.动物和细胞来源:3月龄成年雄性新西兰大白兔购自江苏省金陵种兔场[许可证号:SCXK(苏)2012-0003,动物合格证号:NO.201602656],体重2.5~3 kg,梅毒螺旋体明胶凝集试验和快速血浆反应素环状卡片实验均阴性,按要求饲养于南京军区军事医学研究所动物实验中心。梅毒螺旋体株(Nichols株)由厦门大学附属中山医院杨天赐教授馈赠。原代HBMEC来自美国Cell Systems公司,人类急性早幼粒白血病细胞株(HL-60细胞)来自中国科学院细胞库。
2.主要试剂和材料:内皮细胞完全培养液(美国Cell Systems公司),RPMI 1640培养基、脂多糖、噻唑蓝(MTT)和二甲基亚砜(DMSO)(美国Sigma公司),胎牛血清(杭州四季青生物工程材料有限公司),兔血清(自制),TRIzol试剂(美国Invitrogen公司),SYBR green实时荧光定量PCR检测试剂盒(大连 TaKaRa公司),CXCL6、CXCL8、CXCL10定量ELISA试剂盒(美国R&D公司),Transwell培养板(美国Corning公司)。
3.主要仪器:全波长酶标仪(美国Thermo Scientific公司),荧光定量PCR仪(美国ABI公司)。
二、方法
1.细胞培养:HBMEC和HL-60细胞分别接种于内皮细胞完全培养液和含10%胎牛血清的RPMI 1640培养液中,均置于37℃、5%CO2孵箱中培养。HBMEC传代3~6次后进行实验。为诱导HL-60细胞分化为类中性粒细胞,向培养液中加入1.5%DMSO刺激5 d。
2.梅毒螺旋体培养和收集:按文献[6]培养和收集有毒力的梅毒螺旋体,用内皮细胞完全培养液稀释为1.6×107条/ml的梅毒螺旋体悬液。取部分螺旋体悬液于56℃水浴锅中热处理30 min制成灭活的梅毒螺旋体悬液。
3.反转录(RT)-PCR检测HBMEC中CXCL6、8、10 mRNA表达水平:将HBMEC按1×106个/孔接种于6孔板中,置于37℃、5%CO2孵箱中培养24 h。移去旧培养液,加入新鲜提取的有活性梅毒螺旋体悬液(梅毒螺旋体组)或灭活(灭活梅毒螺旋体组)菌悬液,以含200 μg/L脂多糖为阳性对照组,以只含细胞培养液的孔作为空白对照组,每孔设置3个复孔,于37℃、5%CO2孵箱中分别培养6、12和24 h。弃旧液,加磷酸盐缓冲液清洗细胞3次,每孔加入1 ml TRIzol试剂,反复吹打,直到液体变成清亮的粉红色,置于-80℃冰箱中冻存。
采用氯仿法提取细胞总RNA,检测RNA纯度和浓度后将RNA反转录为cDNA,置于-80℃冰箱中冻存。运用Primer Premier 5.0软件设计引物序列,引物由生工生物工程(上海)股份有限公司合成。CXCL6正向引物:5′-CCTGTCTCTGCTGTGCTGAC-3′,反向引物:5′-CACTTCCACCTTGGAGCACT-3′;CXCL8正向引物:5′-CCTGTCTCTGCTGTGCTGAC-3′,反向引物:5′-CACTTCCACCTTGGAGCACT-3′;CXCL10正向引物:5′-GAACTGTACGCTGTACCTGC A-3′,反向引物:5′-TTGATGGCCTTCGATTCTGGA-3′;β肌动蛋白正向引物:5′-CAGGCACCAGGGCGT GATGG-3′,反向引物:5′-CGATGCCGTGCTCGATGG GG-3′。反应条件:95℃预变性5 min,95℃变性30 s,60℃退火30 s,72℃延伸30 s,40个循环。以β肌动蛋白作为内参,采用2-△△Ct法计算目的基因的表达倍数。
4.ELISA法检测HBMEC培养上清液中CXCL6、CXCL8和CXCL10含量:将HBMEC按每孔5×104个接种于96孔板中,置于37℃、5%CO2孵箱中培养24 h,加入新鲜提取的有活性或灭活梅毒螺旋体悬液刺激HBMEC,以含脂多糖(200 μg/L)的孔作为阳性对照组,以只含细胞培养液的孔为空白对照组,每孔设置3个复孔,于37℃、5%CO2孵箱中分别培养6、12、24 h,取细胞培养上清液,置-20℃冰箱中冻存。按ELISA试剂盒说明书进行操作,检测不同处理组HBMEC培养上清液中CXCL6、CXCL8和CXCL10含量。
5.HL-60细胞迁移实验:将HBMEC按每孔5×105个接种于24孔板中,置于37℃、5%CO2孵箱中培养24 h,弃旧培养基,分别加入1.6×107条/ml梅毒螺旋体悬液和灭活菌悬液,以只含细胞培养液的孔为空白对照组,将Transwell小室放入24孔板中,按每孔2×105个将提前诱导的HL-60细胞加入上室中,每孔设3个复孔,置于37℃、5%CO2孵箱中分别培养6、12和24 h。收集下室中的上清液,150g离心5 min,用含10%胎牛血清的RPMI 1640培养液重悬细胞,接种于96孔板中,每孔加入10 μl 0.5%MTT溶液,继续培养4 h,终止培养,150×g离心10 min,弃上清液,每孔加入100 μl DMSO,置摇床上低速振荡10 min,用酶联免疫检测仪在570 nm波长处测定各孔A值。
6.统计学分析:采用SPSS 17.0软件进行分析,计量资料以±s表示。多组间比较采用单因素方差分析,若方差齐,进行SNK检验;若方差不齐,则进行Games-Howell检验,P<0.05为差异有统计学意义。
结 果
一、不同处理组HBMEC中CXCL6、CXCL8和CXCL10 mRNA表达
6、12和24 h时各组间CXCL6 mRNA、CXCL8 mRNA、CXCL10 mRNA相对表达水平差异均有统计学意义(均P<0.05)。见表1。组间比较显示,在各时间点梅毒螺旋体组中CXCL6、CXCL8和CXCL10 mRNA表达水平均显著高于空白对照组和灭活梅毒螺旋体组(均P<0.05);梅毒螺旋体组中CXCL6和CXCL8 mRNA表达水平与脂多糖组比较,均P<0.05,而CXCL10 mRNA表达水平差异无统计学意义(均P>0.05);灭活梅毒螺旋体组3种基因mRNA表达水平与空白对照组间差异均无统计学意义(均P>0.05),与脂多糖组相比差异均有统计学意义(均P<0.05)。见表1。
表1 不同处理组中人脑微血管内皮细胞趋化因子配体(CXCL)6、CXCL8和CXCL10 mRNA的相对表达水平(±s)
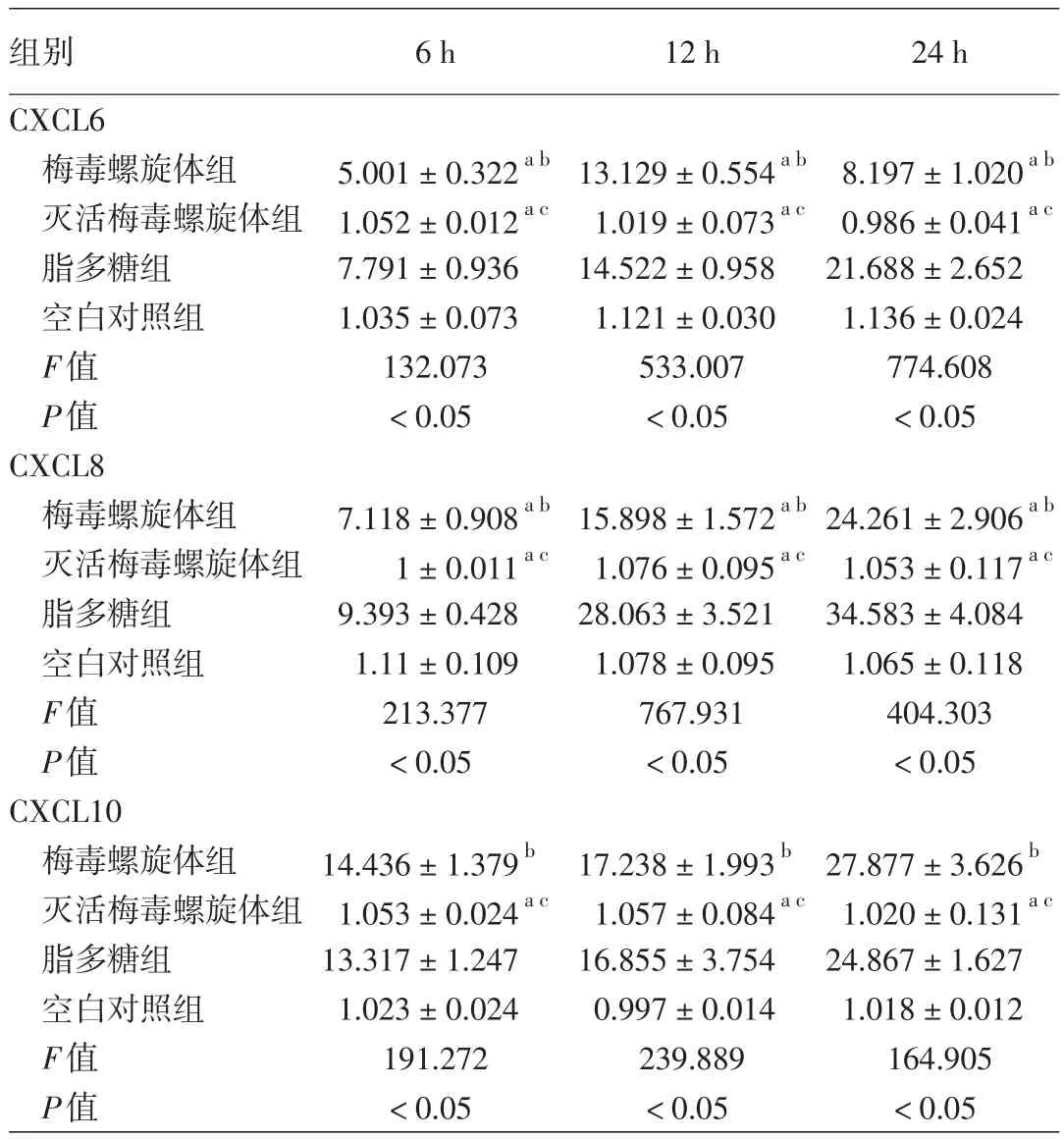
表1 不同处理组中人脑微血管内皮细胞趋化因子配体(CXCL)6、CXCL8和CXCL10 mRNA的相对表达水平(±s)
注:n=3。a与脂多糖组比较,P<0.05;b与空白对照组比较,P<0.05;c与梅毒螺旋体组比较,P<0.05
组别CXCL6梅毒螺旋体组灭活梅毒螺旋体组脂多糖组空白对照组F值P值CXCL8梅毒螺旋体组灭活梅毒螺旋体组脂多糖组空白对照组F值P值CXCL10梅毒螺旋体组灭活梅毒螺旋体组脂多糖组空白对照组F值P值6 h 12 h 24 h 5.001±0.322a b1.052±0.012a c7.791±0.936 1.035±0.073 132.073<0.05 13.129±0.554a b1.019±0.073a c14.522±0.958 1.121±0.030 533.007<0.05 8.197±1.020a b0.986±0.041a c21.688±2.652 1.136±0.024 774.608<0.05 7.118±0.908a b1±0.011a c9.393±0.428 1.11±0.109 213.377<0.05 15.898±1.572a b1.076±0.095a c28.063±3.521 1.078±0.095 767.931<0.05 24.261±2.906a b1.053±0.117a c34.583±4.084 1.065±0.118 404.303<0.05 14.436±1.379b1.053±0.024a c13.317±1.247 1.023±0.024 191.272<0.05 17.238±1.993b1.057±0.084a c16.855±3.754 0.997±0.014 239.889<0.05 27.877±3.626b1.020±0.131a c24.867±1.627 1.018±0.012 164.905<0.05
二、不同处理组HBMEC上清液中CXCL6、CXCL8和CXCL10蛋白含量
单因素方差分析显示,在6、12和24 h时4组间CXCL6(F值分别为 229.960、573.247、522.244,均P<0.05)和 CXCL8(F值分别为 268.029、342.715、496.257,均P<0.05)的含量差异均有统计学意义。见图1。两两比较显示,梅毒螺旋体组CXCL6和CXCL8含量高于空白对照组和灭活梅毒螺旋体组(均P<0.05),而灭活梅毒螺旋体组CXCL6和CXCL8含量与空白对照组比较,差异无统计学意义(均P>0.05)。
梅毒螺旋体组CXCL6含量随培养时间延长呈现先升高后下降的趋势,12 h时达最高峰,且各时间点间差异有统计学意义(F=189.540,P<0.05),见图1A;而CXCL8含量随培养时间延长逐渐升高,各时间点间差异有统计学意义(F=353.578,P<0.05),见图1B。各时间点梅毒螺旋体组、灭活梅毒螺旋体组和空白对照组间CXCL10差异均无统计学意义(均P>0.05),见图1C。
三、各组HL-60细胞迁移情况
Transwell细胞迁移实验结果显示,在6、12和24 h时3组间Transwell小室下室中迁移的HL-60细胞数量均存在组间差异(F值分别为291.317、131.279、589.958,均P<0.05)。组间比较显示,在各时间点梅毒螺旋体组Transwell小室下室中迁移的HL-60细胞数量显著高于空白对照组和灭活梅毒螺旋体组(均P<0.05);而后2组间差异无统计学意义(P>0.05)。见表2。
讨 论
梅毒螺旋体对CNS有一定的亲和性,有研究显示,梅毒螺旋体感染人体后不久即可出现在脑脊液中,24%未治疗的梅毒患者脑脊液中可发现梅毒螺旋体,一期梅毒患者脑脊液中梅毒螺旋体阳性率高达40%[7]。动物模型[8]和梅毒螺旋体基因分型研究结果[9-11]均证实存在具有CNS亲和性的梅毒螺旋体亚型。血脑屏障作为一个由HBMEC、星形胶质形成细胞和周细胞等成分构成的特殊结构,是CNS抵御病原微生物侵袭的第一道防线。HBMEC作为血脑屏障中最重要的成分,一方面是血脑屏障物理屏障的实质成分,另一方面HBMEC受到病原微生物的刺激后会分泌趋化因子和神经营养因子等物质激活宿主的免疫系统[12]。我们利用新鲜提取的具有活性的梅毒螺旋体刺激HBMEC,观察细胞中CXCL6、CXCL8和CXCL10的变化情况,探讨HBMEC在神经梅毒发病过程中的作用。
表2 不同处理组人脑微血管内皮细胞对HL-60细胞迁移的影响(A570,±s)
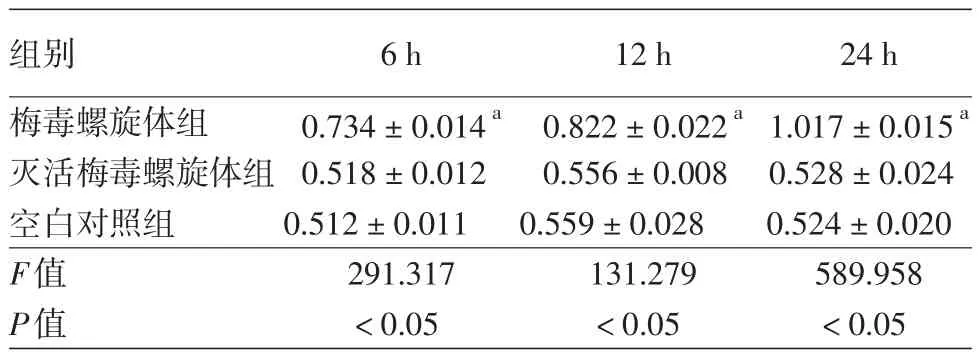
表2 不同处理组人脑微血管内皮细胞对HL-60细胞迁移的影响(A570,±s)
注:n=3。a与空白对照组和灭活梅毒螺旋体组比较,P<0.05
组别梅毒螺旋体组灭活梅毒螺旋体组空白对照组F值P值6 h 0.734±0.014a0.518±0.012 0.512±0.011 291.317<0.05 12 h 0.822±0.022a0.556±0.008 0.559±0.028 131.279<0.05 24 h 1.017±0.015a0.528±0.024 0.524±0.020 589.958<0.05
本研究中,有活性的梅毒螺旋体刺激HBMEC后CXCL6和CXCL8在转录水平和蛋白表达水平均显著升高,而灭活的梅毒螺旋体未引起这些变化。值得一提的是,CXCL10 mRNA虽然高表达,但细胞培养上清液中CXCL10的含量与空白对照和灭活梅毒螺旋体组间无明显差异。这可能与mRNA翻译和翻译后调控有关,具体原因尚需后续研究深入分析。
CXCL6、CXCL8和CXCL10是一类对中性粒细胞有趋化和激活作用的细胞因子,因此我们利用Transwell细胞迁移实验探讨梅毒螺旋体刺激后HBMEC对中性粒细胞的吸引能力。HL-60细胞经DMSO诱导后可分化为成熟的类中性粒细胞,表达多种中性粒细胞分子标志物,同时也具备吞噬能力,是中性粒细胞相关研究的良好替代模型[13]。我们利用HL-60细胞替代中性粒细胞进行实验,结果显示,有活性的梅毒螺旋体刺激后HBMEC对HL-60细胞的趋化能力明显增加,而灭活梅毒螺旋体并无该作用。前期研究发现,梅毒螺旋体膜蛋白Tpp47和Tpp17均可激活人脐静脉内皮细胞(HUVEC),通过上调HUVEC中细胞间黏附分子和E选择素的表达,增强HUVEC对单核巨噬细胞的趋化和黏附能力[14-15]。鉴于HBMEC与外周血管内皮细胞存在较多理化性质上的差异,梅毒螺旋体是否可以激活HBMEC从而诱导巨噬细胞趋化,有待进一步实验验证。
综上所述,有活性的梅毒螺旋体可上调HBMEC中CXCL6、CXCL8和CXCL10的基因表达水平,提高CXCL6和CXCL8的分泌水平,同时增强HBMEC对HL-60细胞的趋化能力,这些可能在神经梅毒的发病中起一定作用。本研究存在两点不足,一方面,仅构建了HBMEC的单层血脑屏障细胞模型,未考虑其他血脑屏障组成细胞和基底膜对HBMEC的影响;另一方面,未检验迁移来的HL-60细胞是否被激活,是否具有吞噬能力。后续研究中我们将构建双重或三重血脑屏障细胞模型,进一步探讨迁移后的HL-60细胞对梅毒螺旋体的吞噬情况,以更全面和深入地分析HBMEC在神经梅毒发病中的作用。

