Krüppel样因子6对于TGF-β1诱导的晶状体上皮细胞纤维化的调控作用研究
高美子 ,黄亮瑜 ,东莉洁 ,杨光 ,田芳
后发性白内障是白内障囊外摘除术后常见并发症,是由术后残留的晶状体细胞增殖移行和上皮-间充质转化(epithelial-mesenchymal transition,EMT)等引起的晶状体后囊膜混浊后囊膜混浊(posterior capsular opacification,PCO)[1],是白内障术后视力下降的常见原因。近年来手术方案和人工晶状体虽有改良,PCO的防止也随之取得一些进展,但关于其发病机制尚不明确。转化生长因子-β1(transforming growth factor-β1,TGF-β1)是一种能使正常的成纤维细胞的表型发生转化,主要参与调节细胞的生长与分化的生长因子,在房水、玻璃体、晶状体上皮细胞中均有表达,对晶状体上皮细胞(lens epithelial cells,LECs)终末分化具有调节作用[2]。 TGF-β1通路也是参与和诱导EMT的重要途径,是目前已知的参与诱导LECs发生EMT的重要细胞因子[3]。
Krüppel样因子 6(Krüppel-like factor6,KLF6)是一种肿瘤抑制因子,多项研究证实[4]其在细胞发育、细胞分化、增生、凋亡、血管生成及组织修复等生理或病理过程中发挥重要作用,并在多种纤维化疾病机制的研究中发现KLF6与TGF-β1的表达,具有相关性和潜在联系[5-7]。
鉴于KLF6在细胞纤维化中的重要作用,以及TGF-β1在晶状体上皮细胞EMT过程中的调控作用。本次研究采用真核质粒转染法,初步探讨KLF6过表达对TGF-β1诱导的晶状体上皮细胞纤维化的影响,从而为进一步探讨后发障的发病机制奠定基础。
1 材料与方法
1.1 材料
人晶状体上皮细胞 (human lensepithelial cells,HLECs)细胞株(HLE-B3细胞)(由天津医科大学眼科学院眼科研究所杨春波博士惠赠),pEGFP-C2-KLF6真核表达质粒由本实验室自行构建,其制备的方法及有效性验证等实验内容已发表于《中华实验眼科杂志》,转染pSilencer-KLF6由本实验室自行构建,TGF-β1购自美国peprotech(工作浓度0.5 ng/ml),Trizol试剂 (美国 Invitrogen公司),First Strand cDNA Synthesis Kit(美国 Thermo 公司),2xSYBRGreen Mix (瑞士 Roche 公司),DreamTaqTMHot Start DNA Polymerase,Transwell小 室 ( 美 国Coming公司),Lipofeetamine 2000 (美国 Invitrogen公司)。
1.2 细胞培养
使用含有10%FBS、100 U/ml青霉素和100 U/ml链霉素的RPMI-1640完全培养基,置于37℃,95%空气,5%二氧化碳的密闭恒温培养箱中培养。
1.3 转染与检测
检测 pEGFP-C2-KLF6(KLF6)和 pSilencer-KLF6(siKLF6)转染后HLECs中KLF6表达情况。接种每孔6×105个HLECs于1 ml培养体系的6孔细胞培养板中,待细胞汇合度达到70%左右,利用脂质体2000分别转染空载体、KLF6和siKLF6至HLECs中。转染48 h后,提取总RNA经反转录聚合酶链反应 (reverse transcriotion-polymerase chain reaction,RT-PCR)及实时定量PCR反应(real-time quantitative PCR,q-PCR)的方法分析KLF6的表达。
1.4 两种PCR方法分析转录水平的基因表达
体外培养HLECs细胞:接种于6孔板,按实验分组予相应的处理,37℃,5%CO2培养48 h后,进行总RNA提取。
按Trizol提取液说明书抽提细胞总RNA:首先4℃预冷离心机,同时新鲜配置体积分数75%乙醇溶液置于4℃备用。吸弃6孔板中的培基,用PBS洗2次,每次3 min,每个孔加入 1 ml的 Trizol,静置 3~5 min,将细胞裂解液吸到1.5ml EP管中,加200μl氯仿轻摇15 s,待溶液混合成粉红色,静置15 min,4℃,Frc=12 000离心15 min,取上清至另一新EP管中,加入等量异丙醇,吹打混匀上下倒置数次,静置10 min,4℃,Frc=12 000离心 15 min,弃上清,加入 1 ml已配好的体积分数75%乙醇,4℃,Frc=12 000离心5 min,弃上清后晾干,加入40μl DEPC水溶解并静置20 min,涡旋后离心,超微量分光光度计检测其浓度,A260/A280比值介于 1.8~2.0之间视为RNA提取质量良好,存于-80℃保存备用。
cDNA反转录:根据测得的RNA浓度,来计算1 μg RNA所对应的体积,加入到提前置于冰上的无菌无核酸酶的PCR管中,并按照顺序依次加入下面的反应物,建立一个总量为12μl的体系,其中oligo(dT)加1μl,RNA为所算好的体积,最后用DEPC补足到12μl,放入RNA逆转装置65℃孵育5 min,冰上冷却,离心收集,再置于冰上冷却,依次加入4 μl reaction buffer,1 μl RNase inhibitor,1 μl transcriptase和 2μl dNTP 2μl,总体积为 20μl,轻轻混匀后离心,42℃孵育60 min,70℃加热5 min终止反应,反应物可直接用于PCR反应。甘油醛-3-磷酸脱氢 酶 (glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参。
RT-PCR:引物选择见表1,反应条件见表2,最后所得扩增产物经琼脂糖凝胶电泳分离,于紫外透射仪下观察结果。

表1 RT-PCR引物

表2 RT-PCR反应条件
q-PCR:引物选择见表3。将2μl模板cDNA,2 μl上下游引物的等比混合物,4μl SYBR荧光染料,最终体积8μl,依次加入384孔板(避光冰上操作),每组3个复孔,实验重复3次,放入Real-time PCR仪内反应,调整扩增参数为:50℃2 min孵育,95℃10 min变性,重复40次循环:95℃15 s变性、55℃30 s退火、72℃30 s延伸;最后加入解离阶段(95℃15 s、60 ℃ 15 s、95 ℃ 15 s)。根据扩增曲线,输出 CT值,依照公式 2-ΔΔCt法进行数据分析。

表3 q-PCR引物
1.5 Transwell细胞迁移实验
体外培养HLECs细胞,并分为3组:空载体对照组(只转染空载体,无KLF6质粒,无TGF-β1刺激),单纯 TGF-β1刺激组 (转染空载体并予以TGF-β1刺激),KLF6高表达组 (转染KLF6质粒并予以 TGF-β1)
接种于6孔板,按实验分组予相应的处理,37℃,5%CO2培养 48 h后,取出 transwell板,先用1640培养液浸润,下层加入600μl,上层加入100 μl,放在37℃培养箱中孵育1 h,在孵育1 h期间,用胰酶消化3组细胞,离心、计数各组细胞,用1%培养基将细胞配制成浓度为3×105/ml,每组设3个复孔,取出transwell板,弃除之前小室上1640培养液,入配制好的细胞悬浮液100μl,轻晃transwell板,放于培养箱中。提前配制好吉姆萨染液,以1 g的姬姆色素染料加入66 ml甘油,混匀,60℃保温溶解2 h,再加入66 ml甲醇混匀,即配成姬姆色素原液,此原液用前用PBS稀释10倍左右就可以使用 (此为姬姆萨工作液)。根据需要量,配好工作液,此工作液常温可保存2周。用真空泵小心吸取下室上清液和上室培养液,再用棉签轻微擦拭小室基膜,以擦除基膜内壁细胞,然后在下室加入600μl 0.1%吉姆萨染液,染色25 min,用18.2Ω水清洗3遍,每次10 min,清洗完成后适度风干,用角膜刀将基膜环形切下,注意正反面,小室底面在上,放置在载玻片上,用玻璃棒蘸取中性树胶一滴于基膜上,将盖玻片从一侧缓慢放于基膜上(尽量不产生气泡)。
在光学显微镜下观察基膜上的细胞,并分4个象限随机视野下拍照,每个象限2张,采用直接计数法计数穿过基膜细胞数。重复试验3次,统计数据,进行分析。
1.6 统计学方法
使用SPSS 18.0统计软件进行统计学分析,GraphPad Prism7软件对所获得数据进行图表整理。计量资料组间比较采用两独立样本t检验 (2组数据)或单因素方差分析(3组数据)。P<0.05为差异有统计学意义。
2 结果
2.1 pEGFP-C2-KLF6转染后HLECs中KLF6表达水平
RT-PCR琼脂糖凝胶电泳显示,KLF6组中的亮度高于空载体对照组(Vec组)(图1A);灰度分析结果显示,KLF6组中KLF6表达水平显著高于Vec组,且差异具有统计学意义(P<0.05)(图 1B)。q-PCR显示,KLF6组中的KLF6表达量显著高于Vec组(图 1C)。说明 pEGFP-C2-KLF6转染可以提高HLECs中KLF6的表达水平。
2.2 pSilencer-KLF6转染后HLECs中KLF6表达水平
RT-PCR琼脂糖凝胶电泳显示,siKLF6组中KLF6的亮度低于Vec组(图2A);灰度分析结果显示,siKLF6组中KLF6表达水平显著低于Vec组中KLF6表达水平,且差异具有统计学意义 (P<0.05)(图2B)。q-PCR显示,siKLF6组中KLF6的表达量显著低于Vec组(图2C)。说明pSilencer-KLF6转染可以降低HLECs中KLF6的表达水平。

图1 pEGFP-C2-KLF6转染后HLECs中KLF6表达情况及定量分析。1A.琼脂糖凝胶电泳显示pEGFP-C2-KLF6转染后HLECs中KLF6表达情况(RT-PCR);1B.琼脂糖凝胶电泳的灰度分析结果;1C.pEGFP-C2-KLF6转染后 HLECs中 KLF6表达情况 (q-PCR) Vec: 空载体对照组 KLF6:pEGFP-C2-KLF6转染组 HLECs:人晶状体上皮细胞 GAPDH:甘油醛-3-磷酸脱氢酶
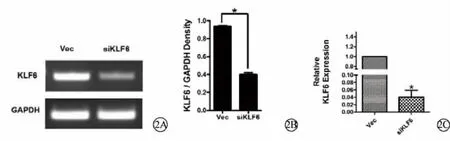
图2 pSilencer-KLF6转染后HLECs中KLF6表达情况及定量分析。2A.琼脂糖凝胶电泳显示pSilencer-KLF6转染后HLECs中KLF6表达情况 (RT-PCR);2B.琼脂糖凝胶电泳的灰度分析结果;2C.pSilencer-KLF6转染后HLECs中KLF6表达情况(q-PCR) Vec:空载体对照组 siKLF6:pSilencer-KLF6转染组 HLECs:人晶状体上皮细胞 GAPDH:甘油醛-3-磷酸脱氢酶
2.3 pEGFP-C2-KLF6转染后 HLECs中E-cadherin表达水平
RT-PCR琼脂糖凝胶电泳显示,KLF6组中E-cadherin的亮度低于Vec组(图3A);灰度分析结果显示,KLF6组中E-cadherin表达水平显著低于Vec组中E-cadherin表达水平,且差异具有统计学意义 (P<0.05)(图 3B)。q-PCR 显示,KLF6 组中E-cadherin的表达量显著低于Vec组(图3C)。说明pEGFP-C2-KLF6转染致KLF6高表达后,HLECs中E-cadherin的表达降低。
2.4 pEGFP-C2-KLF6转染后HLECs中Vimentin表达水平
RT-PCR琼脂糖凝胶电泳显示,KLF6组中Vimentin表达的亮度高于Vec组(图4A);灰度分析结果显示,KLF6组中Vimentin表达水平显著高于Vec组中Vimentin表达水平,且差异具有统计学意义(P<0.05)(图 4B);q-PCR 显示,KLF6 组中 Vimentin表 达 量 显 著 高 于 Vec组 (图4C)。 说 明pEGFP-C2-KLF6转染致KLF6高表达后,HLECs中Vimentin的表达水平升高。
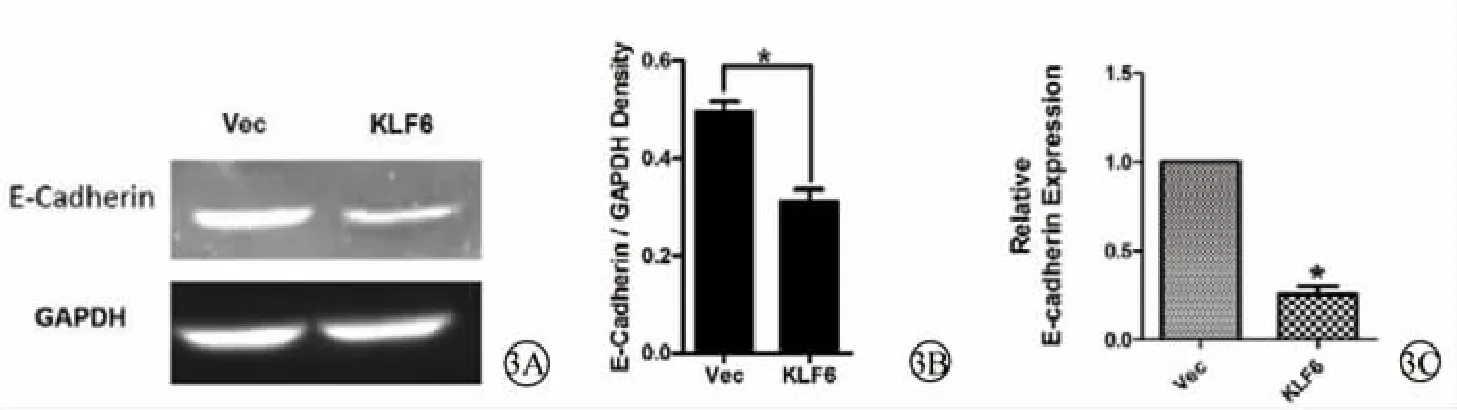
图3 pEGFP-C2-KLF6转染后HLECs中E-cadherin表达情况及定量分析。3A.琼脂糖凝胶电泳显示pEGFP-C2-KLF6转染后HLECs中E-cadherin表达情况 (RT-PCR);3B.琼脂糖凝胶电泳的灰度分析结果;3C.pEGFP-C2-KLF6转染后HLECs中E-cadherin表达情况(q-PCR) Vec:空载体对照组 KLF6:pEGFP-C2-KLF6转染组 (KLF6高表达组) E-cadherin:上皮钙黏素 HLECs:人晶状体上皮细胞GAPDH:甘油醛-3-磷酸脱氢酶

图4 pEGFP-C2-KLF6转染后HLECs中Vimentin表达情况及定量分析。4A.琼脂糖凝胶电泳显示pEGFP-C2-KLF6转染后HLECs中Vimentin表达情况(RT-PCR);4B.琼脂糖凝胶电泳的灰度分析结果;4C.pEGFP-C2-KLF6转染后HLECs中 Vimentin表达情况 (q-PCR) Vec: 空载体对照组 KLF6:pEGFP-C2-KLF6转染组 (KLF6高表达组) Vimentin:波形蛋白 HLECs:人晶状体上皮细胞GAPDH:甘油醛-3-磷酸脱氢酶

图5 pSilencer-KLF6转染后HLECs中E-cadherin表达情况及定量分析。5A.琼脂糖凝胶电泳显示pSilencer-KLF6转染后HLECs中E-cadherin表达情况 (RT-PCR);5B.琼脂糖凝胶电泳的灰度分析结果;5C.pSilencer-KLF6转染后HLECs中E-cadherin表达情况(q-PCR) Vec:空载体对照组 siKLF6:pSilencer-KLF6转染组 (KLF6低表达组) E-cadherin:上皮钙黏素 HLECs:人晶状体上皮细胞GAPDH:甘油醛-3-磷酸脱氢酶
2.5 pSilencer-KLF6转染后HLECs中E-cadherin表达水平
RT-PCR琼脂糖凝胶电泳显示,KLF6低表达组中E-cadherin的亮度高于Vec组(图5A);灰度分析结果显示,siKLF6组中E-cadherin表达水平显著高于Vec组中E-cadherin表达水平,且差异具有统计学意(P<0.05)(图 5B)。 q-PCR 显示,KLF6 低表达组中E-cadherin的表达量显著高于Vec组(图5C)。说明pSilencer-KLF6转染致KLF6低表达后,HLECs中E-cadherin的表达升高。
2.6 pSilencer-KLF6转染后 HLECs中Vimentin表达水平
RT-PCR琼脂糖凝胶电泳显示,KLF6低表达组中Vimentin表达的亮度低于Vec组(图6A);灰度分析结果显示,siKLF6组中Vimentin表达水平显著低于Vec组中Vimentin表达水平,且差异具有统计学意义(P<0.05)(图 6B)。q-PCR 显示,KLF6 低表达组中Vimentin表达量显著低于Vec组(图1C)。说明pSilencer-KLF6转染致KLF6低表达后,HLECs中Vimentin的表达水平降低。
2.7 Transwell细胞迁移实验
结果见图7。单纯TGF-β1刺激组中细胞迁移水平高于空白对照组(P<0.05),且KLF6高表达组中发生迁移的细胞数量高于单纯TGF-β1刺激组 (P<0.05),即在TGF-β1刺激下随KLF6的表达量增加,发生迁移的细胞数量相应提高。
2.8 pEGFP-C2-KLF6转染后,在TGF-β1刺激下,HLECs中Vimentin表达情况及定量分析
RT-PCR琼脂糖凝胶电泳显示,在TGF-β1刺激条件下,Vimentin表达量随KLF6表达量增加而提高(图8A);灰度分析结果显示,在TGF-β1刺激下,KLF6高表达组中Vimentin表达水平显著高于Vec组中Vimentin表达水平,且差异具有统计学意义(P<0.05)(图8B)。q-PCR显示,在TGF-β1刺激条件下,Vimentin表达量随KLF6表达量增加而提高(图8C)。说明加入TGF-β1刺激后,Vimentin表达量升高,随着KLF6的高表达,Vimentin表达量进一步增加。

图6 pSilencer-KLF6转染后HLECs中Vimentin表达情况及定量分析。6A.琼脂糖凝胶电泳显示pSilencer-KLF6转染后HLECs中Vimentin表达情况 (RT-PCR);6B.琼脂糖凝胶电泳的灰度分析结果;6C.pSilencer-KLF6转染后HLECs中Vimentin表达情况(q-PCR) Vec:空载体对照组siKLF6:pSilencer-KLF6转染组(KLF6低表达组) Vimentin:波形蛋白 HLECs:人晶状体上皮细胞 GAPDH:甘油醛-3-磷酸脱氢酶

图7 pEGFP-C2-KLF6转染后在TGF-β1刺激下HLECs细胞迁移情况。7A.Transwell细胞迁移实验观察各组HLECs迁移情况;7B.HLECs发生迁移的细胞数量 Vec:空载体 TGF-β1:转化生长因子-β1 KLF6:pEGFP-C2-KLF6转染(KLF6高表达) HLECs:人晶状体上皮细胞
2.9 pEGFP-C2-KLF6转染后,在TGF-β1刺激下,HLECs中E-Cadherin表达情况及定量分析
RT-PCR琼脂糖凝胶电泳显示,在TGF-β1刺激条件下E-Cadherin表达量随KLF6表达量升高而降低(图9A);灰度分析结果显示,在TGF-β1刺激下,KLF6高表达组中E-Cadherin表达水平显著低于Vec组中E-Cadherin表达水平,且差异具有统计学意义(P<0.05)(图 9B)。 q-PCR 显示,在 TGF-β1 刺激条件下,E-Cadherin表达量随KLF6表达量增加而降低(图9C)。说明加入TGF-β1刺激后,E-Cadherin表达量降低,随着KLF6的高表达,E-Cadherin表达量进一步减少。
3 讨论
EMT是上皮细胞在特定的生理或者病理情况下发生的细胞形态改变,细胞间黏附性降低,并向连接疏松,迁移能力更高的间质组织转化的过程[8]。EMT与多种类型的肿瘤侵袭密切相关[9、10]。在眼科领域中,EMT的发生可使晶状体上皮细胞增殖,迁移而引起PCO。
参与诱导和调控EMT过程的因素有很多,其中以TGF-β1诱导LECs发生EMT为众多研究者所熟知。研究显示[3],白内障术后,房水内部环境发生改变,细胞因子TGF-β1促进LECs由立方形的上皮细胞向伸长的成纤维细胞表行转变,并抑制上皮标志蛋白E-cadherin的表达,LECs逐渐丧失黏附链接和缝隙链接,细胞骨架重组,细胞迁移性和运动增加,并获得基质细胞的标志如波形蛋白Vimentin。LECs发生EMT可引起细胞外基质固缩,从而引起后囊膜褶皱引起PCO。

图8 pEGFP-C2-KLF6转染后,在TGF-β1刺激下,HLECs中Vimentin表达情况及定量分析。8A.琼脂糖凝胶电泳显示pEGFP-C2-KLF6转染后,在TGF-β1刺激下HLECs中Vimentin表达情况(RT-PCR);8B.琼脂糖凝胶电泳的灰度分析结果;8C.pEGFP-C2-KLF6 转染后,在 TGF-β1 刺激下,HLECs中 Vimentin 表达情况(q-PCR) Vec:空载体 TGF-β1:转化生长因子-β1 KLF6:pEGFP-C2-KLF6转染 (KLF6高表达) Vimentin:波形蛋白 HLECs:人晶状体上皮细胞GAPDH:甘油醛-3-磷酸脱氢酶

图9 pEGFP-C2-KLF6转染后,在TGF-β1刺激下,HLECs中E-Cadherin表达情况及定量分析。9A.琼脂糖凝胶电泳显示pSilencer-KLF6转染后,在TGF-β1刺激下HLECs中E-Cadherin表达情况(RT-PCR);9B.琼脂糖凝胶电泳的灰度分析结果;9C.pSilencer-KLF6转染后, 在TGF-β1刺激下,HLECs中 E-Cadherin表达情况 (q-PCR) Vec: 空载体TGF-β1:转化生长因子-β1 KLF6:pEGFP-C2-KLF6转染(KLF6高表达) E-cadherin:上皮钙黏素 HLECs:人晶状体上皮细胞 GAPDH:甘油醛-3-磷酸脱氢酶
KLF6作为一种重要的肿瘤抑制基因,参与多种与TGF-β1传导相关的细胞增殖,纤维化等过程[12]。E-cadherin是一种钙离子依赖的细胞间黏附分子,属于I型钙黏蛋白,参与介导细胞间的同源黏附[13]。E-cadherin表达下调会导致同源细胞间黏附力下降,有利于肿瘤细胞脱离原发部位,向细胞外基质扩散。E-cadherin表达减少或缺失目前被认为是肺癌等恶性肿瘤中EMT现象的重要标志[14]。波形蛋白(vimentin)是细胞骨架蛋白之一,特异性的分布于间质细胞中,在上皮源性肿瘤中表达是发生EMT特征的表现,与细胞的生长分化状态以及细胞游走迁移有关。
鉴于PCO的发病机制尚不明确,本次研究采用真核质粒转染法将pEGFP-C2-KLF6(KLF6)和pSilencer-KLF6(siKLF6)分别转染到 HLECs中,并加入TGF-β1对细胞进行刺激,在KLF6高表达与低表达的水平下利用PCR方法检测EMT相关标记蛋白E-cadherin与Vimentin的表达水平,采用细胞迁移实验观察HLECs迁移能力的改变,以初步探讨KLF6在由TGF-β1诱导的晶状体上皮细胞纤维化过程中的调节作用。
本次研究结果显示(图 1,图 2)经 RT-PCR与q-PCR检测下我们成功建立了KLF6高表达与低表达的细胞模型。并发现当KLF6呈高表达时,HLECs中E-cadherin表达水平降低 (图3),同时Vimentin表达水平升高(图4)。当KLF6呈低表达时,HLECs中E-cadherin表达水平升高 (图5),同时Vimentin表达水平降低(图6)。同时,在TGF-β1刺激条件下(图8)细胞中Vimentin表达水平升高,且随着KLF6的高表达,Vimentin表达量进一步增加,并且在TGF-β1刺激条件下(图 9),细胞中 E-cadherin表达水平降低,且随着KLF6的高表达,E-Cadherin表达量进一步减少。由此可见,KLF6可以通过上调Vimentin高表达以及促进E-cadherin的低表达,进一步促进TGF-β1诱导的晶状体上皮细胞纤维化过程,从而为后发障的发生奠定了基础。
本次研究创新性体现在:我们首次报道KLF6蛋白对TGF-β1诱导的人晶状体上皮细胞纤维化的促进作用。利用KLF6特性我们可以针对性的设计KLF6的小干扰RNA,特异性的下调HLECs中KLF6的表达,从而内源性提高人晶状体上皮细胞的抗纤维化能力,进而抑制或延缓后发性白内障的发生发展。
[1] 李华,汤欣.后发性白内障与相关信号转导通路研究进展 [J].中国实用眼科杂志,2013,31(11):1375-1378.
[2] Hosler MR,Wang-Su ST,Wagner BJ.Role of theproteasome in TGF-beta signagling in lens epithelial cells[J].Invest Ophthalmol Vis Sci,2006,47(5):2045-2052.
[3] 陈晓云,CHENXiao-yun.转化生长因子-信号通路在后发性白内障发生发展中的作用 [J].中华实验眼科杂志,2013,31(4):408-413.
[4] Ting Gui,Yueming Wang,Lixing Zhang,et al.Krüppel-like factor 6 rendered rat Schwann cell more sensitive to apoptosis via upregulating FASexpression[J].Plos One,2013,8(12):e82449.
[5] XZ Zou,ZC Gong,T Liu,et al.Involvement of epithelialmeasenchymal trasition afforded by activation of LOX-1/TGF-β1/KLF6 signaling pathway in diabetic pulmonary fibrosis[J].Pulmonary Pharmacology&Therapeutics,2017,44:70-77.
[6] BK Son,T Suzuki,D Sawaki,et al.KLF6 Modulates Aortic A-neurysm Formation Balancing Between Inflammatort and TGF beta Signaling Patyways[J].Circulatioon,2012,126(21):A17973.
[7] 李文,胡继红,李兴国,等.KLF6通过上调TGF-β1诱导静脉内皮细胞endoglin,P-selectin表达,引发血小板粘附?聚集,促进TDVT形成的实验研究 [J].中国矫形外科杂志,2011,19(16):1365-1368.
[8] 王浩,顾劲扬,丁义涛.上皮-间充质转化调控的分子机制研究进展[J].中华实验外科杂志,2014,31(1):221-222.
[9] 童宇洋,许晓琳,罗葆明.上皮间质转化在肝癌非手术治疗后促进残癌侵袭?转移的研究进展[J].中国介入影像与治疗学,2016,13(7):449-452.
[10]陈晓敏,郭俊明,乐东海.上皮-间质转化:肿瘤转移的重要调控机制[J].中国细胞生物学学报,2013(9):1367-1375.
[11]MG Dionyssiou,JSalma,M Bevzyuk,et al.Krüppel-like 6(KLF6)promotes cell proliferation in skeletal myoblastsin response to TGF/Smadssignaling[J].Skeletal Muscle,2013,3(1):7.
[12]LM Botella,F Sanz-Rodriguez,Y Komi,et al.TGF-beta regulates the expression of transcription factor KLF6 and its splice variants and promotes co-operative transactivation of common target genes through a Smad3-Sp1-KLF6 interaction[J].Biochemical Journal,2009,419(2):485-495.
[13]李蒙,吴玖斌,张培彤.E-钙黏蛋白?N-钙黏蛋白及波形蛋白在肿瘤转移中应用的研究进展 [J].肿瘤研究与临床,2016,28(2):32-136.
[14]杨心治,钟警,文格波.E-cadherin在黏附连接的调控机制及肿瘤EMT中的作用研究进展[J].现代医药卫生,2015(11):1658-1661.

