铁核桃根与叶水浸提液对果园间作绿肥植物的化感作用及其生理机制
侯林林,张文娥,李 菲,潘学军
(贵州大学/贵州省果树工程技术研究中心,贵阳 550025)
养分生态循环利用是现代果园生产管理的发展趋势[1],果树凋落物的还田[2-3]和种植绿肥[4-5]可有效提高果园土壤肥力。作为世界四大干果之一的核桃(Juglansregia),在中国的种植面积和产量均居世界首位。贵州作为铁核桃(J.sigillata)的原产中心和主要产区之一,种植面积已超过704 000 hm2。但贵州属于典型的喀斯特地貌,土壤保水保肥能力较差,核桃园土壤速效钾、有效硼和有效铁缺乏较严重,导致核桃树体营养不良,影响核桃生长发育和产量[6-8]。核桃叶片和青皮等凋落物还田,对土壤理化性质、养分动态、土壤酶活性和土壤微生物量等都有明显的影响,可有效提高土壤肥力[9],但是成熟核桃林中核桃凋落物年均量仅约10 000 kg/hm2[10],产量有限,土壤肥力提升有限。因此,核桃园间作绿肥是养分可持续发展的必然选择[11-13]。
核桃的根系分泌物及叶、果皮等凋落物中含有的胡桃醌(5-羟基苯醌)、酚类、黄酮类、亚麻油等化合物释放到土壤中,影响绿肥种子的发芽及幼苗期生长,降低绿肥产量[14]。众多研究表明,不同作物对核桃不同器官浸提液的敏感程度不同,而且不同发育时期对化感作用的敏感性不同。核桃叶水浸提液显著降低黄瓜(Cucumissativus)、洋葱(Alliumcepa)种子萌发,对玉米(Zeamays)和萝卜(Raphanussativus)种子萌发没有影响,番茄(Lycopersiconesculentum)、水芹(Oenanthejavanica)、黄瓜(Cucumissativus)和苜蓿(Medicagosativa)的种子萌发和幼苗生长都受到显著抑制作用,对小麦(Triticumaestivum)、大麦(Hordeumvulgare)、西瓜(Citrulluslanatus)和菜豆(Phaseolusvulgaris)种子萌发没有影响,但显著影响幼苗的生长,而甜瓜(Cucumismelon)幼苗生长受化感作用促进;核桃叶水浸提液虽对黄瓜种子萌发有抑制作用,但青皮水浸提液没有作用效果[15-17]。因此,核桃园绿肥种类的筛选及核桃凋落物对绿肥植物化感作用机理的明晰是提高核桃园土壤肥力的关键。本研究以中国西南地区果园广泛种植的16种绿肥植物为受体,研究铁核桃根、叶水浸提液及胡桃醌对其种子萌发及幼苗生长的影响,并从氧化胁迫的角度探讨了核桃凋落物对不同绿肥种类影响差异,以期筛选适宜中国西南地区核桃园种植的绿肥种类,探讨核桃凋落物对绿肥作物的化感作用机理,为西南地区核桃园绿肥间作提供理论依据。
1 材料和方法
1.1 材 料
供体材料铁核桃根系、叶片采集于贵州大学农场基地的3年生铁核桃树,风干后粉碎备用。胡桃醌购于Sigma公司(纯度98%)。16种受体材料为白菜(Brassicacampestris)、白三叶(Trifoliumrepens)、刺槐(Robiniapseudoacacia)、草木樨(Melilotussuaveolens)、白萝卜(Raphanussativus)、黑麦草(Loliumperenne)、红三叶(Trifoliumpratense)、黄豆(Glycinemax)、箭舌豌豆(Viciasativa)、菊苣(Cichoriumintybus)、绿豆(Vignaradiata)、毛叶苕子(Viciavillosa)、花生(Arachishypogaea)、油菜(Brassicanapus)、紫花苜蓿(Medicagosativa)、紫云英(Astragalussinicus),种子购于贵阳市花鸟市场绿化种业公司。
1.2 试验设计
1.2.1铁核桃根、叶水浸提液的制备分别称取铁核桃根、叶粉碎干样100 g,置于1 000 mL烧杯中,加满水在室温下冷提24 h,经过滤,得到质量浓度为100 mg/mL的根、叶水浸提液(母液),试验时将各处理液母液分别用蒸馏水再稀释成50、25、10、2 mg/mL,以蒸馏水为对照(CK,0 mg/mL)。利用高效液相色谱测定出铁核桃根水浸提液母液里胡桃醌浓度为33.4 μg/mL,叶水浸提液母液中胡桃醌浓度为30.97 μg/mL,胡桃醌浓度介于胡桃醌纯品的20和60 μg/mL之间,因而铁核桃根水浸提液50、25、10、2 mg/mL分别对应胡桃醌浓度为16.7、8.35、3.34、0.668 μg/mL,铁核桃叶水浸提液50、25、10、2 mg/mL分别对应胡桃醌浓度为15.49、7.74、3.1、0.62 μg/mL。
1.2.2胡桃醌溶液的配制用蒸馏水将胡桃醌分别配成浓度0、20、65、110、155、200 μg/mL溶液。
1.2.3铁核桃根、叶水浸提液和胡桃醌的化感效应16种绿肥种子分别用6个浓度(0、2、10、25、50、100 mg/mL)的铁核桃根水浸提液浸种10 h[18]后进行发芽试验,每天统计发芽种子的数量,7 d后测定16种绿肥种子的发芽率及幼苗的鲜重、干重,计算3个指标的综合隶属函数值,并初步筛选出对铁核桃根水浸提液化感作用存在明显差异的4种绿肥。
为进一步研究铁核桃不同器官化感成分的作用差异,参考Matawska[19-20]等方法,并通过预试验确定的浓度梯度范围,设置铁核桃根、叶水浸提液的6个质量体积比浓度(0、2、10、25、50、100 mg/mL)和胡桃醌(胡桃醌是核桃化感作用的主要物质,胡桃醌浓度设定参考Jalili等[17])的6个浓度(0、20、65、110、155、200 μg/mL)处理,测定4种绿肥种子的发芽势、发芽指数和幼苗的株高、根长,以期确定胡桃醌和铁核桃根、叶水浸提液对筛选的4种绿肥的化感效应是否一致;最后测定3种处理液对4种绿肥幼苗的3种抗氧化酶活性(SOD、POD、CAT)、丙二醛和可溶性蛋白含量的影响,通过植物不同的抗氧化水平探讨化感存在差异的机理和原因。
1.3 受体种子的处理与培养
采用培养皿药膜法测定铁核桃根、叶水浸提液及胡桃醌对绿肥种子萌发和幼苗生长的影响。颗粒较小的种子用直径为10 cm的培养皿,颗粒较大的选择直径为20 cm的培养皿作为种子发芽床。选取籽粒饱满、大小均一的绿肥种子用蒸馏水清洗,经0.1% KMnO4消毒,蒸馏水冲洗3遍,用滤纸吸干附着水后用纱布分装,不同的处理液进行浸种,置于发芽床中,每培养皿中铺有滤纸,放入30~50粒种子在滤纸上摆放整齐,每个处理3次重复。置于25 ℃人工气候箱中培养。每24 h进行1次种子发芽数统计,第1、2天补加10 mL处理液,3 d后每天加5 mL。
1.4 测定指标及方法
1.4.1萌发指标和幼苗生长指标从置床起计时,每天统计发芽种子的数量,直到种子不再萌发时,计算相对发芽率、发芽势、发芽指数。发芽率(GR)=(7 d内萌发种子数/供试种子总数)×100%,发芽势(GE)=(第4天发芽种子数/供试种子总数)×100%,发芽指数(GI)=∑(Gt/Dt)。式中:Gt为第t天的发芽数,Dt为相应发芽天数。用刻度尺测定植株的株高和根长,随机抽取10株用电子天平测量鲜质量,而后置于80 ℃烘箱烘干至恒量,测定组织干质量。
1.4.2抗氧化酶活性、丙二醛与可溶性蛋白含量超氧化物歧化酶(SOD)活性采用氮蓝四唑法光化还原法测定,以抑制NBT光化还原的50%所需酶量为1个酶单位(U·g-1);过氧化物酶(POD)活性测定采用愈创木酚法,将每分钟OD值变化0.01个酶活性单位(U·g-1·min-1);过氧化氢酶(CAT)活性测定采用紫外分光光度计法,以每分钟OD值变化0.01为1个酶活性单位(U·g-1·min-1);丙二醛(MDA)含量测定采用硫代巴比妥酸加热显色法测定;可溶性蛋白(SP)含量测定采用考马斯亮蓝G250法[21]。
1.5 数据处理
采用DPS v7.05统计分析软件(Duncan 新复极差法)对试验数据进行方差分析及最小显著差异性检验,用Excel 2010进行数据整理和绘图。
2 结果与分析
2.1 铁核桃根水浸提液对16种绿肥种子发芽率和幼苗生长的影响
图1显示,与对照(0 mg/mL)相比,铁核桃根水浸提液对绿豆种子的发芽率没有抑制作用,而对其他15种受体种子的发芽率均表现出明显的抑制(P<0.05)。在浓度100 mg/mL时,16种受体种子发芽率的化感作用由强到弱依次(发芽抑制率)为白三叶(90%)、油菜(90%)、毛苕子(85.8%)、花生(85.3%)、刺槐(75.6%)、黑麦草(70.7%)、紫云英(69.4%)、箭舌豌豆(69.4%)、白萝卜(67.0%)、白菜(66.9%)、红三叶(34.2%)、草木樨(28.1%)、紫花苜蓿(28.1%)、黄豆(27.8%)、菊苣(27.4%)、绿豆(0%)。由此可见,铁核桃根水浸提液对绿豆的发芽率没有影响。
由图2可知,与对照相比,铁核桃根水浸提液对16种绿肥幼苗的鲜重均有抑制作用,并均达到显著差异水平(P<0.05)。在浓度2 mg/mL时,菊苣、刺槐、箭舌豌豆的鲜重受到显著抑制;浓度达到10 mg/mL时,白菜、白萝卜、油菜、紫花苜蓿、紫云英、黑麦草、黄豆、花生鲜重显著降低;绿豆、白三叶、红三叶、草木樨、毛苕子鲜重在25 mg/mL时达到显著抑制水平。随着根水浸提液浓度升高,受体幼苗的鲜重逐渐降低,绿豆幼苗受化感物质影响最小。
图3显示,与对照相比,根水浸提液浓度2 mg/mL时对白三叶的干重有显著抑制作用;浓度为25 mg/mL时,对绿豆幼苗的干重达到显著抑制水平;其他的受体植物幼苗大约在浓度为10 mg/mL时达到显著抑制效果。在浓度100 mg/mL时,根水浸提液对16种幼苗干重的化感作用(抑制率)分别为花生(38.3%)>白三叶(20.5%)>刺槐(19.0%)>红三叶(18.2%)>菊苣(18.0%)>毛苕子(17.7%)>白萝卜(17.1%)>黑麦草(17.0%)>油菜(16.7%)>箭舌豌豆(16.0%)>紫云英(13.9%)>紫花苜蓿(13.0%)>草木樨(12.7%)>黄豆(11.9%)>绿豆(10.6%)>白菜(8.6%)。说明铁核桃根水浸提液对16种绿肥幼苗干重都有显著化感抑制作用(P<0.05),而对绿豆幼苗化感抑制作用最弱,对白三叶的抑制作用最强。
2.2 胡桃醌及铁核桃根、叶水浸提液对4种绿肥种子萌发和幼苗生长的影响
通过如上试验筛选出化感效应存在明显差异的4种绿肥,即受化感抑制作用强的白三叶、花生与受化感作用弱的绿豆、红三叶。
铁核桃根、叶水浸提液与胡桃醌对4种植物种子化感作用随着处理液和受体种类不同而有所不同。铁核桃根、叶水浸提液对绿豆种子的萌发没有影响,在不同浓度处理下绿豆的发芽势和发芽指数均为100%,但其他3种受体绿肥种子在2种浸提液的处理下均表现浓度效应,在根、叶水浸提液浓度为50 mg/mL时3种绿肥种子发芽势都受到显著化感抑制作用(P<0.05,图4),在浓度25 mg/mL时对3种绿肥种子发芽指数达到显著抑制水平。胡桃醌对4种绿肥种子都有显著抑制作用,但对绿豆种子萌发的化感抑制作用弱于其他3种绿肥种子;在胡桃醌处理下,绿豆发芽势和发芽指数在155 μg/mL时受到显著抑制,其他3种绿肥种子发芽势在浓度65 μg/mL时受到显著化感抑制,发芽指数在20 μg/mL时达到显著抑制水平;与对照相比,在200 μg/mL时,4种绿肥白三叶、花生、红三叶、绿豆种子发芽势分别下降了100%、95.3%、98.0%、55.3%,发芽指数降低了99.8%、95.6%、95.0%、43.0%。在铁核桃根、叶水浸提液100 mg/mL时,白三叶和花生的发芽势和发芽指数仅为胡桃醌20~65 μg/mL处理时的7%~20%,同时铁胡桃水浸提液对红三叶的作用效果也显著高于胡桃醌。说明胡桃醌与铁核桃根、叶水浸提液对受体种子萌发的化感抑制效果一致,但化感抑制强度不一致,根、叶水浸提液对4种绿肥种子萌发化感抑制作用明显比胡桃醌强。
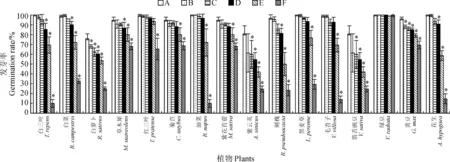
A-F分别代表铁核桃根水浸提液的6个质量体积比浓度; *表示与对照组相比差异显著(P<0.05)。下同图1 铁核桃根水浸提液对16种绿肥种子发芽率的影响A-F respectively represent 6 mass ratio concentration of aqueous extract of Juglans sigillata root (A. 0 mg/mL; B. 2 mg/mL; C. 10 mg/mL; D. 25 mg/mL; E. 50 mg/mL; F. 100 mg/mL). * means significant difference compared with control group (P<0.05). The same as belowFig.1 Effects of aqueous extract of Juglans sigillata root on seed germination rate of 16 kinds of green manure

图2 铁核桃根水浸提液对16种绿肥幼苗鲜重的影响Fig.2 Effects of aqueous extract of J. sigillata root on fresh weight of 16 kinds of green manure seedlings

图3 铁核桃根水浸提液对16种绿肥幼苗干重的影响Fig.3 Effects of aqueous extract of J. sigillata root on dry weight of 16 kinds of green manure seedling

Ⅰ~Ⅵ代表铁核桃叶水浸提液浓度、a~f代表胡桃醌质量体积比浓度; *表示与对照组相比差异显著(P<0.05)。 下同图4 不同处理条件对4种绿肥种子萌发的影响Ⅰ-Ⅵ respectively represent 6 mass ratio concentration of aqueous extract of J. sigillata leaves(Ⅰ. 0 mg/mL; Ⅱ. 2 mg/mL; Ⅲ. 10 mg/mL; Ⅳ. 25 mg/mL; Ⅴ. 50 mg/mL; Ⅵ. 100 mg/mL) and a-f respectively represent concentration of juglone (a. 0 mg/mL; b. 20 mg/mL; c. 65 mg/mL; d. 110 mg/mL; e. 155 mg/mL; f. 200 mg/mL). *. Significant difference compared with control group (P<0.05). The same as belowFig.4 Effects of different treatment conditions on seed germination of four green manures
图5显示,胡桃醌及铁核桃根、叶水浸提液对4种受体幼苗的株高、根长都有明显化感抑制作用(P<0.05)。与对照相比,在胡桃醌浓度20 μg/mL时,对4种植物幼苗株高有显著抑制作用;在浓度为65 μg/mL时,幼苗的根长达到显著抑制水平;在浓度200 μg/mL时,白三叶、花生、红三叶、绿豆的株高和根长比对照分别降低了71.2%、60.2%、48.4%、41.9%和40.6%、48.5%、43.0%、46.1%。根水浸提液在50 mg/mL时对花生株高有显著抑制作用,在2 mg/mL时其他3种幼苗株高达到显著抑制水平;在25 mg/mL时即对白三叶的根长有显著抑制效果,在浓度50 mg/mL时对其他3种幼苗的根长达到显著抑制水平(P<0.05)。叶水浸提液在10 mg/mL时对绿豆幼苗株高、根长有显著抑制作用,25 mg/mL时对其他受体幼苗的株高、根长达到显著抑制水平。在胡桃醌20和60 μg/mL处理下4种绿肥幼苗的株高和根长约为铁核桃根、叶水浸提液100 mg/mL处理时的1.2~1.7倍,说明铁核桃根、叶水浸提液对幼苗生长的化感抑制作用强于胡桃醌。
2.3 胡桃醌及铁核桃根、叶水浸提液对4种受体幼苗的抗氧化酶活性、MDA和SP含量的影响
由图6可知,4种绿肥幼苗在3种处理液作用下,SOD、POD、CAT活性均有先升高后降低的变化趋势。其中,在胡桃醌和铁核桃根、叶水浸提液处理下,与对照相比,绿豆幼苗的SOD活性显著升高,且显著高于白三叶和花生,与红三叶幼苗酶活性相近;绿豆和红三叶、花生SOD活性分别在胡桃醌155 μg/mL和铁核桃根、叶水浸提液50 mg/mL时才达到最大,而白三叶在胡桃醌110 μg/mL和铁核桃根、叶水浸提液25 mg/mL时就已经达到最大值。
与对照相比,在3种处理液的处理下,绿豆CAT活性都有最大值,且有最大增幅,绿豆是红三叶和花生增幅的8~40倍,而白三叶的CAT活性受抑制,即绿豆CAT活性受到的促进作用最大。4种幼苗的CAT活性与最高值相比,绿豆的降低率最小,稳定性最高。与对照相比,绿豆幼苗CAT活性在3种处理液最大浓度作用下高于其他绿肥幼苗,且化感促进作用显著高于其他3种。
4种幼苗的POD活性分别在胡桃醌155 μg/mL和铁核桃根、叶水浸提液50 mg/mL时最大,但在最大处理浓度时的POD活性与最大值相比,绿豆的POD活性无降低现象。说明在化感物质作用下,绿豆幼苗SOD、POD、CAT活性超过阈值时也存在降低,但其自身调节能力强,能保持酶活性相对稳定。

图5 不同处理条件对4种绿肥幼苗生长的影响Fig.5 Effects of different treatment conditions on seedlings growth of four green manures

图6 不同处理对4种绿肥幼苗抗氧化酶活性的影响Fig.6 Effects of different treatments on the activities of three antioxidant enzymes of four green manure seedlings
由图7可知,在不同处理液作用下,受体幼苗的MDA含量有相同的升高变化趋势。随着处理液浓度的增加,MDA含量逐渐升高,在胡桃醌200 μg/mL和铁核桃根、叶水浸提液100 mg/mL时,4种受体幼苗的MDA含量都达到最大值,且表现出相同的化感促进作用为白三叶>花生>红三叶>绿豆。绿豆在3种处理液作用下的化感抑制作用显著弱于其他3种幼苗,而且在不同浓度处理下绿豆的MDA含量没有显著差异;白三叶、红三叶和花生在3种处理液作用下都有显著促进作用。说明,在胡桃醌和铁核桃根、叶水浸提液作用下,化感物质对绿豆幼苗的膜脂过氧化程度显著低于其他幼苗,细胞受伤害程度低。
同时,4种幼苗SP含量在低浓度(胡桃醌20 μg/mL、铁核桃根、叶水浸提液2 mg/mL)处理时有最大值,随着处理浓度升高又有相同的降低趋势,在胡桃醌200 μg/mL和铁核桃根、叶水浸提液100 mg/mL有最小值,且显著低于对照组;与对照相比,在3种处理液的作用下绿豆SP含量的降低率显著低于其他绿肥幼苗。
3 讨 论
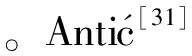
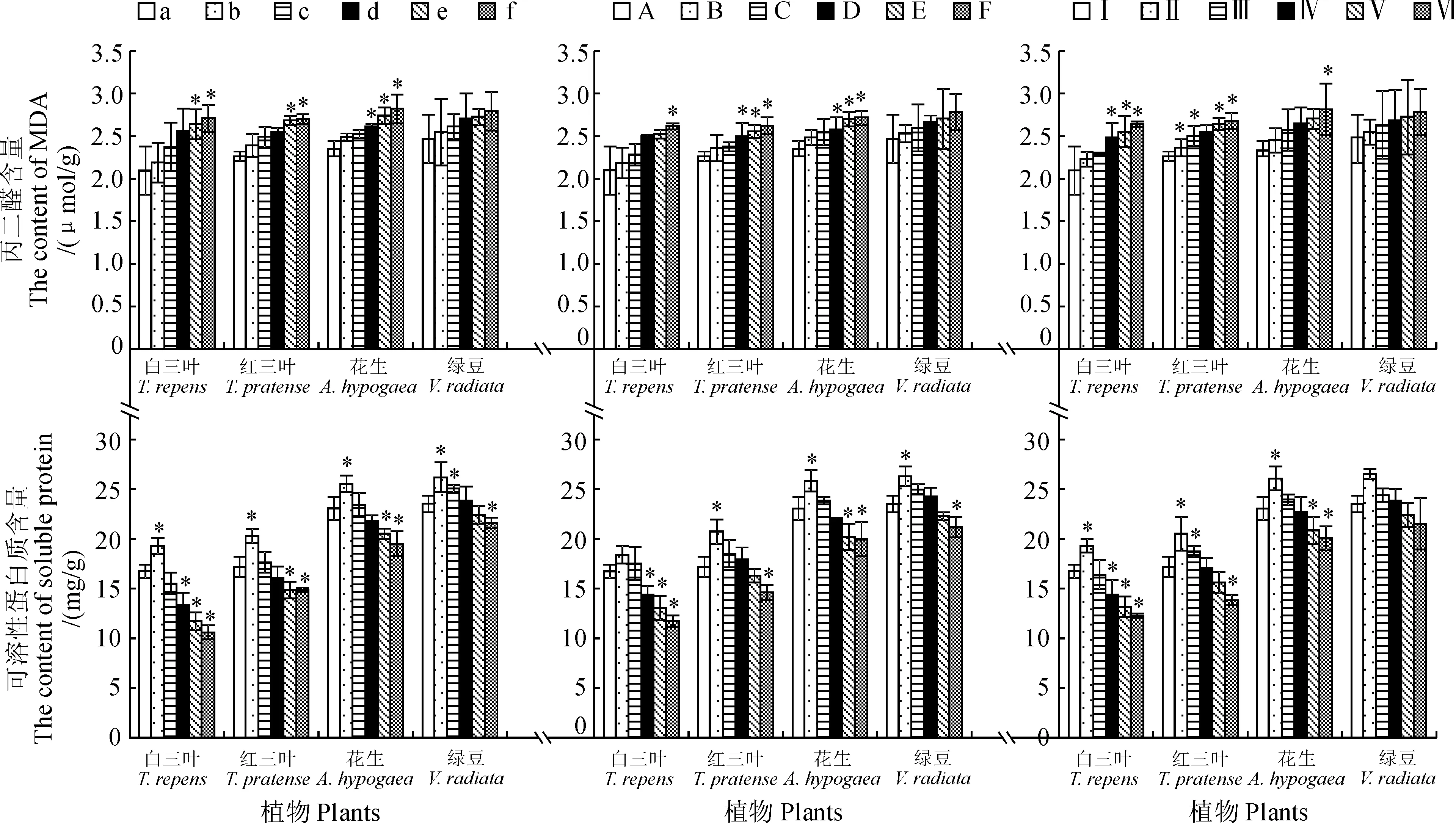
图7 不同处理条件对4种绿肥幼苗丙二醛及可溶性蛋白含量的影响Fig.7 Effects of different treatments on the contents of MDA and soluble protein of four green manure seedlings
植物化感效应的强弱依浓度和受试植物而不同,一般有“剂量效应”、“低促高抑效应”及“低浓度无影响、高浓度抑制”3 种不同的作用方式[27]。本研究表明,不同绿肥植物对胡桃醌和铁核桃根、叶水浸提液的敏感性不同,4种受试植物的敏感性从强到弱为白三叶>花生>红三叶>绿豆;不同化感物质对受体植物的化感作用效果不同,铁核桃根、叶水浸提液对4种受体植物的化感作用显著强于胡桃醌。高浓度的胡桃醌对绿豆种子萌发(发芽势、发芽指数)有显著化感抑制作用,而低浓度的无影响;在溶液中核桃醌浓度一致的情况下,铁核桃根、叶水浸提液对其他3种受体绿肥种子萌发(发芽势、发芽指数)及4种绿肥幼苗生长(株高、根长)的化感抑制作用强于胡桃醌溶液。Terzi[26]研究表明,在一定处理浓度下,核桃叶浸提液对作物种子萌发和幼苗生长的化感作用明显高于胡桃醌。胡桃醌是核桃根、茎、叶中化感作用最主要的物质,但还含有丰富的苷类、黄酮类、多酚类、萜类、酸类等多种化感物质[15,19-20,26-27],在一定程度上加强对受体的化感抑制,所以对受体的抑制作用要强于单一胡桃醌的作用。
化感物质破坏植物细胞中ROS产生与清除之间的平衡,导致植物细胞膜遭受氧化胁迫,植物通过提高SOD、CAT、POD等抗氧化酶活性共同协调清除,防止氧化应激造成的损害[32]。本研究中,随着胡桃醌及铁核桃根、叶水浸提液处理浓度的升高,4种受体幼苗的SOD、CAT、POD等抗氧化酶活性增加,清除过量的活性氧,提高植物的抗逆性,然而,随着核桃水浸提液及胡桃醌浓度的升高,抗氧化酶的清除能力毕竟有限,当处理浓度增大到一定程度时,化感抑制作用高于植物的耐受阈值,各种抗氧化酶活性降低,从而抑制了植物的生长[33]。与对照相比,绿豆幼苗的抗氧化酶活性均高于其他3种绿肥幼苗,其抗氧化酶SOD、CAT及POD在3种处理液作用下,活性呈现出先升高后降低的变化趋势。主要原因可能是其感受到外界化感胁迫后,体内产生过多的氧化产物而激活自身的一种应激机制,促使机体提高抗氧化能力,但这种能力具有一定的局限性,随着化感胁迫程度增加,在胡桃醌155 μg/mL和铁核桃根、叶水浸提液浓度50 mg/mL时,其保护性酶活性达到最大值,之后开始下降,在铁核桃根、叶浸提液处理浓度100 mg/mL时相当于胡桃醌33.4、30.97 μg/mL,介于胡桃醌纯品浓度20和65 μg/mL之间,在胡桃醌处理浓度20、65 μg/mL,4种受体幼苗的抗氧化酶活性持续增高、MDA含量差异不明显、SP含量降低幅度小,而在铁核桃水浸提液作用下,开始抑制受体幼苗的抗氧化酶活性、MDA含量差异显著(除绿豆)、SP含量显著降低,可能与铁核桃根、叶水浸提液含有的其他化感物质[28]有关;由于绿豆幼苗具有较强的调节能力,因此在其抗氧化酶超过阈值酶活性降低时,仍能保持相对稳定的酶活性;白三叶、花生和红三叶3种幼苗的MDA含量明显升高且SP含量降低幅度大,而绿豆幼苗的MDA含量不受处理液影响且SP含量小于其他3种幼苗,表明绿豆幼苗可通过升高抗氧化酶活性来降低对细胞膜的伤害,这一结果与汤绍虎[34]研究相一致。绿豆含有黄酮类化合物、多酚类、生物碱、鞣质、活性酶类等物质,这些物质可能起到抵御外界化感胁迫作用,提高抗氧化能力[35],及时有效地清除细胞内的活性氧,降低化感物质对细胞的损坏,从而保证绿豆的正常生长。后续研究中应分析绿豆种皮及幼苗中可能含有的特殊抗氧化物质,验证各功能成分在抑制化感中的作用。
综上,铁核桃根水浸提液对绿豆种子萌发没有影响,对花生、白三叶等15种绿肥植物种子的发芽和幼苗生长均有显著抑制;铁核桃根、叶水浸提液对绿肥植物幼苗生长的化感趋势一致,但化感效果强于单一胡桃醌;绿豆幼苗清除活性氧的能力高于其他3种绿肥。初步筛选绿豆作为西南地区幼龄铁核桃园的间作绿肥。但需进一步研究绿豆在不同树龄铁核桃园中的生长量及还田效果。
参考文献:
[1] OLIVEIRA B S, AMBROSINI V G, TRAPP T,etal. Nutrition, productivity and soil chemical properties in an apple orchard under weed management[J].NutrientCyclinginAgroecosystems, 2016,104(2): 247-258.
[2] SINGH K, TRIVEDI P, SINGH G,etal. Effect of different leaf litters on carbon, nitrogen and microbial activities of sodic soils[J].LandDegradation&Development, 2016,27(4): 1 215-1 226.
[3] GERMER S, VAN DONGEN R, KERN J. Decomposition of cherry tree prunings and their short-term impact on soil quality[J].AppliedSoilEcology, 2017,117: 156-164.
[4] TREVISAN E, PARTELLI F L, DE OLIVEIRA M G,etal. Growth ofPipernigrumL. and nutrients cycling by intercropping with leguminous species[J].AfricanJournalofAgriculturalResearch, 2017,12(1): 58-62.
[5] PAULO V C Z, DAIANE D C M,etal. Green manure in fruit culture: Aspects on soil quality and use in agriculture[J].AfricanJournalofAgriculturalResearch, 2016,11(17): 1 469-1 474.
[6] 刘茂桥. 贵州核桃主产区核桃园土壤与叶片养分状况及其评价[D]. 贵阳:贵州大学, 2016.
[7] 张信宝, 王世杰, 白晓永, 等. 贵州石漠化空间分布与喀斯特地貌、岩性、降水和人口密度的关系[J].地球与环境, 2013,41(1): 1-6.
ZHANG X B, WANG S J, BAI X Y,etal. The relationship between spatial distribution of rocky desertification in Guizhou and the landform, lithology, precipitation and population density of Karst[J].EarthandEnvironment, 2013,41(1): 1-6.
[8] 盛茂银, 熊康宁, 崔高仰, 等. 贵州喀斯特石漠化地区植物多样性与土壤理化性质[J]. 生态学报, 2015,35(2): 434-448.
SHENG M Y, XIONG K N, CUI G Y,etal. Plant diversity and soil physical-chemical properties in Karst rocky desertification ecosystem of Guizhou, China[J].ActaEcologicaSinica, 2015,35(2): 434-448.
[9] 马红叶, 潘学军, 张文娥, 等. 核桃青皮腐解物对土壤肥力的影响[J]. 西北农林科技大学学报(自然科学版), 2016,44(12): 88-98.
MA H Y, PAN X J, ZHANG W E,etal. Effects of walnut (Juglanssigillata) husk decomposition on soil fertility under various conditions[J].JournalofNorthwestA&FUniversity(Nat.Sci.Ed.), 2016,44(12): 88-98.
[10] 黄建贝, 胡庭兴, 吴张磊, 等. 核桃凋落叶分解对小麦生长及生理特性的影响[J]. 生态学报, 2014,34(23): 6 855-6 863.
HUANG J B, HU T X, WU Z L,etal. Effects of decomposing leaf litter ofJuglansregiaon growth and physiological characteristics ofTriticumaestivum[J].ActaEcologicaSinica, 2014,34(23): 6 855-6 863.
[11] ARANTES A C C, FONTANETTI A, SOARES M R,etal. Agronomic characteristics and yield of organic maize straw intercropped with perennial green manures[J].PesquisaAgropecuriaTropical, 2016,46(3): 222-229.
[12] FAVACHO F S, LIMA J S S,etal. Productive and economic efficiency of carrot intercropped with cowpea-vegetable resulting from green manure and different spatial arrangements[J].RevistaCiênciaAgronmica, 2017,48(2): 337-346.
[13] WEI H, XIANG Y, LIU Y,etal. Effects of sod cultivation on soil nutrients in orchards across China: A meta-analysis[J].SoilandTillageResearch, 2017,169: 16-24.
[14] ERCISLI S, ESITKEN A, TURKKAL C,etal. The allelopathic effects of juglone and walnut leaf extracts on yield, growth, chemical and PNE compositions of strawberry cv. Fern[J].PlantSoilEnviron, 2005,51(6): 283-287.
[15] KOCACЁALISKAN, TERZI I. Allelopathic effects of walnut leaf extracts and juglone on seed germination and seedling growth[J].JournalofHorticulturalScience&Biotechnology, 2001,76(4): 436-440.
[16] TERZI I. Allelopathic effects of juglone and walnut leaf and fruit hull extracts on seed germination and seedling growth in muskmelon and cucumber[J].AsianJournalofChemistry, 2009,21(3): 1 840-1 846.
[17] JALILI A, ALIPOUR S, SADEGHZADE A. Allelopathic effects of juglone and decomposed walnut leaf juice on corn, cucumber, radish, onion and bread wheat seed germination and seedling growth[J].BiosciencesBiotechnologyResearchAsia, 2016,9(2): 585-591.
[20] 史斌斌, 张文娥, 潘学军, 等. 铁核桃叶片多酚类物质含量及其抗氧化活性[J]. 园艺学报, 2017,44(1): 23-32.
SHI B B, ZHANG W E, PAN X J,etal. Phenolics content and antioxidant activity of walnut (Juglanssigillata) leaves[J].ActaHorticulturaeSinica, 2017,44(1): 23-32.
[21] 赵世杰, 史国安, 董新纯. 植物生理学实验指导[M]. 北京:中国农业科学技术出版社, 2002.
[22] 陈 锋, 孟永杰, 帅海威, 等. 植物化感物质对种子萌发的影响及其生态学意义[J]. 中国生态农业学报, 2017,25(1): 36-46.
CHEN F, MENG Y J, SHUAI H W,etal. Effects of plant allelochemicals on seed germination and its ecological significance[J].ChineseJournalofEco-Agriculture, 2017,25(1): 36-46.
[23] BAHUGUNA S, BAHUGUNA A, PRASAD B,etal. Seed germination and seedling growth of wheat and barley influenced by the allelopathic effect of walnut (JuglansregiaL.) leaf extracts under mid hills of Uttarakhand Agri-Silvisystem[J].AsianJournalofAgriculturalResearch, 2014,8(3):164-169.
[24] 孔垂华,胡 飞.植物化感作用及其应用[M].北京:中国农业出版社, 2016.
[26] TERZI I. Allelopathic effects of juglone and decomposed walnut leaf juice on muskmelon and cucumber seed germination and seedling growth[J].AfricanJournalofBiotechnology, 2008,7(12): 1 870-1 874.
[27] CUI C, CAI J, JIANG Z,etal. Effects of walnut (JuglansregiaL.) root exudates on germination, seedling growth and enzymatic activities of turnip (BrassicarapaL.)[J].AllelopathyJournal, 2011,28(2): 237-250.
[28] 郑 丽, 冯玉龙. 紫茎泽兰叶片化感作用对10种草本植物种子萌发和幼苗生长的影响[J]. 生态学报, 2005,25(10): 2 782-2 787.
ZHENG L, FENG Y L. Allelopathic effects ofEupatoriumadenophorumSpreng. on seed germination and seedling growth in ten herbaceous species[J].ActaEcologicaSinica, 2005,25(10): 2 782-2 787.
[29] 申时才, 徐高峰, 张付斗, 等. 红薯叶片浸提液对5种主要农田杂草种子萌发及幼苗生长的化感作用[J]. 生态学报, 2017,37(6): 1 931-1 938.
SHEN S C, XU G F, ZHANG F D,etal. Allelopathic effects of water extracts from sweet potato (Ipomoeabatatas) leaves on five major farming weeds[J].ActaEcologicaSinica, 2017,37(6): 1 931-1 938.
[30] WU A P, YU H, GAO S Q,etal. Differential belowground allelopathic effects of leaf and root ofMikaniamicrantha[J].Trees, 2009,23(1): 11-17.
[32] BOGATEK R, GNIAZDOWSKA A. ROS and phytohormons in plant-plant allelopathic interaction[J].PlantSignaling&Behavior, 2007,2(4): 317-318.
[33] MAHDAVIKIA F, SAHARKHIZ M J, KARAMI A. Defensive response of radish seedlings to the oxidative stress arising from phenolic compounds in the extract of peppermint (Mentha×piperitaL.)[J].ScientiaHorticulturae, 2017,214: 133-140.
[34] 汤绍虎, 周启贵, 孙 敏, 等. 外源NO对渗透胁迫下黄瓜种子萌发、幼苗生长和生理特性的影响[J]. 中国农业科学, 2007,40(2): 419-425.
TANG S H, ZHOU Q G, SUN M,etal. Effects of exogenous nitric oxide on seed germination, seedling growth and physiological characteristics of cucumber under osmotic pressure[J].ScientiaAgriculturaSinica, 2007,40(2): 419-425.
[35] CHUNG L Y. The antioxidant properties of garlic compounds: allyl cysteine, alliin, allicin, and allyldisulfide[J].JournalofMedicinalFood, 2006,9(2): 205-213.

