干旱胁迫对远志种子萌发及幼苗生长和生理特性的影响
彭 亮,杨冰月,张 岗,赵 停,孙 涛,胡本祥
(陕西中医药大学 药学院,陕西省中药基础与新药研究重点实验室,西安 712046)
干旱是影响植物生长发育、次生代谢产物积累和产量的重要环境因子之一,且其影响随着全球气候变暖呈扩大化趋势[1-2]。植物在进化过程中为了适应缺水等逆境,演化出了一套自身的适应机制,通过生长发育到渗透调节物质及保护酶体系等生理生化的变化,以抵御或耐受干旱环境的影响,这也是植物和药用植物生理领域研究的热点问题之一[3]。在干旱地区,种子萌发和幼苗生长这两个最脆弱的阶段是决定植物能否正常生长的关键时期,而耐旱性较好的药用植物,其种子在缺水环境下常常会形成特殊的萌发机制以确保萌发与繁衍。同时,干旱胁迫可引起植物幼苗失水,诱发渗透胁迫及活性氧损伤。为了保持体内的水分平衡,使细胞发挥正常功能,抵御干旱胁迫伤害,植物的细胞液渗透势会降低、气孔关闭推迟,同时酶促保护系统中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、丙二醛(MDA)和抗坏血酸过氧化物酶(APX)等酶的合成活动增强[4-6]。聚乙二醇(PEG)作为一种渗透调节剂,能较为理想地模拟干旱环境,具有简便快速、重复性好、周期短等优点,已广泛应用于种子和幼苗与渗透及干旱胁迫等相关的试验,并在药用植物决明子[7]、白芷[8]、黄芩[9]等种子种苗的抗旱特性方面取得了较好的研究成果。
远志(PolygalatenuifoliaWilld.)为远志科(Polygalaceae)远志属(Polygala)多年生草本植物,干燥根为中国传统大宗中药材。其味苦、辛,性温,具有宁心安神、祛痰开窍、解毒消肿的功效[7]。远志广泛分布于中国西北、华北和东北地区,以陕西、山西产量最大、质量最优,是一种适应性极强的中旱生植物,喜凉爽忌高温,耐干旱怕水涝[10]。目前,国内外对远志的研究集中在质量控制、药用成分和药理作用等方面[11-12]。同时,由于其良好的药理作用,远志药材国内市场需求量和出口量不断增加,野生资源已经无法满足药材需求。为了解决远志的药材资源问题,亟待通过人工栽培以形成规模化的种植基地,而有关远志种子萌发和幼苗生长对干旱环境的适应能力及相关生理机制研究鲜见报道。因此,本试验以远志为材料,通过PEG-6000人工模拟不同程度的干旱胁迫,研究干旱胁迫对远志种子萌发、幼苗生长、叶绿素含量、渗透调节物质、抗氧化酶系统等生理生化特性的影响,以期了解远志种子及幼苗对干旱环境的适应机制,为远志的育种栽培提供理论依据。
1 材料和方法
1.1 实验材料
供试的远志种子采集于陕西省淳化县远志规范化栽培基地,经陕西中医药大学药学院胡本祥教授鉴定为远志(PolygalatenuifoliaWilld.)的干燥成熟种子。
1.2 试验设计
1.2.1种子萌发试验选取大小均一的优质远志种子,先用 2%次氯酸钠浸泡消毒15 min,再用蒸馏水冲洗直至无次氯酸钠后浸种24 h待用。以经高压灭菌锅灭菌处理的培养皿(直径 9 cm,内铺有2 层滤纸)作为发芽床,将供试种子均匀排布在加有等量质量分数分别为0(蒸馏水,CK)、2.5%、5%、10%、15%、20%、25%和30% PEG-6000的发芽床中,每床50粒,精确称取质量后置于光照培养箱中进行萌发测定,培养条件为温度25 ℃、光照时间 12 h/d。每天向滤纸加蒸馏水或PEG6000溶液以保持原始质量,隔天换纸1次,每处理重复4次。每天16:00观察并记录远志种子萌发情况,种子发芽的标准为种子露出1 mm 以上的胚根,连续3 d无萌发种子视为萌发结束。计算发芽启动时间、发芽持续时间,第8 天统计发芽势,最后计算发芽率、发芽指数和活力指数。发芽结束后,每重复取10株幼苗测量其胚根和胚芽长度,计算平均值,同时称取幼苗鲜重,干燥至恒重后称取干重。相关指标计算公式如下:
发芽启动时间:从发芽试验开始到第1粒种子开始萌发所需时间(天数)
发芽率(GR) = 种子发芽数/供试种子总数×100%
相对发芽率=处理 GR/对照 GR
发芽势 = 规定时间内发芽种子总数/供试种子总数×100%
发芽指数(GI) = ∑(在不同时间的发芽数/相应的发芽天数)
活力指数(VI)=发芽指数×胚芽长度(mm)
1.2.2幼苗干旱胁迫试验将沙土和有机质土按质量比4∶1配成基质,等量分装于塑料盆(30×35 cm)中,每盆播种25粒远志种子,添加适量的蒸馏水后放入人工气候箱中进行培养 (温度28 ℃,光照时间24 h)。待子叶离开土面1 cm后,光照条件变为光照12 h(28 ℃,光强500 μmol·m-2·s-1)。幼苗长至4叶期后进行定苗,每盆选取发育良好且大小一致的幼苗5株继续培养,待8叶期进行模拟干旱胁迫处理。根据种子萌发试验的结果,设置PEG-6000质量分数分别为2.5%、5%、10%、15%和20%的胁迫梯度以及对照(蒸馏水,CK),每个处理5盆,3次重复。每天18:00用称重法补充PEG-6000溶液至原始质量,分别于干旱胁迫处理的第5、10和15 天,取幼苗叶片放入液氮速冻后转移至-80 ℃冰箱保存,用于测定幼苗叶片的各项生理指标。
1.3 测定指标及方法
叶绿素含量测定采用乙醇-丙酮混合液浸泡法[13],单位表示为mg·g-1;SOD活性采用氮蓝四唑(NBT)光化还原法[13],以每分钟抑制光化还原 50% 的酶用量为1个酶活性单位(U);POD 测定采用愈创木酚法[14],以每分钟内吸光度(A470)变化0.01为1 个酶活性单位(U);CAT 活性采用紫外吸收法[14],以每分钟内吸光度(A240)变化0.01为1个酶活性单位(U);丙二醛(MDA)含量采用硫代巴比妥酸法[13],单位表示为μg·g-1;脯氨酸(Pro)含量的测定采用酸性茚三酮法[13],单位表示为μg·g-1;可溶性蛋白含量采用考马斯亮蓝G-250法测定[13],单位表示为mg·g-1;可溶性糖含量采用蒽酮比色法测定[13],单位用百分比表示。
1.4 数据处理
采用Microsoft Excel 2013软件对数据进行处理,测定结果表示为(平均值±标准差)形式, 用SPSS18.0软件进行方差分析,Duncan法进行多重比较分析,Original 8.0绘图。
2 结果与分析
2.1 干旱胁迫对远志种子萌发的影响
种子在条件合适时开始萌发,其萌发能力和活力水平可通过发芽启动时间、发芽率和活力指数等指标体现。远志种子萌发进程(图1)显示,对照组(CK)种子在培养的第1 天时就开始启动发芽,第7 天时大量萌发,平均萌发种子数为26;2.5%、5%和10%PEG胁迫处理种子在第1 天有个别重复启动发芽,第7 天时平均萌发种子数分别为24、22、22;15%PEG胁迫处理种子到第2 天才有1个重复出现萌发,第7 天时平均萌发种子数为19;20% PEG胁迫处理下种子启动发芽时间则推迟到第4 天,第7 天时平均萌发种子数为7;25%和30% PEG胁迫处理下种子未见萌发。
同时,远志种子发芽率、相对发芽率、发芽势、发芽指数和活力指数随PEG胁迫处理浓度的加大而呈逐渐下降趋势(表1),且影响效应随胁迫浓度不同呈现出差异性。其中,在发芽率方面,2.5%、5%、10%和15%PEG胁迫处理与对照无显著性差异;在相对发芽率、发芽势、发芽指数方面,2.5%、5%和10% PEG胁迫处理与对照无显著性差异;在活力指数方面,仅2.5% PEG胁迫处理与对照无显著性差异。20% PEG胁迫处理下远志种子萌发的各项指标急剧下降,与对照差异均显著(P<0.05),发芽率仅为对照的53.93%;胁迫浓度在25%及以上时则已完全抑制了远志种子萌发,各项指标全部为0(30% PEG胁迫下各项指标也全部为0,因与25%PEG胁迫处理一致,数据未列出)。
2.2 干旱胁迫对远志胚根和胚芽生长的影响
表2显示,随着PEG-6000模拟干旱胁迫强度的增加,远志胚芽长度表现出逐渐降低的趋势,除2.5% PEG胁迫处理外,5%~20% PEG胁迫处理胚芽长度与对照组差异显著(P<0.05),分别为对照组的74.81%、72.09%、53.32%和40.51%,表明干旱胁迫会抑制远志幼苗胚芽的生长,且浓度越大抑制作用越大。同时,远志胚根长度随干旱胁迫强度增加呈现出先增长后缩短的趋势。其中,15% PEG胁迫处理下胚根最长,为对照组的1.78倍;2.5%、5%和10%胁迫处理下胚根长度分别为对照组的1.05、1.26和1.64倍;20% PEG胁迫处理下胚根长度显著缩短,仅为对照组的52.03%,说明2.5%~15% PEG胁迫处理能够促进远志幼苗胚根生长,使其更好地吸取水分以适应干旱环境,但当PEG胁迫浓度增加到20% 时,由于严重缺水而抑制远志幼苗胚根的生长。另外,随着PEG胁迫强度的增加,远志幼苗的鲜重呈逐渐下降趋势,其在2.5%、5%、10%、15%和20% PEG胁迫处理下分别为对照组的70.96%、62.95%、54.94%、54.93%和53.78%,说明干旱胁迫会显著抑制幼苗的生物量积累(P<0.05);远志幼苗干重随PEG浓度增大而逐渐增加,并均显著高于对照组,增幅为22.06%~189.71%(P<0.05);远志幼苗含水量随着PEG浓度的增大而逐渐减小,证明了植株在干旱胁迫下会抑制幼苗汲取所需水分,造成含水量下降。
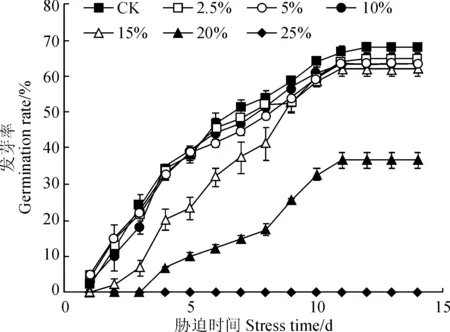
图1 干旱胁迫处理下远志萌发进程Fig.1 The seed germinating progress of P. tenuifolia under drought stress
2.3 干旱胁迫对远志幼苗叶片叶绿素和渗透调节物质含量的影响
首先,远志幼苗的叶绿素含量因胁迫强度和胁迫时间的不同而表现出差异性(图2,A)。其中,2.5%~10% PEG胁迫处理幼苗叶片叶绿素含量随胁迫强度的增加和时间的延长而不断上升,并均显著高于同期对照(P<0.05),如叶绿素含量在10% PEG胁迫处理第15 天(3.29 mg·g-1)时为对照的1.43倍。15%和20% PEG胁迫处理下,幼苗叶片叶绿素含量在第5 天均显著高于同期对照,在第10天时虽出现下降但仍高于对照组,在第15 天继续下降并显著低于同期对照组,并以20% PEG胁迫处理的含量最低(1.86 mg·g-1)。上述结果表明,随着干旱胁迫时间的延长,远志幼苗能够适应一定程度的干旱胁迫,但严重的干旱胁迫也会导致远志幼苗叶片的光合系统受损。

表1 不同浓度PEG 6000处理下远志种子萌发情况
注:同列数据后标不同小写字母表示处理间在0.05水平差异显著(P<0.05);下同
Note: Different lowercase letters in same column indicate the significant difference among different PEG treatments at 0.05 level. The same as below
其次,游离脯氨酸、可溶性糖和可溶性蛋白能够参与植物细胞水势的调节,是植物体内3种重要的渗透调节物质,具有广泛的生理作用[15]。由图2,B~D可知,远志幼苗中游离脯氨酸、可溶性糖和可溶性蛋白的含量随着胁迫强度的增加和胁迫时间的延长而持续上升,并大多显著高于同期对照(P<0.05)。其中,20% PEG胁迫处理第15天时,游离脯氨酸、可溶性糖和可溶性蛋白含量分别为424.67 μg·g-1、3.59%、7.04%,分别是同期对照组的1.99、1.53、1.50倍。这表明随着干旱胁迫程度的加重,远志幼苗体内会积累较多的脯氨酸来适应干旱环境,同时又通过可溶性蛋白含量的增加来提升细胞的持水力和可溶性糖含量的增加来降低细胞水势,最终协同作用以降低干旱胁迫对远志幼苗的损害。
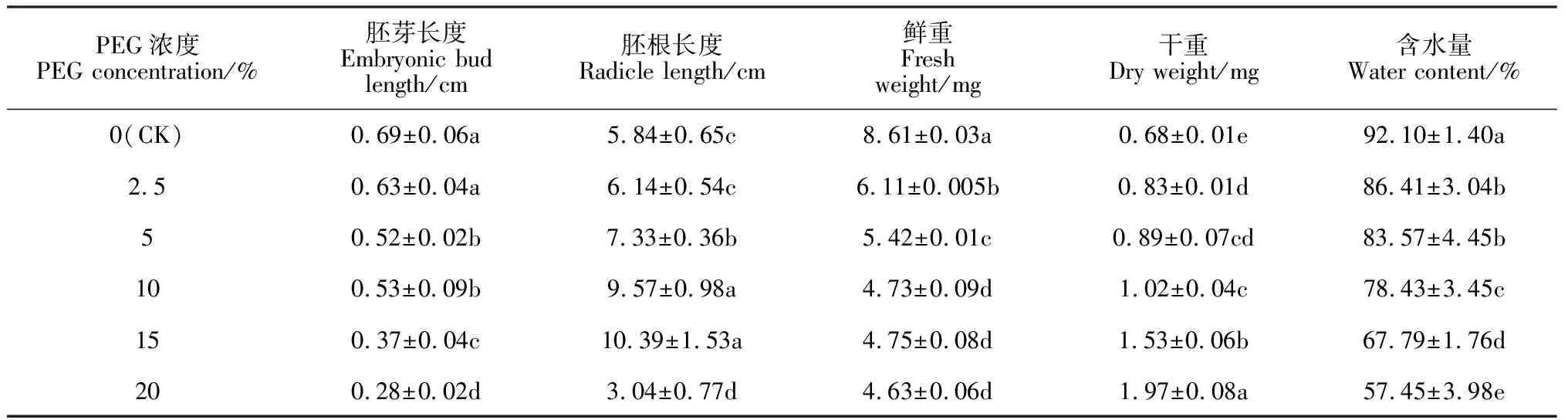
表2 不同浓度PEG 6000下远志幼苗生长情况
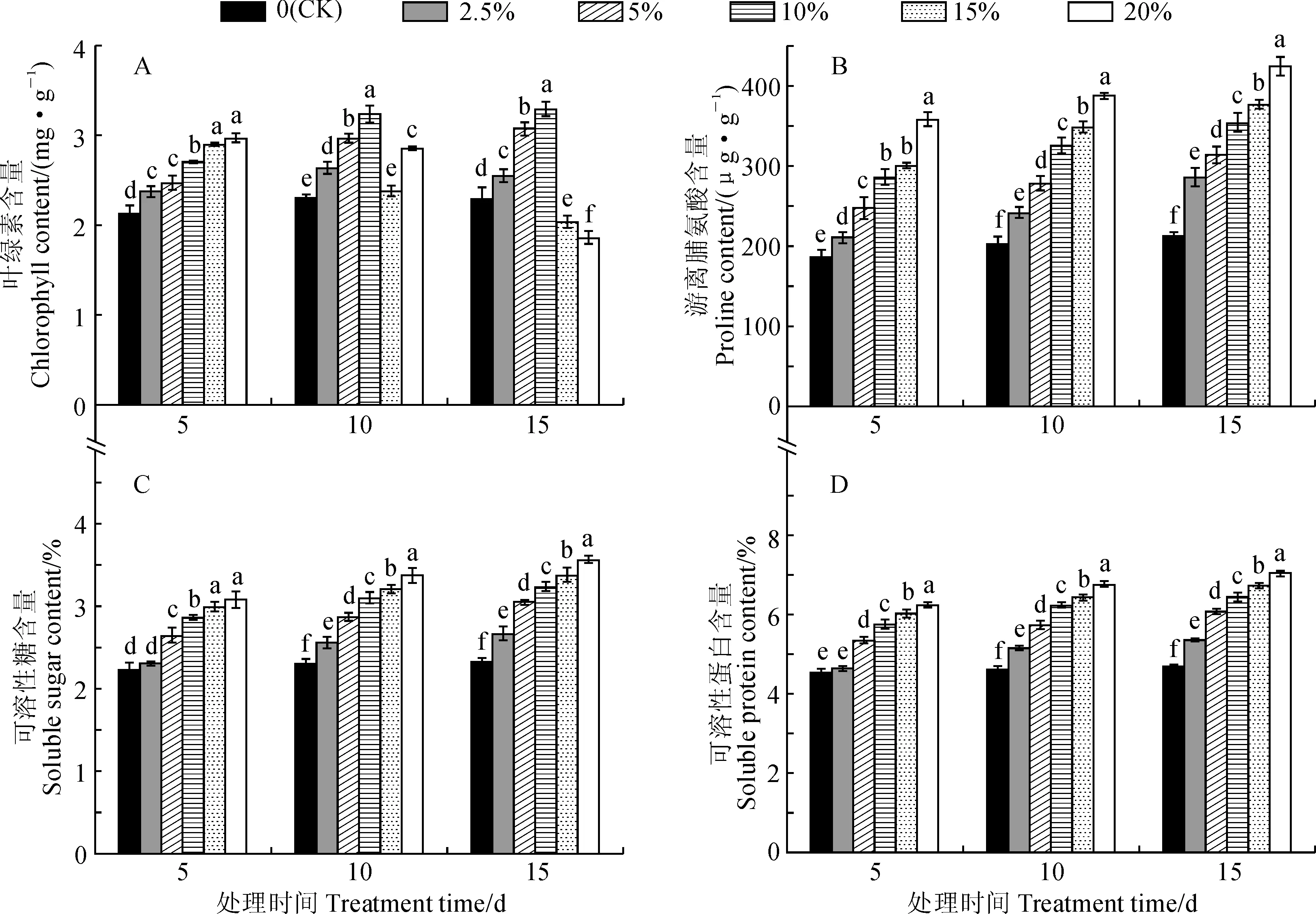
图2 干旱胁迫下远志幼苗叶绿素、游离脯氨酸、可溶性糖和可溶性蛋白含量的变化Fig.2 Dynamics of chlorophyll, proline, soluble sugar and soluble protein content in seedling leaves of P. tenuifolia under drought stress
2.4 干旱胁迫对远志幼苗抗氧化酶活性和膜脂过氧化作用的影响
另外,干旱胁迫处理初期(第5 天)时,远志幼苗MDA含量随着胁迫强度的增加而上升,但幅度较小,但各处理组与对照组相比仍差异显著(P<0.05);在胁迫第10天时,处理组幼苗MDA含量明显增高,尤其是15%和20% PEG胁迫处理增幅更大;在胁迫第15 天时,2.5%~10% PEG胁迫处理幼苗MDA含量与第10天相比稍有降低,但15%和20% PEG胁迫处理MDA含量持续升高;20% PEG胁迫处理第15 天幼苗的MDA含量达到最高(759.73 μg·g-1),是同期对照组的3.01倍(图3,D)。以上结果说明,随着干旱胁迫时间延长,远志幼苗可以抵抗一定程度的干旱胁迫诱导的膜脂过氧化作用伤害,且得到明显缓和,但干旱胁迫程度过高仍会导致远志幼苗质膜出现明显损坏。
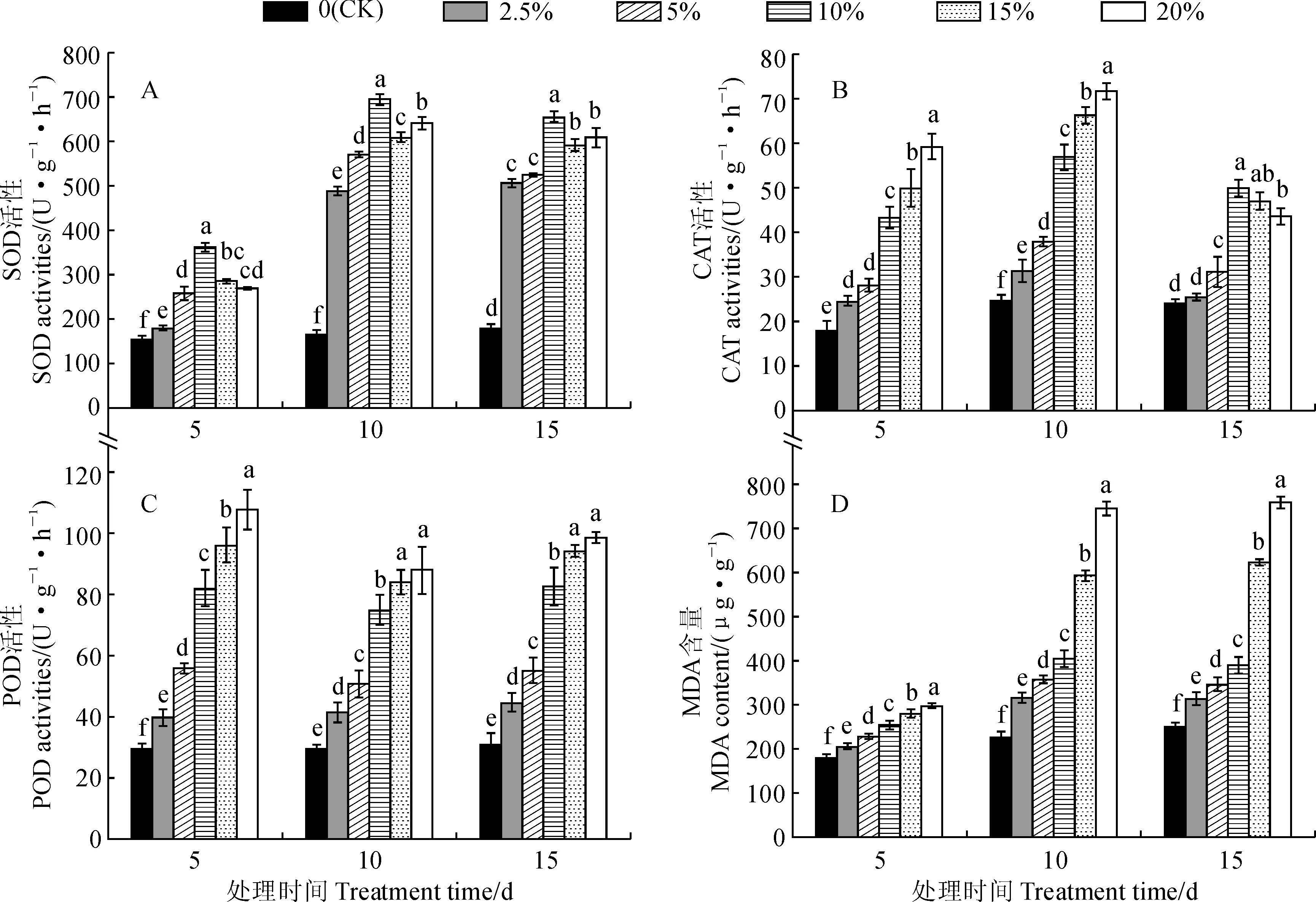
图3 干旱胁迫处理下远志幼苗SOD、CAT、POD活性和MDA含量的变化Fig.3 Dynamics of SOD, CAT, POD activity and MDA content in seedling leaves of P. tenuifolia under drought stress
3 讨 论
干旱胁迫是影响药用植物生长发育的重要环境因子之一,而植物种子萌发和幼苗生长阶段是对外界环境变化响应最为敏感和脆弱的时期[18]。因此,通过模拟干旱环境来考察药用植物种子萌发和幼苗生长情况,评价其应对干旱胁迫的生理机制和抗逆性,相关指标可反映其耐旱能力,具有较高的实际和理论价值。PEG-6000作为渗透调节剂,已广泛应用于不同植物的干旱环境模拟方面[19],本试验通过对PEG-6000模拟干旱胁迫下远志种子萌发相关指标及幼苗生理特性进行分析,可以对远志种子和种苗的抗旱性有一个初步的了解。
药用植物种子萌发指标是反映其耐旱性能的最直接指标,本研究结果表明远志种子能在PEG浓度为10%的干旱胁迫下正常萌发,发芽启动时间、发芽率、相对发芽率、发芽势和发芽指数与对照组无显著性差异;15%PEG胁迫处理虽然会延缓远志种子发芽的启动时间,相对发芽率、发芽势、发芽指数和活力指数显著低于对照组(P<0.05),但最终发芽率与对照相比无显著差异;而当PEG胁迫浓度为20%时,远志种子萌发受到强烈抑制,浓度达到25%时已完全致死,这与李文鹤等[20]在野菊中的相关研究结果一致。同时,根系是植物吸收水分的主要器官,其生长与植物的抗旱性呈正相关关系,本研究中远志幼苗胚根长度随PEG处理浓度增加而先增长后缩短,与黄芩[9]相关研究结果类似,低中浓度的PEG胁迫可促进根的生长,而高浓度PEG则抑制根的生长。说明远志种子和幼苗对于干旱胁迫具有极强的耐受能力,在轻、中程度干旱胁迫下种子可以正常萌发,幼苗会通过胚根加长以适应干旱环境,但胁迫程度过高时会抑制种子萌发和胚根生长甚至致死。
叶绿素是植物进行光合作用的物质基础,其含量可作为评价干旱环境下植物耐受性的重要指标之一。为了应对干旱胁迫,植物叶片中叶绿素含量会出现适应性变化以保证对光能的充分利用,提高转化率以保证碳同化,增强体内的代谢活动。本研究中,远志幼苗叶绿素含量在胁迫初期(第5天)随着PEG胁迫浓度的增加而上升,可能是远志幼苗叶片由于所处干旱环境导致含水量降低,叶绿素含量相对上升,与植物对外在胁迫的补偿和超补偿效应相关[21];随着干旱胁迫时间的延长,远志幼苗叶片叶绿素含量在PEG胁迫浓度为10%时持续增高并相对稳定,而在15%和20% PEG胁迫处理下则随着胁迫时间的延长下降明显,可认为远志属于抗旱性较好的药用植物,随着胁迫时间的延长已适应一定程度的干旱胁迫,叶绿素含量增加且较为稳定。然而,严重干旱胁迫会致使远志幼苗叶片内叶绿素含量急剧下降,因为严重干旱胁迫能够阻碍植物叶片内叶绿素合成并加速已合成的叶绿素降解[22]。
游离脯氨酸、可溶性糖和可溶性蛋白作为3种重要的渗透调节物质,广泛存在于植物体内并在植物响应干旱胁迫时大量增加以发挥生理保护作用[4]。本研究发现远志幼苗中游离脯氨酸、可溶性糖和可溶性蛋白的含量随着干旱胁迫强度的增加和胁迫时间的延长而增加,分析其原因可能是远志幼苗为了抵御或适应干旱环境,通过增加体内合成可溶性糖和蛋白数量来达到降低原生质的渗透势,以保持细胞的膨压,使细胞易于从较低水势的外界介质中吸收水分,保护细胞免于损伤以提高其对干旱环境的适应性,这已在药用植物杠柳的干旱胁迫研究中得到证实[23]。植物体内的脯氨酸会在其面对高温和干旱等逆境胁迫时大量积累,其含量高低可以一定程度上反映植物遭受干旱胁迫伤害的程度,远志幼苗遭受干旱胁迫时体内会积累较多的脯氨酸,且脯氨酸含量与胁迫程度和时间呈正相关,表明远志幼苗随着干旱胁迫强度的增加,其体内需要产生大量的脯氨酸来应对外界的干旱胁迫,这与许多植物干旱胁迫研究中的结果一致[24-25]。
POD、SOD和CAT普遍存在于植物体内,是植物体内的重要抗氧化酶,与植物的生理生化活动关系密切。干旱或水分胁迫时,上述3种酶可协同起作用,有效清除活性氧及其他过氧化物自由基,缓解外在环境胁迫对植物造成的伤害[23]。本研究结果表明,随着胁迫强度的增加和胁迫时间的延长,远志幼苗的SOD活性和CAT活性均表现为先上升后下降的趋势,POD活性则在胁迫初期就表现出最强的活性,与在栓皮栎[26]、鹿角杜鹃[27]等植物中的研究一致,说明在遭受干旱胁迫时远志幼苗体内的抗氧化酶系统能通过复杂的协同调控发挥减少活性氧积累的作用,但严重干旱胁迫下活性氧的增加已超过抗氧化酶系统的负荷而对其造成伤害,从而引起酶活性的下降。MDA能通过结合膜上的酶和蛋白质而破坏质膜的完整性,并导致选择透性丧失,其含量高低可以反映植物受干旱胁迫伤害程度的大小[28]。本研究中远志幼苗遭受干旱胁迫时,叶片MDA含量显著增加,细胞膜出现损伤,膜透性降低;而随着干旱胁迫时间的延长,低、中浓度胁迫下的叶片MDA含量又有所下降,高浓度胁迫下MDA含量持续上升,说明远志幼苗可通过生理调节作用修复生理机能以适应一定程度的干旱环境,具有较强的抗干旱能力,然而胁迫强度过大会导致远志幼苗细胞膜出现严重损伤,加剧膜脂过氧化程度,导致生理劣变。
综上所述,远志种子具有较好的干旱耐受能力,在轻、中程度的干旱环境中可正常萌发,严重干旱环境中仍有种子萌发。同时,远志幼苗能通过调节自身生长和叶绿素含量、渗透调节物质、保护酶系统、丙二醛含量等来抵抗所处干旱环境的伤害,表现出较好的耐旱性。远志是中国常用中药材之一,市场需求量大,经济价值较高,人工种植过程中可以在其种子萌发和幼苗生长阶段给予一定的干旱胁迫以提升其抗旱能力,严重干旱环境中需要提供水分使其种子萌发和保证幼苗正常生长。本研究结论对于揭示远志种子及幼苗适应干旱环境的机制,指导远志在人工栽培过程中的种子种苗处理以及抗旱措施具有重要的理论和现实意义。
参考文献:
[1] 黄璐琦, 郭兰萍. 环境胁迫下次生代谢产物的积累及道地药材的形成[J]. 中国中药杂志, 2007,32(4): 277-280.
HUANG L Q, GUO L P. Secondary metabolites accumulating and geoherbs formation under enviromental stress[J].ChinaJChinMaterMed, 2007,32(4): 227-280.
[2] 周 洁,郭兰萍,张 霁,等.药用植物对干旱胁迫的响应及受控实验[J].中国中药杂志,2010,35(15): 1 919-1 924.
ZHOU J, GUO L P, ZHANG J,etal. Responses of medicinal plants to drought stress and controlled experiments[J].ChinaJChinMaterMed, 2010,35(15): 1 919-1 924.
[3] SELMER D, KLEINWACHTER M. Stress enhances the synthesis of secondary plant products: the impact of stress-related over-reduction on the accumulation of natural products[J].PlantandCellPhysiology, 2013,54(6): 817-826.
[4] AHMAD P, MOHD R W.Physiological mechanisms and adaptation strategies in plants under changing environment[M]. Springer Science & Business Media, 2013: 120-132.
[5] 周 洁, 黄璐琦, 郭兰萍, 等. 干旱胁迫下苍术幼苗生理特性变化研究[J]. 中国中药杂志, 2008,33(19): 2 163-2 166.
ZHOU J, HUANG L Q, GUO L P,etal. Study on effect of drought stress on physiological adaption of seedlings ofAtractylodeslancea[J].ChinaJChinMaterMed, 2008,33(19): 2 163-2 166.
[6] ZHU Z, LIANG Z S, HAN R L. Saikosaponin accumulation and antioxidative protection in drought-stressedBupleurumchinenseDC. plants[J].EnvironmentalandExperimentalBotany, 2009,66(2): 326-333.
[7] 喻泽莉, 何 平, 张春平, 等. 干旱胁迫对决明种子萌发及幼苗生理特性的影响[J]. 西南大学学报: 自然科学版, 2012,34(2): 39-44.
YU Z L, HE P, ZHANG C P,etal. Effects of drought stress on seed germination and physiological characteristics ofCassiaobtusifoliaL. seedlings[J].JSouthwestUniv(Nat. Sci. Ed.), 2013, 2012,34(2): 39-44.
[8] 陈郡雯, 吴 卫, 郑有良, 等. 聚乙二醇 (PEG-6000) 模拟干旱条件下白芷苗期抗旱性研究[J]. 中国中药杂志, 2010,35(2): 149-153.
CHEN J W, WU W, ZHENG Y L,etal. Drought resistance ofAngelicadahuricaduring seedling stage under polyethylene glycol (PEG-6000)-simulated drought[J].ChinaJChinMaterMed, 2010,35(2): 149-153.
[9] 袁 媛, 李 娜, 邵爱娟, 等. PEG6000 处理对黄芩种子萌发和幼苗生长的影响[J]. 中草药, 2008,39(2): 269-272.
YUAN Y, LI N, SHAO A J,etal. Effect of PEG 6000 on seed germination and seedling growth ofScutellariabaicalensis.[J].ChinTraditHerbDrugs, 2008,39(2): 269-272.
[10] 张福生, 陈彤垚, 王丹丹, 等. 远志药材商品规格等级与品质的关联性研究进展[J]. 中草药, 2017,48(12): 2 538-2 547.
ZHANG F S, CHEN T K, WANG D Detal. Research progress in correlation between commodity specification level and quality ofPolygalatenuifolia.[J].ChinTraditHerbDrugs, 2017,48(12): 2 538-2 547.
[11] 张陶珍, 荣巍巍, 李 清, 等. 远志的研究进展[J]. 中草药, 2016,47(13): 2 381-2 389.
ZHANG T Z, RONG W W, LI Qetal. Research progress onPolygalaeradix[J].ChinTraditHerbDrugs, 2016,47(13): 2 381-2 389.
[12] LI S, LIU S, LIU Z,etal. Bioactivity screening, extraction, and separation of lactate dehydrogenase inhibitors fromPolygalatenuifoliaWilld. based on a hyphenated strategy[J].JournalofSeparationScience, 2017,40(6): 1 385-1 395.
[13] 李合生. 植物生理生化试验原理和技术[M]. 北京:高等教育出版社, 2006.
[14] 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社, 2006.
[15] ZAHRA S, AMIN B, ALI V,etal. The salicylic acid effect on the tomato (LycopersicumesculentumMill.) sugar, protein and proline contents under salinity stress (NaCl)[J].JournalofBiophysicsandStructuralBiology, 2011,2(3): 35-41.
[16] ZHANG X, ERVIN EH, LIU Y,etal. Differential responses of antioxidants, abscisic acid, and auxin to deficit irrigation in two perennial ryegrass cultivars contrasting in drought tolerance[J].JournaloftheAmericanSocietyforHorticulturalScience, 2015,140(6): 562-572.
[17] ZHANG L X, LAI J H, LIANG Z S,etal. Interactive effects of sudden and gradual drought stress and foliar-applied glycinebetaine on growth, water relations, osmolyte accumulation and antioxidant defence system in two maize cultivars differing in drought tolerance[J].JournalofAgronomyandCropScience, 2014,200(6): 425-433.
[18] MATIAS L, GONZALEZ-DIAZ P, JUMP A S. Larger investment in roots in southern range-edge populations of scots pine is associated with increased growth and seedling resistance to extreme drought in response to simulated climate change[J].EnvironmentalandExperimentalBotany, 2014,105(4): 32-38.
[19] MAHESH K, BALARAJU P, RAMAKRISHNA B,etal. Effect of brassinosteroids on germination and seedling growth of radish (RaphanussativusL.) under PEG-6000 induced water stress[J]. AmericanJournalofPlantSciences, 2013,4(12): 2 305-2 313.
[20] 李文鹤,何 淼,卓丽环.PEG处理对野菊花种子萌发期抗旱性的影响[J].种子, 2010,11(11): 51-54.
LI W H, HE M, ZHUO L H. Effect of PEG-6000 onDendranthemaindicumseed drought resistance during germination[J].Seed, 2010,11(11): 51-54.
[21] KALAJI H M, JAJOO A, OUKARROUM A,etal. Chlorophyll a fluorescence as a tool to monitor physiological status of plants under abiotic stress conditions[J].ActaPhysiologiaePlantarum, 2016,38(4): 102-112.
[22] YANG Y, TANG M, SULPICE R,etal. Arbuscular mycorrhizal fungi alter fractal dimension characteristics ofRobiniapseudoacaciaL. seedlings through regulating plant growth, leaf water status, photosynthesis, and nutrient concentration under drought stress[J].JournalofPlantGrowthRegulation, 2014,33(3): 612-625.
[23] 安玉艳, 梁宗锁, 郝文芳, 等. 杠柳幼苗对不同强度干旱胁迫的生长与生理响应[J]. 生态学报, 2011,31(3): 716-725.
AN Y Y, LIANG Z S, HAO W F,etal. Growth and physiological responses of thePeriplocasepiumBunge seedlings to drought stress[J].ActaEcologicaSinica, 2011,31(3): 716-725.
[24] REJEB K B, ABDELLY C, SAVOURE A. How reactive oxygen species and proline face stress together[J].PlantPhysiologyandBiochemistry, 2014,80(12): 278-284.
[25] RIZWAN M, ALI S, IBRAHIM M,etal. Mechanisms of silicon-mediated alleviation of drought and salt stress in plants: a review[J].EnvironmentalScienceandPollutionResearch, 2015,22(20): 15 416-15 431.
[26] 李志萍,张文辉,崔豫川. PEG模拟干旱胁迫对栓皮栎种子萌发及生长生理的影响[J]. 西北植物学报,2013,33(10): 2 043-2 049.
LI Z P, ZHANG W H, CUI Y C. Effects of PEG simulated drought stress on seed germination and growth physiology ofQuercusvariabilis[J].ActaBotanicaBoreali-OccidentaliaSinica, 2013,33(10): 2 043-2 049.
[27] 李 畅,苏家乐,刘晓青,等. 干旱胁迫对鹿角杜鹃种子萌发和幼苗生理特性的影响[J]. 西北植物学报,2015,35(7): 1 421-1 427.
LI C, SU J L, LIU X Q,etal. Effects of drought stress on seed germination and seedling physiological characteristics ofPhododendronlatoucheae[J].ActaBotanicaBoreali-OccidentaliaSinica, 2015,35(7): 1 421-1 427.
[28] AMMAR M H, ANWAY F, EL-HARTY E H,etal. Physiological and yield responses of faba bean (ViciafabaL.) to drought stress in managed and open field environments[J].JournalofAgronomyandCropScience, 2015,201(4): 280-287.

