镉在水生植物中的富集与亚细胞分布及其化学形态特征
杨 登,张 昊,邹慧玲,4,尹晓辉,方雅瑜,陈 楠,魏祥东*
(1 湖南农业大学 资源环境学院,长沙 410128;2 广东省环境保护工程研究设计院有限公司,广州 510030;3 湖南农业大学 南方稻田重金属污染防控协同创新中心,长沙 410128;4 湖南农业大学 图书馆,长沙 410128)
近年来,由于工矿业废水的大肆排放及化肥农药的不合理使用,致使中国水体重金属污染日趋严重。水体中过量的重金属通过灌溉进入土壤会造成土壤板结和肥力下降;进入植物体会使植物出现茎叶枯黄和生长停滞,以及光合作用下降等毒害症状,且能通过食物链进入人体,导致人体机能失常,危害人类健康[1-2]。水体重金属污染的物理和化学修复技术成本高昂且易产生二次污染,因此绿色环保、操作简单的植物修复技术广泛受到人们的关注[3-4]。许多学者已经利用植物修复技术,在受污染水体中种植富集重金属能力强的植物,通过植物的富集和吸收来净化水体重金属污染并已取得一定成果。研究发现,几种不同水生植物对重金属Cd的富集能力表现为鸢尾(Iristectorum)>马蔺(Irislactea)>旱伞草(Cyperusalternifolius)>水生美人蕉(Cannaglauca)>旱生美人蕉(Cannageneralis)>菖蒲(Acoruscalamus)[5],超富集植物印度芥菜对Sr+的富集特性与其在植物亚细胞中的分布及在植物体内的存在形态密切相关[6]。迄今,相关研究多集中于同类植物富集能力及机理的比较,鲜有探讨不同种类植物间富集能力及机理特征差异的报道。因此,本试验以生长于同一环境下的7种不同类型水生植物为研究对象,分析水生植物体中镉的含量及分布特征,探讨不同水生植物镉富集能力,筛选出可应用于灌溉水镉污染净化的水生植物;并通过差速离心法和五步提取法研究镉在水生植物亚细胞中的分布及其体内镉的存在形态,分析水生植物对镉的耐性和解毒机制,为选用水生植物治理水体重金属污染提供理论依据。
1 材料和方法
1.1 试验区概况
试验区位于湖南省浏阳市七宝山乡铁山村老矿产工业基地下游约1.5 km,地理坐标为113.9°E、28.3°N,历史上因盛产铅、铁、硼砂、青矾、胆矾、土磺、碱石等“七宝”而得名,由于长期采用粗放型原矿生产,采矿的矿坑废水和冶炼废水直接流入矿区南侧坡脚的宝山河,使河水重金属浓度超标,河水经分段拦坝后又用于农田灌溉进而导致宝山河两侧耕地和稻米重金属污染都十分严重[7-8]。实验前期测定结果显示,试验区土壤和水体中pH背景值分别为4.96和6.49,总镉浓度背景值分别为7.19和13.92 mg/kg,稻米镉浓度超标约2倍。
1.2 试验设计
根据灌溉水渠走向,选取合适农田新建三级生物塘。生物塘均为水泥池壁,两相邻生物塘之间用PVC管道(管径20 cm)相连,第1、2、3生物塘尺寸分别为45 m×15 m×1.5 m、15 m×15 m×1.5 m和30 m×15 m×1.5 m,第1个生物塘中以长苞香蒲 (Typhaangustata)、水生美人蕉、黑藻(Hydrillaverticillata)、粉绿狐尾藻(Myriophyllumaquaticum)、花叶芦竹(Arundodonax)、香根鸢尾(Iristectorum)、水葫芦(Eichhorniacrassipes) 7种植物交叉种植,第2和第3个生物塘分别单独种植花叶芦竹和空心草(Alternantheraphiloxeroides)。其中,挺水植物长苞香蒲、水生美人蕉、花叶芦竹、香根鸢尾、芦竹的种植间距均为1.5 m,空心草和沉水植物粉绿狐尾藻、黑藻,以及浮水植物水葫芦为自然撒种。为保持试验植物生长环境的镉含量一致,本试验只选择第一个生物塘中的植物为研究对象。非灌溉期为水渠的枯水期,生物塘只在灌溉期运行。
1.3 样品的采集及预处理
以第1个生物塘中种植的7种水生植物为研究对象,于早稻灌溉期尾期,采用五点采样法分别采集足量不同种类的水生植物,包括长苞香蒲、黑藻、粉绿狐尾藻、花叶芦竹、水生美人蕉、香根鸢尾、水葫芦。采集的水生植物用河水冲洗干净后放入尼龙网袋中运回实验室进行预处理。先用自来水冲洗干净,再用超纯水冲洗3遍,并将植株分成根、茎、叶三部分(香根鸢尾只分成根和茎两部分,黑藻保留全株实验)。其中,花叶芦竹、水葫芦和黑藻3种植物保留一部分鲜样用密封袋装好放入冰箱中冷藏并尽快进行镉在水生植物中的亚细胞分布及化学形态实验,另一部分样品与其余植物样品留作干样,均用牛皮纸信封袋装好后放入烘箱中,105 ℃杀青 1 h后在60 ℃下烘至恒重,然后将样品粉碎、过筛(100目)并保存,用于镉在植物各器官中的分布特征试验。
1.4 亚细胞结构分级分离
称取植物鲜样1.000 g(根、茎、叶),加入20 mL预冷的提取缓冲液研磨匀浆后用10 mL提取液冲洗,提取缓冲液组成为0.25 mol·L-1蔗糖溶液、0.154 g·L-1二硫苏糖醇、50 mmol·L-1Tris-HCl缓冲液(pH=7.5)。将2次匀浆的混合液转入离心管中离心,首先以300 r·min-1的速度离心30 s,所得的沉淀即为细胞壁(F1);上清液在2000 r·min-1下离心15 min,所得的沉淀为原生质体[包括细胞核和叶绿体组分(F2)];上清液在10 000 r·min-1下离心20 min,沉淀为线粒体(F3);上清液为含核糖体的可溶组分(F4)。所有步骤均在4 ℃条件下进行,所有上清液与沉淀均转移到消解管进行消解[9]。
1.5 重金属镉化学形态提取
采用化学试剂逐级提取法提取水生植物中不同化学形态镉。称取1.000 g植物各部位(根、茎、叶)鲜样,剪碎后置于50 mL离心管中,加入40 mL提取剂;25 ℃恒温箱振荡22 h后,离心15 min,回收提取液,再在装有植物样品沉淀的离心管内加入10 mL同种提取液,25 ℃振荡1 h、离心15 min后回收第2次提取液。合并2次回收的提取液于150 mL的三角瓶中待消解。按照下列提取剂添加顺序进行依次提取:80%乙醇主要提取硝酸盐、氯化物为主的无机盐及氨基酸盐等;去离子水,主要提取水溶性有机盐等;1 mol·L-1氯化钠,主要提取果胶酸盐、蛋白质结合态或吸附态的重金属等;2%醋酸,主要提取难溶于水的重金属磷酸盐;0.6 mol·L-1盐酸,主要提取草酸盐等;最后为残渣态重金属[6]。
1.6 植物镉含量测定
1.6.1植物干样镉含量称取0.500 0 g样品于消解管中,加入5 mL硝酸,管口加盖弯颈漏斗放置12 h后置于消解仪上进行消解,待充分消解后,用超纯水定容至25 mL并过滤,然后用原子吸收分光光度计ICP-OES(美国PE8300)测定样品中Cd的含量。
1.6.2植物鲜样镉含量将提取液、植物残渣和各亚细胞组分放于消解管,加入5 mL HNO3- HClO4(4∶1,V∶V)溶液,加盖漏斗放置过夜后在电热板上进行消解,充分消解、定容、过滤。用原子吸收分光光度计ICP-OES(美国PE8300)测定样品中Cd的含量[10]。
1.7 数据分析
采用迁移系数来分析镉在植物器官间的迁移特征,迁移系数(transfer factor,TF)的计算公式为:
TF根-茎=C茎/C根,TF茎-叶=C叶/C茎,
其中C根、C茎和C叶分别表示植物根、茎和叶中的镉含量(mg·kg-1)。
试验数据采用Excel 2013作图,用 SPSS 19.0进行统计分析,结果用平均值±标准误差表示。
2 结果与分析
2.1 镉在水生植物器官间的分布及其转运特征
从图1可知,各类型水生植物根中镉含量表现为:粉绿狐尾藻>水葫芦>水生美人蕉>黑藻>香根鸢尾>长苞香蒲≈花叶芦竹,其中镉含量最高的粉绿狐尾藻[(35.61±0.23) mg·kg-1]约为镉含量最低的长苞香蒲和花叶芦竹(3.00 mg·kg-1)的11.87倍;各类型水生植物茎和叶中镉含量均表现为:水生美人蕉>水葫芦>粉绿狐尾藻>花叶芦竹≈香根鸢尾(不分叶)>长苞香蒲,水生美人蕉茎和叶中镉含量分别达到(10.7±0.12)和(8.1±0.05) mg·kg-1,远大于其他水生植物;各类型水生植物各器官中镉含量相差很大,说明各水生植物各器官富集能力相差显著。
同时,由水生植物各器官对镉转运能力分析结果(图2)来看,镉从根到茎(根-茎)的迁移系数为0.06~0.57,从茎到叶(茎-叶)的迁移系数均高于0.74。其中,镉从水生美人蕉根到茎的迁移系数小于茎到叶的迁移系数,而镉在长苞香蒲、花叶芦竹、水葫芦和粉绿狐尾藻4种植物器官间的迁移系数均与之相反,说明水生美人蕉体内镉的迁移较活跃,能有效将镉从根部转移到茎和叶中,而镉在长苞香蒲、花叶芦竹、水葫芦和粉绿狐尾藻体内的迁移活性较小,被主要滞留在根部。
另外,不同类型水生植物体内镉的含量表现为:沉水植物>浮水水植物>挺水植物,说明浮水植物对镉的富集能力最强,沉水植物次之,挺水植物最弱;2种浮水植物体中镉从茎到叶的转移系数远大于从根到茎的转移系数,而3种挺水植物不同器官间镉转移系数关系并无一致规律,说明镉在挺水植物体内迁移活性差异明显。
2.2 镉在水生植物亚细胞内的分布特征
在整个实验过程中,水生植物均生长正常,未表现出毒害症状。面对不同浓度镉的胁迫,植物的耐性机制不同。试验中分别选择镉富集量较大的浮水植物水葫芦,以及镉富集量处于中等水平的挺水植物花叶芦竹和沉水植物黑藻作为植物耐镉机制试验(亚细胞分布和化学形态分布)的研究材料。
对于沉水植物黑藻,镉在细胞壁中含量最大(表1),为(3.49±0.46)mg·kg-1,约占亚细胞镉总量的37.13% (图3);原生质体与可溶组分中镉含量次之,分别为(2.24±0.34)和(2.07±0.47)mg·kg-1,占比分别为23.83%和22.02%;线粒体中镉含量最少,仅占亚细胞镉总量的17.02%。镉在浮水植物水葫芦根、茎、叶的细胞壁中含量最大,约占41.87%~50.86%,其次是可溶组分约占28.26%~31.21%,原生质体与线粒体中镉含量最少且两者差异不显著,仅占8.15%~17.60%。镉在挺水植物花叶芦竹根和叶的细胞壁中含量最大,分别约占亚细胞镉总量的40.74%和42.24%,原生质体、线粒体和可溶组分中镉含量相近,分别约占13.80%~26.26%和17.24%~20.69%;花叶芦竹茎的可溶组分和细胞壁中镉含量较大,分别为(0.78±0.44)和(0.7±0.2)mg·kg-1且差异不显著,其原生质体和线粒体中镉含量较小也无显著差异,分别为(0.43±0.31)和(0.28±0.11)mg·kg-1。可见,3种不同类型水生植物亚细胞中镉含量分布存在相同规律,即镉主要分布在植物细胞壁和可溶组分中,而原生质体和线粒体中的含量较少,说明镉在植物细胞中的迁移活性较小。
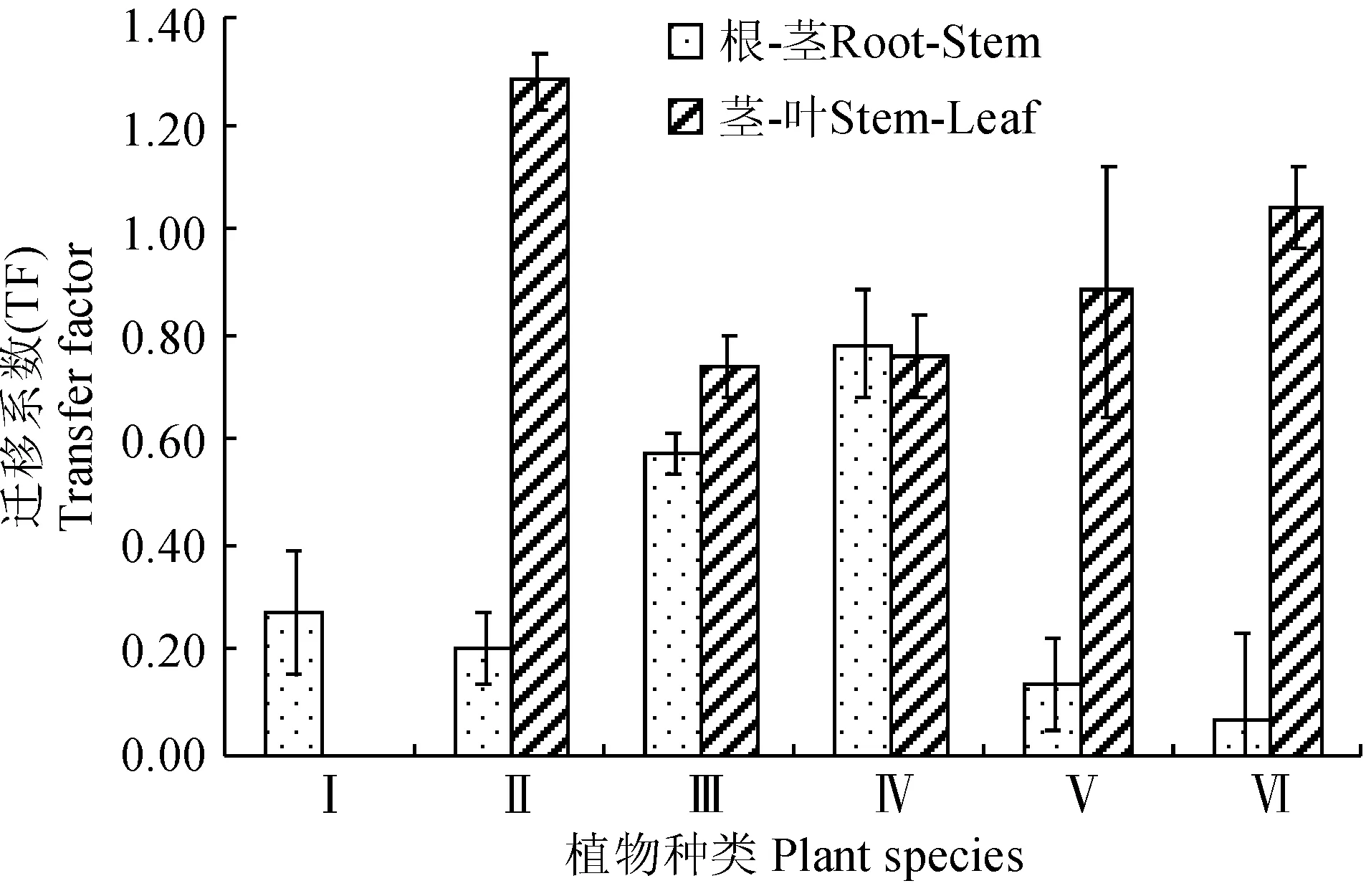
图2 镉在水生植物各器官间的迁移系数Fig.2 Transfer factor of cadmium among different aquatic plant organs
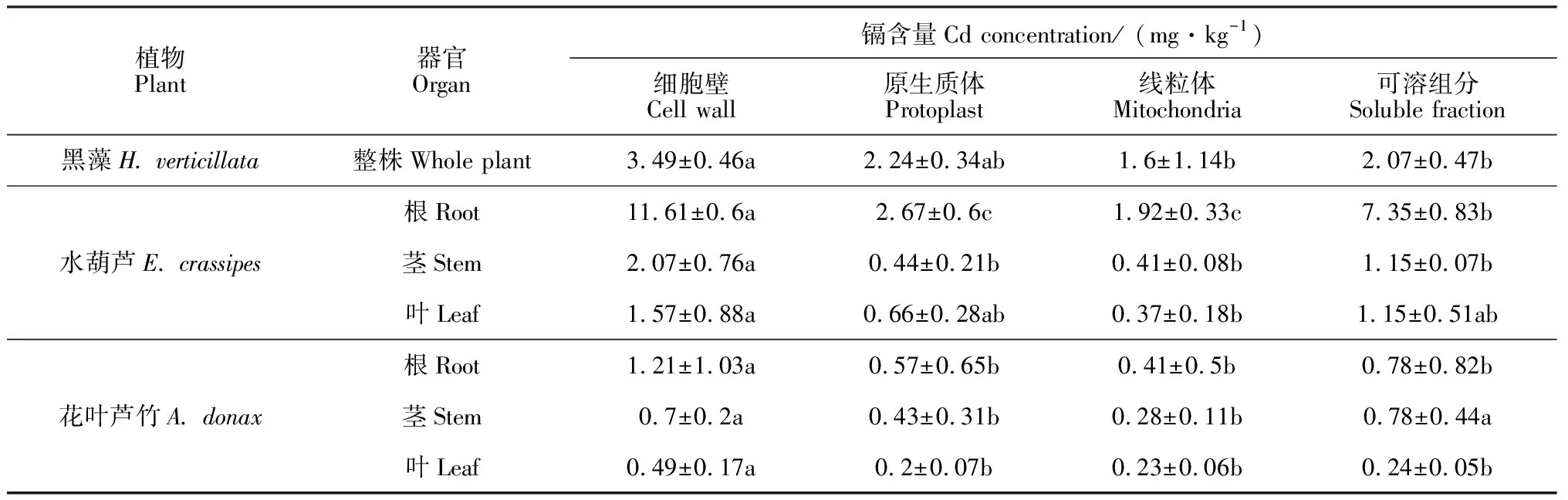
植物Plant器官Organ镉含量Cd concentration/ (mg·kg-1)细胞壁 Cell wall原生质体Protoplast线粒体Mitochondria可溶组分Soluble fraction黑藻H. verticillata整株Whole plant3.49±0.46a2.24±0.34ab1.6±1.14b2.07±0.47b水葫芦E. crassipes根Root11.61±0.6a2.67±0.6c1.92±0.33c7.35±0.83b茎Stem2.07±0.76a0.44±0.21b0.41±0.08b1.15±0.07b叶Leaf1.57±0.88a0.66±0.28ab0.37±0.18b1.15±0.51ab花叶芦竹A. donax根Root1.21±1.03a0.57±0.65b0.41±0.5b0.78±0.82b茎Stem0.7±0.2a0.43±0.31b0.28±0.11b0.78±0.44a叶Leaf0.49±0.17a0.2±0.07b0.23±0.06b0.24±0.05b
注:同行不同字母表示不同亚细胞组分间在0.05水平存在显著性差异
Note: The different normal letters with the same row indicate significant difference among subcellular fractions at 0.05 level
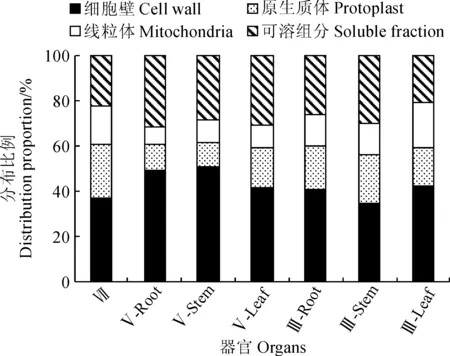
图3 镉在水生植物器官亚细胞组分中的分布比例Fig.3 Distribution proportion of cadmium in subcellular fractions of aquatic plants
另外,浮水植物水葫芦和挺水植物花叶芦竹不同器官同一亚细胞组分的镉含量与各器官中总镉含量关系一致,即根> 茎> 叶;浮水植物与挺水植物同一器官同一亚细胞组分的镉含量与各器官中总镉含量关系一致,即浮水植物>挺水植物。
2.3 镉在水生植物体内的化学形态分布特征
试验仍以沉水植物黑藻、浮水植物水葫芦和挺水植物花叶芦竹为材料,对各类型水生植物中不同提取态镉形态含量分布特征进行分析,结果如表2和图4所示。黑藻中镉主要以氯化钠提取态存在,含量为(3.76±0.02)mg·kg-1,占提取镉总量的44.66%,其次是醋酸提取态和盐酸提取态,含量分别为(2.14±0.42)和(1.23±0.02)mg·kg-1,分别占提取镉总量的25.42%和14.61%,乙醇提取态、水提取态和残渣态镉含量均较低,约占提取镉总量的4.04% ~ 5.82%。水葫芦根中氯化钠提取态和醋酸提取态镉含量最大,分别为(12.94±0.3)和(11.53±2.84)mg·kg-1,分别占提取镉总量的40.62%和36.19%,其次为盐酸提取态镉,含量为(3.62±0.74)mg·kg-1,占提取镉总量的11.36%,最小的为残渣态,仅占提取镉总量的2.23%;水葫芦茎和叶中氯化钠提取态镉含量远大于其他形态,分别占提取镉总量的56.27%和51.01%,其次为醋酸提取态镉,分别占提取镉总量的18.63%和18.12%,且茎和叶中不同形态镉含量差异显著。花叶芦竹根中镉主要以氯化钠提取态、醋酸提取态和盐酸提取态存在,3种形态分别占提取镉总量的29.37%、25.66%和25.66%,三者之间无显著性差异,含量最小的为水提取态镉,仅占提取镉总量的3.70%;茎和叶中镉主要以氯化钠提取态存在,分别为(0.8±0.16)和(0.53±0.06)mg·kg-1,分别占提取镉总量的57.23%和41.55%,其次为醋酸提取态镉,含量最小的分别为水提取态和残渣态镉,仅占提取镉总量5.42%和7.75%。可见,不同类型水生植物体内镉的主要存在形态相同,均主要以氯化钠提取态镉存在,说明镉在3种不同类型水生植物体内主要以果胶酸盐、蛋白质结合态或吸附态的形式存在。
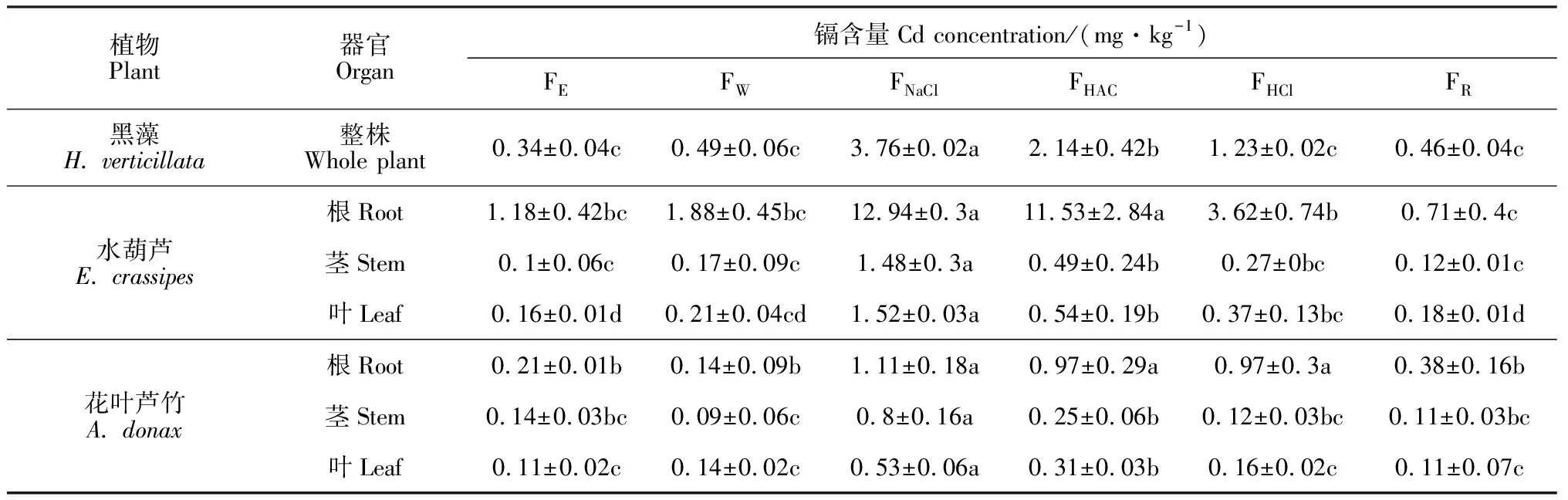
表2 镉在水生植物体内的形态分布
注:FE、FW、FNaCl、FHAC、FHCl、FR分别表示乙醇提取态、水提取态、氯化钠提取态、醋酸提取态、盐酸提取态和残渣态镉含量;图4同
Note: FE, FW. FNaCl, FHAC, FHCland FRstand for cadmium content of ethanol, H2O, NaCl, HAC, HCl extractable fractions and residual forms; The same as Fig.4
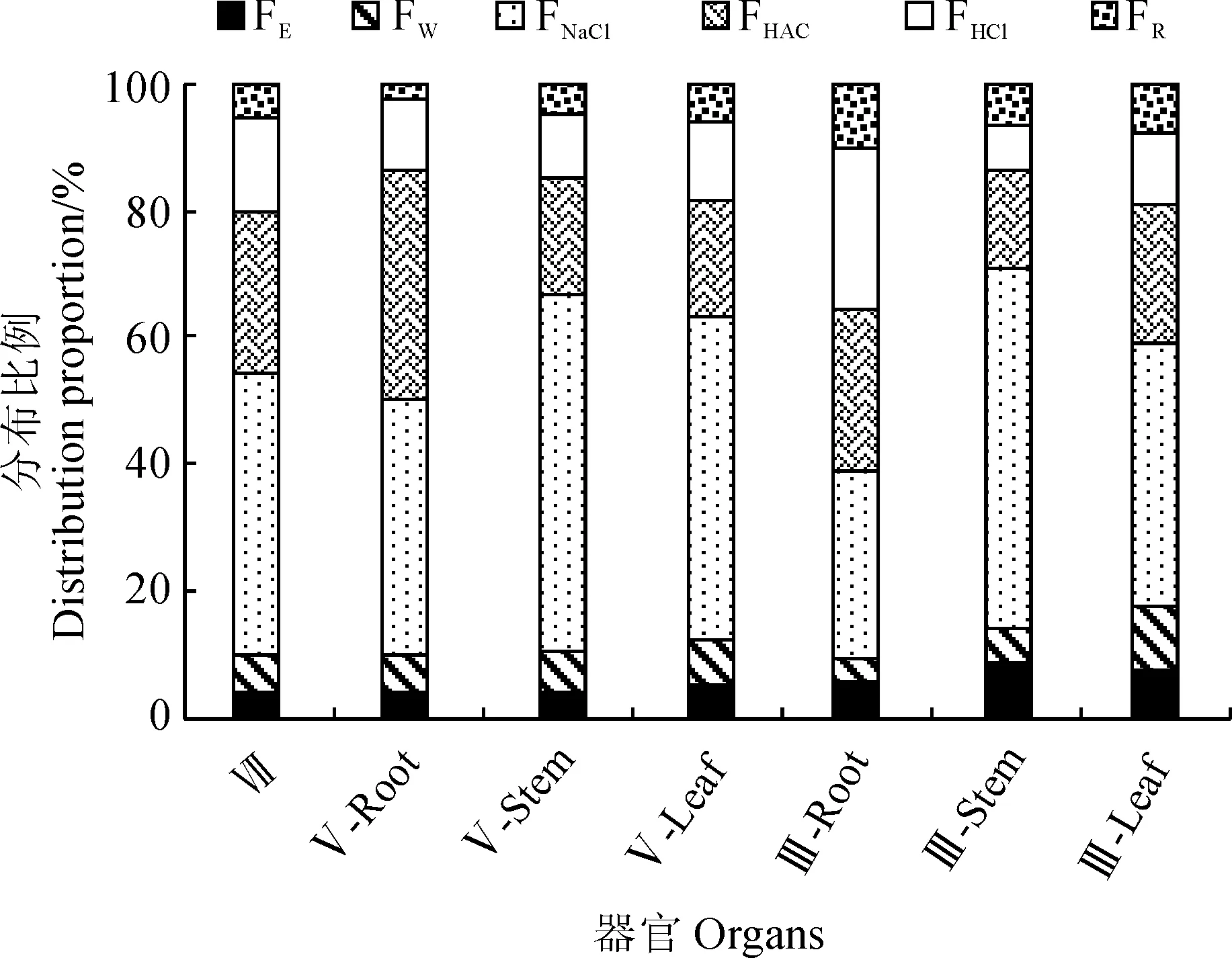
图4 不同化学形态镉在水生植物器官中的分布比例Fig.4 Distribution proportion of different forms of cadmium in aquatic plants
3 讨 论
本研究证实了7种水生植物均具有一定的镉富集能力,且在植物各器官中镉含量差异显著。对于试验水生植物,镉主要分布在根部,少量分布在茎和叶中,说明镉进入植物体后,大部分被截留在植物根部[11],少部分被转运到地上部分,根是主要的镉富集器官[11]。在用植物修复法净化镉污染灌溉水的应用中,植物收割法通常也能作为移除水体中镉的一种有效途径,根据镉在各植物器官间的转移系数可知,仅有美人蕉地上部镉含量大于地下部,通过收割法移除环境中的镉能取得最好的效果。镉在美人蕉各器官中含量分布差异关系与他人结果不同,这可能是因为美人蕉应对不同浓度镉胁迫时做出相应生理调节,促进了镉从地下部向地上部的转移,使得植物地上部的镉含量大于地下部的镉含量[12-13]。另外,镉在挺水植物花叶芦竹各器官间转移活性仅次于水生美人蕉,通过收割法亦能取得较好的净化效果;而镉在长苞香蒲和香根鸢尾体内迁移能力弱且富集量小,用于净水镉污染灌溉水的效果相对较差。
根据以往相关研究可知[14-17],沉水植物用于净化水质通常都能取得较理想的效果,而本研究中同为沉水植物的黑藻的镉富集量却远小于狐尾藻,可能的原因是植物对镉的富集能力不仅与植物种类有关,还与植物株龄、生长周期等有关[18]。本研究中所有的水生植物虽于同一时间种植于同一环境中,但可能因为生长环境条件限制,导致黑藻在栽种初期大量死亡,采样前期黑藻才逐渐扎根于底泥开始生长,由于生长期较短,加上水体氮磷水平不高以及酸性水体环境不利于黑藻的存活及繁殖,造成黑藻对镉的富集能力不如他人研究结果理想。
水生植物之所以能耐受较高浓度的镉,可以通过镉在植物亚细胞中的分布及镉在植物体内的赋存形态规律阐释。本试验镉在3种类型水生植物亚细胞组分中分布关系均表现为细胞壁>可溶组分>细胞器[19-20](包括原生质体和线粒体),这与他人研究结果一致。主要原因在于细胞壁中含有的蛋白质和果胶、纤维素、木质素等多糖和大量亲金属离子的配位基团能与镉离子沉淀络合以不活跃的状态存在,从而降低镉向细胞器的迁移[21-22],发挥其作为植物与外界物质交换的第一道屏障的保护作用;当细胞壁中的结合位点达到饱和时,镉即被转运到液泡,液泡中的有机酸、有机碱和蛋白质等与镉结合,使镉阻滞在植物液泡中,形成液泡区隔化,从而降低镉在细胞器中的分布[23],减弱镉对植物生理机能的影响。由此可见,细胞壁固持作用和液泡区隔化都是植物的耐镉机制。
镉在植物体内的赋存化学形态直接影响镉的迁移能力及活性,其中80%乙醇提取态和水溶态镉活性最强,氯化钠提取态和2%醋酸提取态镉活性居中,盐酸提取态和残渣态镉活性最弱。本研究中的3种水生植物体内镉的主要赋存化学形态为氯化钠提取态、2%醋酸提取态和盐酸提取态,而80%乙醇提取态、水提取态和残渣态含量较少,这与以往大量研究结果一致[24]。其原因是镉在植物体内主要与果胶酸盐、蛋白质或金属配位体结合形成复合物,沉积在细胞壁上,待饱和后转移到液泡,又在液泡中形成新的复合物贮存在液泡中,这也进一步解释了镉主要富集在根中的原因是根细胞壁和液泡中积累了大量镉,从而减弱了镉向根细胞器和植物地上部分的转移,减弱了镉对植物体的毒害[25],说明镉在植物体内的赋存化学形态亦是植物的一种耐镉机制。
综上所述,7种水生植物中,狐尾藻、水葫芦、美人蕉和芦竹是较好的镉污染水体的净化植物,而黑藻、鸢尾和香蒲对镉污染水体的净化效果相对较差。黑藻、水葫芦、芦竹的各器官亚细胞组分镉含量分布表现为细胞壁>可溶组分>原生质体>线粒体,体现了植物细胞壁固持化和液泡区室化的解毒机制。同时,黑藻、水葫芦、芦竹体内不同化学形态镉分布呈现为:氯化钠提取态>2%醋酸提取态>盐酸提取态>水提取态≥残渣态≥80%乙醇,镉主要以果胶酸盐、蛋白质结合态或吸附态存在于植物根的细胞壁中,镉在体内的赋存化学形态亦是植物的一种耐镉机制。
参考文献:
[1] 陈 涛, 常庆瑞, 刘 京, 等. 长期污灌农田土壤重金属污染及潜在环境风险评价[J]. 农业环境科学学报, 2012,31(11): 2 152-2 159.
CHEN T,CHANG Q R, LIU J,etal. Pollution and potential environment risk assessment of soil heavy metals in sewage irrigation area[J].JournalofAgro-EnvironmentScience, 2012,31(11): 2 152-2 159.
[2] 倪小英, 覃世民, 梅 广, 等. 稻米重金属污染及其治理研究进展[J]. 粮食与饲料工业, 2014, (8): 15-18.
NI X Y, QIN S M, MEI G,etal. Research progress of heavy metal pollution of rice and its control[J].Cereal&FeedIndustry, 2014, (8): 15-18.
[3] 谢晓君, 王方园, 王光军, 等.中国地表水重金属污染的进展研究[J].环境科学与管理, 2017,42(2): 35-38.
XIE X J,WANG F Y,WANG G J,etal.Study on heavy metal pollution in surface water in China[J].EnvironmentScienceandManagement, 2017,42(2): 35-38.
[4] 马坤荣.重金属污染水体植物修复研究进展[J].资源节约与环保, 2014,45(10): 1 982-1 985.
MA K R. Research progress on the phytoremediation of water bodies contaminated by heavy metals[J].AppliedChemicalIndustry, 2014,45(10): 1 982-1 985.
[5] 王 敏, 唐景春, 王 斐. 常见水生植物对富营养化和重金属复合污染水体的修复效果研究[J]. 水资源与水工程学报, 2013, (2): 50-56.
WANG M, TANG J C, WANG F,etal. Remediation effect of common aquatic plants on the combined water pollution of eutrophication and heavy metals[J].JournalofWaterResources&WaterEngineering, 2013, (2): 50-56.
[6] 赖金龙, 杨 垒, 付 倩, 等. Sr2+在印度芥菜幼苗中的富集、亚细胞分布及贮存形态研究[J]. 农业环境科学学报, 2015,34(11): 20-27.
LAI J L, YANG L, FU Q,etal. Bioaccumulation, subcellular distribution and chemical forms of strontium inBrassicajunceaL.[J].JournalofAgro-EnvironmentScience, 2015,34(11): 20-27.
[7] 刘许生.七宝山治污之惑[J]. 国土资源导刊, 2012,72(8):32-33.
LIU X S. Pollution confused of Qibaoshan[J].TribuneofLandandResources, 2012,72(8):32-33.
[8] 戴塔根, 刘星辉, 童潜明, 等. 湖南浏阳七宝山矿区宝山河不同时期环境污染对比研究[J]. 矿冶工程, 2005,25(6):9-13.
DAI T G, LIU X H, TONG Q M,etal. Comparison of environmental pollution at different period of time in Qibaoshan mine area,Liuyang,Hunan[J].MiningandMetallurgicalEngineering, 2005,25(6):9-13.
[9] 罗洁文, 黄玫英, 殷丹阳, 等. 类芦对铅镉的吸收动力特性及亚细胞分布规律研究[J]. 农业环境科学学报, 2016,35(8): 1 451-1 457.
LUO J W, HUANG M Y, YIN D Y,etal. Uptake kinetic characteristics and subcellular distribution of Pb2+and Cd2+inNeyraudiareynaudiana[J].JournalofAgro-EnvironmentScience, 2016,35(8): 1 451-1 457.
[10] 鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社, 2001: 335-336.
[11] 吴道铭, 陈晓阳, 曾曙才. 芒属植物重金属耐性及其在矿山废弃地植被恢复中的应用潜力[J]. 应用生态学报, 2017, (4): 1 397-1 406.
WU D M, CHEN X Y, ZENG S C,etal. Heavy metal tolerance of Miscanthus plants and their phytoremediation potentialinaban-donedmineland[J].ChineseJournalofAppliedEcology, 2017, (4): 1 397-1 406.
[12] 胡娜妮. 湘江流域重金属Mn超富集植物的筛选与分析[J]. 中国园艺文摘, 2016,(11): 9-10+196.
HU N N. Mn Selection and analysis of hyperaccumulators inXiangjiang river basin[J].ChineseHorticultureAbstracts, 2016, (11): 9-10+196.
[13] 张文娥. 2种美人蕉属植物对镉的积累及其耐受生理机制的研究[D]. 陕西杨陵:西北农林科技大学, 2013.
[14] MISHRA V K, UPADHYAY A R, PANDEY S K,etal. Concentrations of heavy metals and aquatic macrophytes of Govind Ballabh Pant Sagar an anthropogenic lake affected by coal mining effluent[J].EnvironmentalMonitoringandAssessment, 2008, 141: 49-58.
[15] 黄永杰, 刘登义, 王友保, 等. 八种水生植物对重金属富集能力的比较研究[J]. 生态学杂志, 2006, (5): 541-545.
HUANG Y J, LIU D Y, WANG Y B,etal. Heavy metals accumulation by hydrophytes[J].ChineseJournalofEcology, 2006, (5): 541-545.
[16] 胡 啸, 蔡 辉, 陈 刚, 等. 3种类型水生植物及其组合对污染水体中铬、氮和磷的净化效果研究[J]. 水处理技术, 2012,38(4): 51-54, 60.
HU X, CAI H, CHEN G,etal. Purification efficiencies of three types of aquatic plants and combination of them to chromium, nitrogen and phisohirus in wastewater[J].TechnologyofWaterTreatment, 2012,38(4): 51-54, 60.
[17] 林 海, 陈 思, 董颖博, 等. 黑藻、狐尾藻对重金属铅、镉、铬、钒污染水体的修复[J]. 中国有色金属学报, 2017,27(1): 178-186.
LIN H, CHEN S, DONG Y B,etal. Phytoremediation on heavy metal-polluted water of Pb, Cd, Cr and V byHydrillaverticillataandMyriophyllumverticillatum[J].TheChineseJournalofNonferrousMetals, 2017,27(1): 178-186.
[18] 黄淑萍, 陈爱侠, 常亚飞,等. 皂河湿地植物对多种重金属污染湿地的修复研究[J]. 环境工程, 2016,34(6): 177-181, 154.
HUANG S P, CHEN A X, CHANG Y F,etal. Phytoremediation on wetland in Zaohe River watershed contaminated with multi heavy matels[J].EnvironmentalEngineering, 2016,34(6): 177-181, 154.
[19] 邹 圆, 王晓龙, 陈瑶瑶, 等. 芹菜根对镉的累积及亚细胞和化学形态分布研究[J]. 北方园艺, 2017, (2): 31-37.
ZOU Y, WANG X L, CHEN Y Y,etal. Accunulation, subcellular distribution and chemical forms of Cadmium incelery(ApiumgraveolensL.) roots[J].NorthernHorticulture, 2017, (2): 31-37.
[20] WENG B, XIE X Y, WEISS D J,etal.Kandeliaobovate(S., L.) yong tolerance machanisms to Cadmium: suncellular distribution, chemical forms and thiol pools[J].MarinePollutionBulletin, 2012, 64: 2 453-2 460.
[21] ZHU X F, WANG Z W, DONG F,etal. Exogenous auxin alleviates Cadmium toxicity inArabidopsisthalianaby stimulating synthesis of hemicellulose and increasing the Cadmium fixation capacity of root cell walls[J].JournalofHazardousMaterials, 2013, 263: 398-403.
[22] HU C J, XIONG L,etal. Tissue accumulation andsubcellular distribution of vanadium inBrassicajunceaandBrassicachinensis[J].MicrochemicalJournal, 2013, 10: 575-578.
[23] 陈亚慧, 刘晓宇, 王明新, 等. 蓖麻对镉的耐性、积累及与镉亚细胞分布的关系[J]. 环境科学学报, 2014,34(9): 2 440-2 446.
CHEN Y H,LIU X Y,WANG M X,etal. Cadmium tolerance, accumulation and relationship with Cd subcellulardistribution inRicinuscommunisL.[J].ActaScientiaeCircumstantiae, 2014,34(9): 2 440-2 446.
[24] 付 倩, 金 龙, 尹 燚, 等.铯对印度芥菜幼苗生长的影响及其亚细胞分布和化学形态[J]. 西北植物学报, 2015,35(11): 2 235-2 242.
FU Q, JIN L, YIN Y,etal. Effect of cesium on seedling growth, its subcellular distribution and chemical forms inBrassicajuncesL.[J].ActaBot.Boreal-Occidenti.Sinica, 2015,35(11): 2 235-2 242.
[25] 钟海涛, 潘伟斌, 张太平. 小飞扬草(Euphorbiathymifolial)中镉的亚细胞分布及化学形态[J]. 环境保护科学, 2013,39(3): 50-54.
ZHONG H T, PAN W B, ZHANG T P,etal. Subcelular distribution and chemical forms of cadmium inEuphorbiathymifoliaL.[J].EnvironmentalProtectionScience, 2013,39(3): 50-54.

