外源GA和ABA对花生籽仁皱缩变异品系荚果生长的影响
侯风坤,张秀荣,刘风珍*,万勇善,张 昆,马登超,骆 兵
(1 山东农业大学 农学院,作物生物学国家重点实验室,山东省作物生物学重点实验室, 山东泰安 271018;2 济宁市农业科学研究院,山东济宁272031)
激素对植物的生长发育起着重要的调控作用[1]。作物种子的灌浆结实特性很大程度上受到植物激素调节[2-3]。小麦籽粒灌浆速率与其赤霉素(GA)含量呈极显著正相关[4],GA能延长小麦籽粒灌浆持续期,主要在籽粒灌浆前期和后期发挥作用[5]。小麦花后第1天开始喷施外源GA,显著提高了灌浆中后期籽粒生长素(IAA)和细胞分裂素(CTK)的含量,能够延长籽粒的灌浆持续期。水稻花后第2天开始喷施GA,灌浆初期籽粒中腺苷二磷酸葡萄糖(ADPG)焦磷酸化酶、淀粉合成酶活性及淀粉含量下降,可溶性糖含量增加,但是籽粒的生长活跃期延长[6]。脱落酸(ABA)可以抑制水稻籽粒中某些水解酶的活性,促进ADPG焦磷酸酶和淀粉合成酶等的活性,有利于淀粉和蛋白质的合成与累积以及物质转运[6]。ABA能提高大豆的库强度,促进光合产物韧皮部卸载及在库组织中的转化,从而促进光合产物的运输和积累,对大豆籽粒的发育充实起正调控作用[7]。两系杂交稻灌浆前期强势粒中ABA含量明显高于弱势粒,ABA含量与籽粒最大灌浆速率、平均灌浆速率、谷粒充实度和粒重均呈极显著的正相关[8]。可见,GA和ABA含量对调控作物种子的充实度有重要的作用。
花生是重要的油料和经济作物,荚果大小和籽仁饱满程度是决定花生产量和品质的重要因素。王传堂等[9]将花生荚果生长发育分为两个阶段:(1)荚果膨大阶段,荚果体积逐渐增大,果针入土10~20 d荚果体积增长最快,并在20~30 d内长到最大(定型果);(2)荚果充实阶段,荚果干重迅速增长,果针入土50~60 d或60~70 d干重增长接近停止。冯启理等[10]研究发现,花生幼果GA含量在果针入土前1~2 d较高,入土后2~5 d迅速下降,于荚果膨大阶段又恢复到较高的水平。王铭伦等[3]报道,在果针入土23~56 d,花生籽仁中CTK含量逐渐降低,而ABA含量逐渐提高。骆兵等[11]发现,正常花生品种籽仁内源IAA含量在果针入土24 d之前逐渐升高,达到最大含量后一直呈下降趋势;与‘山花15号’、‘白沙1016’和‘05D610’3个荚果正常品种相比,籽仁皱缩变异品系‘05D677’的荚果膨大阶段IAA含量升高,ABA、细胞分裂素(ZT+ZR)和GA含量下降,推测内源激素比例失衡可能导致荚果发育不良,充实度差,最终籽仁皱缩。
本试验选用荚果和籽仁生长发育正常的花生品系‘05D610’及其籽仁皱缩变异系‘05D677’为材料,在荚果膨大阶段初期,采用外源GA和ABA施加处理幼果,分析外源激素处理对荚果生长发育过程中内源激素含量及生长量的影响,旨在探讨外源补充GA和ABA能否使‘05D677’的籽仁饱满度恢复正常,研究花生激素含量与荚果和籽仁生长发育关系,分析‘05D677’籽仁皱缩的原因,为揭示激素含量调控花生荚果大小、籽仁饱满度的机理以及花生高产育种提供参考。
1 材料和方法
1.1 试验材料
试验材料为荚果和籽仁生长发育正常的材料‘05D610’及其籽仁皱缩变异品系‘05D677’[11-12],种子由山东农业大学花生研究所提供。其中,‘05D610’百果重234.06 g,百仁重94.43 g,籽仁饱满;‘05D677 ’百果重118.07 g,百仁重48.41 g,籽仁皱缩。
1.2 试验设计
2013年和2014年,在山东农业大学农学试验站进行田间试验。2013年2种激素各设置3个浓度水平,即GA分别为15、20和25 mg·L-1,ABA分别为10、15和20 mg·L-1,选择GA和ABA对荚果和籽仁影响最显著的浓度。据此试验,2014年采用以品种为主区、外源激素为副区的二因素裂区设计,分别设GA、ABA和清水(CK)3个处理,每个处理24墩,每墩2株,3次重复。果针大量形成期标记果针,用脱脂棉包裹果针基部,每墩至少标记5个果针。果针入土第12天起,每天16:00用注射器向脱脂棉滴加清水(CK)或激素溶液,每个果针滴加2 mL,连续滴6 d。为使激素能更好地附着于果针上,清水和激素溶液中加入0.5% Tween-20。
相同处理设计3个平行试验。其中,2个平行试验的取样日期依次为果针入土后18 d(荚果迅速膨大阶段)、24 d(内源激素含量高峰期[11])、30 d、42 d、54 d和66 d(收获期),用于测定外源施加GA和ABA后幼果或籽仁内源激素含量(由于18和24 d 2个时期籽仁很小,测激素含量用的材料是荚果,30 d以后的样品测量籽仁的激素含量、荚果和籽仁干物质积累速率的变化,测量激素含量的样品用液氮速冻后-80 ℃保存;另外1个平行试验取样日期为收获期,用于测定外源施加GA和ABA后荚果和籽仁生物量的变化。
1.3 测定项目与方法
1.3.1单果重和单仁重从果针入土18 d至66 d(收获),分6次取样检测荚果或籽仁的干物质重量。用后一次取样荚果或籽仁干物质重量减去前一次取样重量除以2次取样间隔天数作为2次取样中间时期的物质积累速率。每次取20个荚果称量鲜重,剥去果壳,称量籽仁鲜重。将荚果和籽仁烘干称量,并计算单果重和单仁重。
1.3.2内源激素含量采用高效液相色谱法(HPLC)测定荚果或籽仁中激素的含量,激素提取和测定方法参照文献[8]。高效液相色谱仪测定激素含量的条件和技术参数为:色谱柱为Symmetry C18(150 mm×4.6 mm,5 μm),流动相为甲醇:水(5‰冰醋酸)=45∶55,流速为0.9 mL·min-1,柱温25 ℃,进样量为15 μL;紫外检测波长为254 nm。GA、ABA、IAA和ZT的标样均购自北京索莱宝生物公司。
1.4 数据统计分析
用Excel 2003和Photoshop进行数据处理及作图,用DPS 7.05统计分析软件对数据进行方差分析和显著性检验。
2 结果与分析
2.1 外源GA和ABA处理对幼果或籽仁激素含量的影响
2.1.1GA含量如图1所示,两材料不同年份不同处理幼果(18和24 d)或者籽仁(30、42、54和66 d)中GA含量随生育期均表现出先升高后降低的相似变化趋势,只是正常材料‘05D610’和变异材料‘05D677’分别在果针入土后24和30 d先后达到峰值,‘05D677’的GA含量峰值明显较低,出现较迟,且在外源激素处理后GA含量升降幅度有差异。
不滴加外源激素(CK)条件下,‘05D677’幼果GA含量在果针入土18和24 d时分别比‘05D610’ 极显著降低 52.25%和75.69%;其籽仁GA含量在果针入土30 d时比‘05D610’极显著提高93.32%,在果针入土42~66 d期间比‘05D610’ 提高11.60%~31.01%。在外源GA处理后,‘05D610’ 籽仁GA含量在果针入土30和42 d时显著升高,‘05D677’在果针入土24和30 d时显著升高,其他时期GA含量变化不显著;两份材料相比较,外源GA处理后‘05D677’的GA含量在荚果膨大阶段增加更显著,而‘05D610’的GA含量在荚果充实阶段增加更显著,‘05D677’的GA含量在整个生育期总体上低于‘05D610’。在外源ABA处理后,‘05D610’GA含量在果针入土18和24 d时显著降低;‘05D677’GA含量在果针入土18、24和30 d时显著降低,而在果针入土66 d时显著升高,其他时期与CK差异不显著;外源ABA处理后,‘05D610’GA含量的下降幅度虽大于‘05D677’,但其GA含量仍然高于‘05D677’(图1)。
2.1.2ABA含量从图2可知,外源GA和ABA处理后,幼果或籽仁ABA含量的变化趋势在年份间表现一致。在果针入土18 d 时,幼果ABA含量很低,材料间及处理前后无显著差异。不施加外源激素(CK)条件下,‘05D677’幼果中ABA含量在果针入土24 d时比‘05D610’极显著降低45.3%,其籽仁中ABA含量在果针入土30~66 d比‘05D610’降低25.40%~34.78%。外源GA处理对2个材料的幼果和籽仁中ABA含量影响较小,其中‘05D610’籽仁ABA含量仅在果针入土30 d时显著高于CK,其他时期差异不显著;‘05D677’的ABA含量从果针入土18 d到收获期一直高于CK,但差异不显著;‘05D677’的ABA含量增加量略大于‘05D610’,但含量仍然低于‘05D610’。外源ABA处理后,‘05D610’幼果和籽仁中ABA含量变化不显著;‘05D677’幼果和籽仁中ABA含量在荚果膨大和充实阶段比CK明显升高,其中2014年在果针入土24 d时为显著升高;‘05D677’的ABA含量始终低于‘05D610’。
2.1.3ZT含量图3显示,不滴加外源激素条件下,‘05D677’幼果的ZT含量在果针入土18和24 d低于‘05D610’,两年平均分别低28.84%和31.44%;其籽仁中ZT含量在果针入土30~54 d均低于‘05D610’。在外源GA处理后,‘05D610’幼果、籽仁中ZT含量变化较小,仅在2013年果针入土30 d时显著提高;‘05D677’的ZT含量在果针入土30和66 d的变化2013年与2014年不一致,其他时期处理与对照间差异不显著。外源ABA处理后,‘05D610’和‘05D677’幼果或籽仁中ZT含量略有增加,但与相应对照差异不显著;外源ABA处理对‘05D610’和‘05D677’内源ZT含量的影响很小。
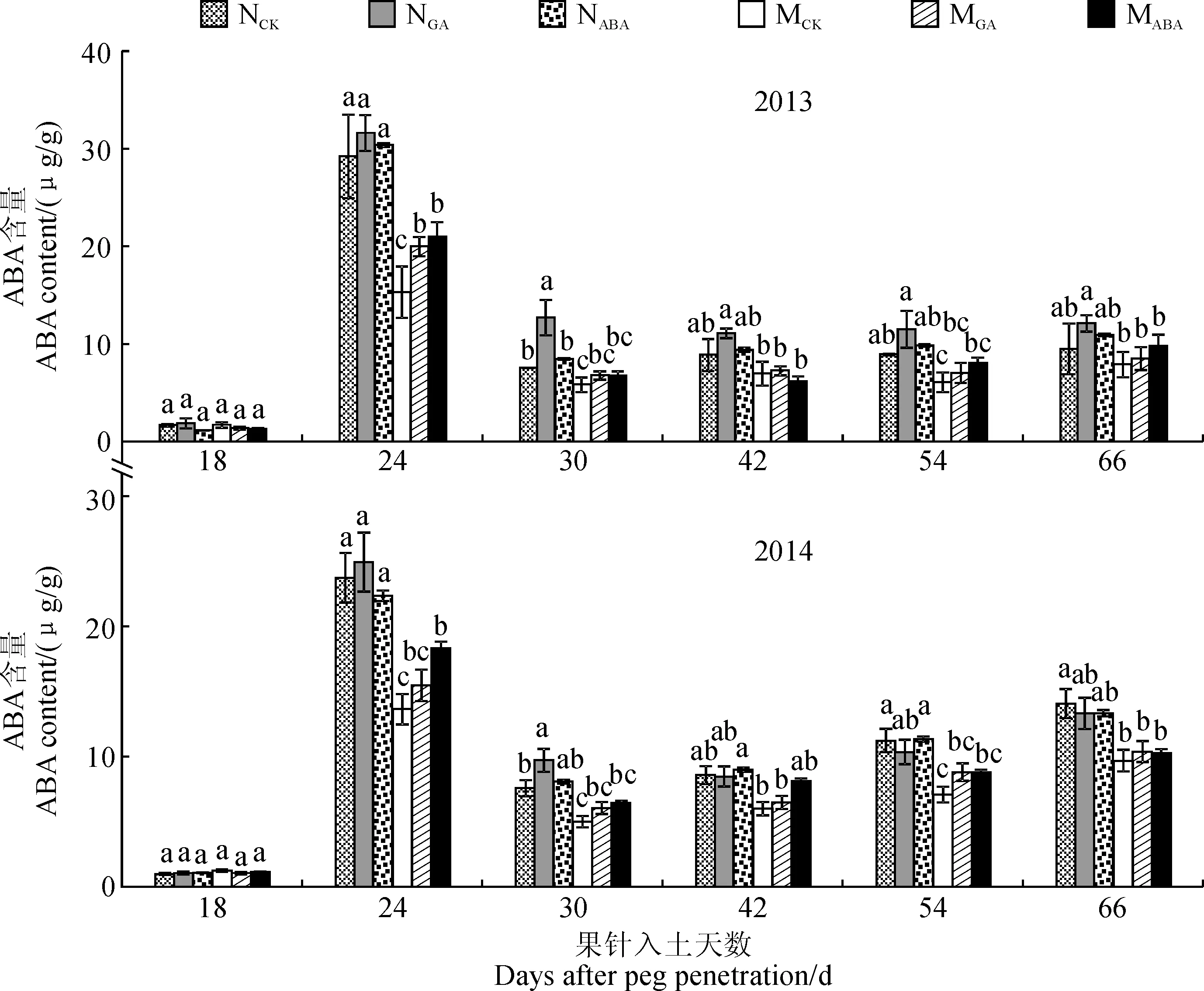
图2 外源GA和ABA处理荚果或籽仁内源激素ABA含量随生育期的变化特征Fig.2 The endogenous ABA content of pod or seed treated by exogenous GA and ABA during growth stage
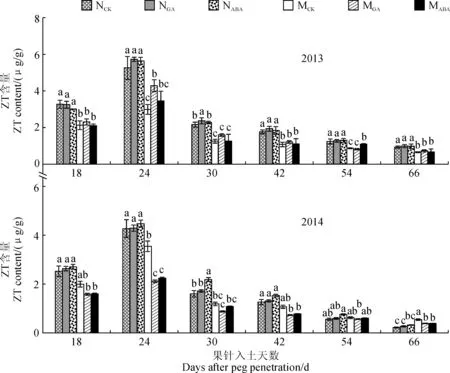
图3 外源GA和ABA处理荚果或籽仁内源激素ZT含量随生育期的变化特征Fig.3 The endogenous ZT content of pod or seed treated by exogenous GA and ABA during growth stage
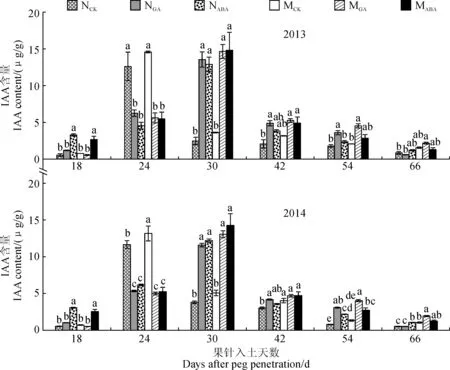
图4 外源GA和ABA处理荚果或籽仁内源激素IAA含量随生育期的变化特征Fig.4 The endogenous IAA content of pod or seed treated by exogenous GA and ABA during growth stage
2.1.4IAA含量如图4所示,不滴加外源激素条件下,‘05D677’幼果及籽仁内源IAA含量在果针入土18~66 d期间均高于‘05D610’。外源GA处理明显推迟了籽仁中IAA含量最大值的出现时期,‘05D610’和‘05D677’具有相同的变化趋势,且两品系间籽仁IAA含量差异较小。外源ABA处理对‘05D610’和‘05D677’的IAA含量影响与外源GA处理的效果相似,即推迟了籽仁中IAA含量最大值的出现时间,‘05D677’的IAA含量略高于同期‘05D610’。外源GA和ABA处理后,两品系幼果或籽仁IAA含量的变化趋势在年份间表现基本一致。
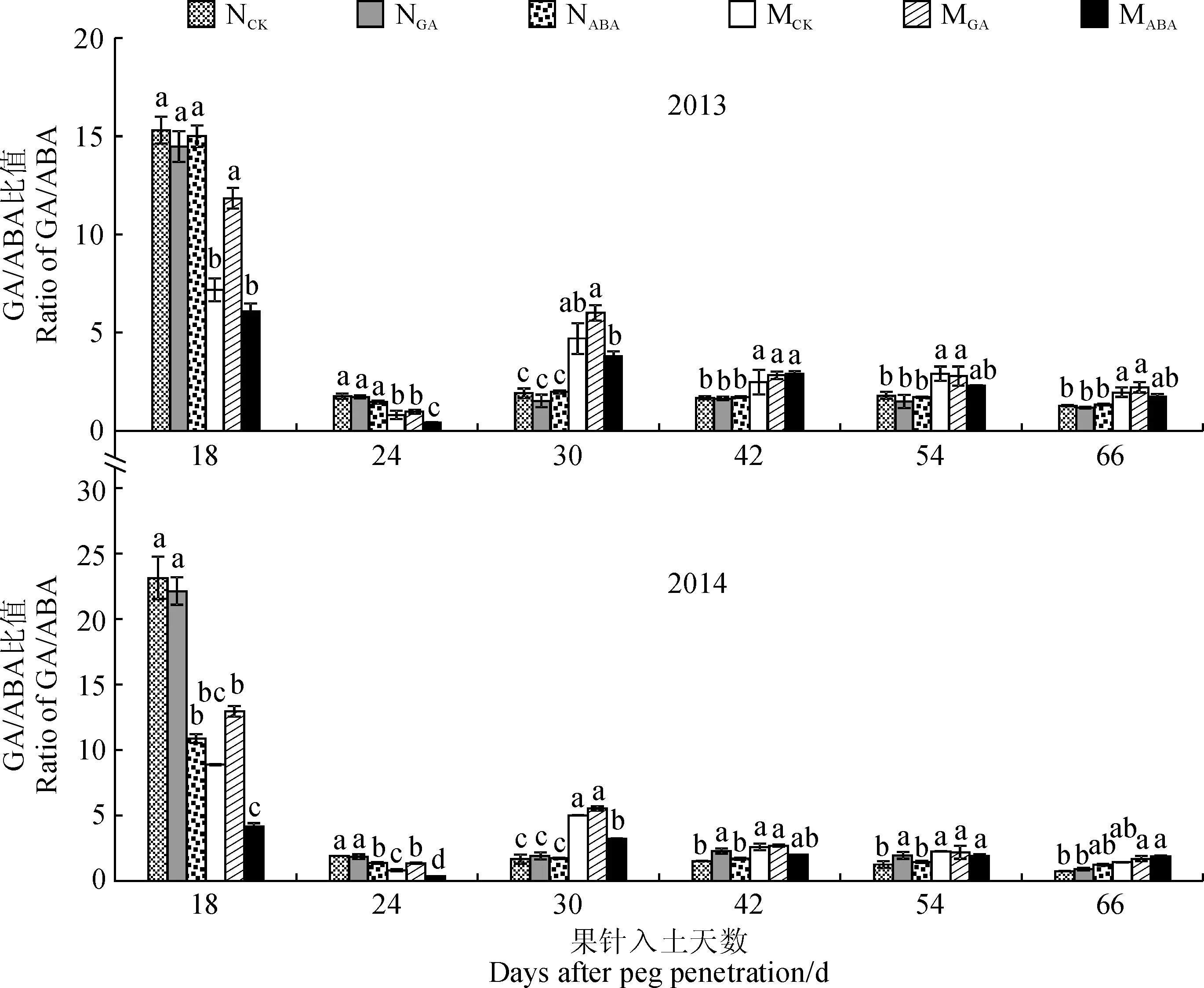
图5 外源GA和ABA处理荚果或籽仁内源激素GA/ABA比值随生育期的变化特征Fig.5 The GA/ABA ratio of pod or seed treated by exogenous GA and ABA during growth stage
2.1.5GA/ABA比值如图5所示,不施加外源激素条件下,变异品系‘05D677’荚果膨大阶段GA/ABA的比值极显著低于‘05D610’,荚果充实阶段显著高于‘05D610’。外源GA处理,‘05D610’ 荚果膨大阶段幼果GA/ABA比值的影响不显著,显著提高了‘05D677’ GA/ABA的比值。与对照相比,外源ABA处理降低了‘05D610’荚果膨大前期(果针入土18 d和24 d)GA/ABA比值,荚果充实后期GA/ABA比值变化较小;外源ABA处理也降低了‘05D677’荚果膨大和充实阶段GA/ABA比值,并在荚果膨大阶段达到极显著水平。外源ABA处理后,在荚果膨大阶段,两品系GA/ABA比值均降低;在荚果充实阶段,‘05D610’ GA/ABA比值升高,而‘05D677’ GA/ABA比值降低。
2.2 外源GA和ABA处理对荚果或籽仁干物质积累速率的影响
2.2.1荚果干物质积累速率由图6可以看出,外源GA处理后,‘05D610’和‘05D677’荚果干物质积累速率在荚果膨大阶段变化不显著,而在荚果充实阶段明显提高,且‘05D677’荚果干物质积累速率受外源GA的影响更大;在外源ABA处理后,‘05D610’和‘05D677’荚果干物质积累速率在荚果膨大阶段和充实阶段前期(果针入土36 d)明显提高,但在荚果充实阶段却受影响较小。外源GA和ABA处理对荚果干物质积累速率的影响的趋势在年份间基本一致(图6)。
2.2.2籽仁干物质积累速率由图7可知,外源GA和ABA处理对籽仁干物质积累速率的影响的趋势年份间基本一致。其中,外源GA处理后,‘05D610’和‘05D677’籽仁干物质积累速率在荚果膨大阶段变化较小,在荚果充实阶段略有提高,但未达到显著水平;经外源ABA处理后,‘05D610’和‘05D677’籽仁干物质积累速率在荚果膨大阶段和荚果充实前期(果针入土36 d)明显提高,而在荚果充实阶段受到的影响较小。另外,2年中‘05D677’各处理籽仁干物质积累速率在果针入土21~48 d均远低于‘05D610’,直到收获期才比‘05D610’略高或相近。
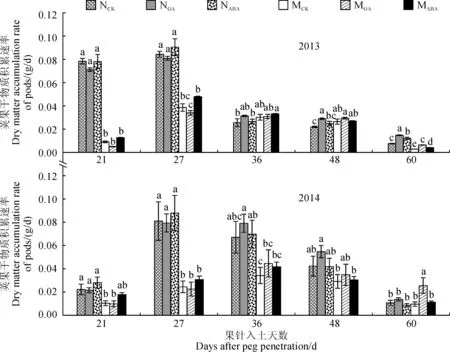
图6 外源GA和ABA处理对荚果干物质积累速率的影响Fig.6 The effects of exogenous GA and ABA treatments on dry matter accumulation rate of pods
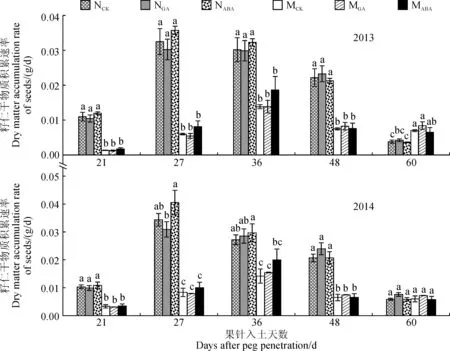
图7 外源GA和ABA处理对籽仁干物质积累速率的影响Fig.7 The effects of exogenous GA and ABA treatments on dry matter accumulation rate of seeds
2.3 外源GA和ABA处理对收获期荚果重和籽仁重的影响
2.3.1荚果重由表1可知,外源GA处理对2个品种荚果鲜重影响不同,‘05D610’荚果鲜重在外源GA处理后极显著升高,‘05D677’荚果鲜重却略有下降;在外源ABA处理后,收获期‘05D610’和‘05D677’荚果鲜重均显著下降。同时,外源GA或ABA处理均显著增加了收获期两品种荚果的干重;同一外源激素处理下,‘05D610’荚果增重效果均明显低于‘05D677’;而对于同一品种而言,GA处理的荚果增重效果极显著高于ABA处理(表1)。
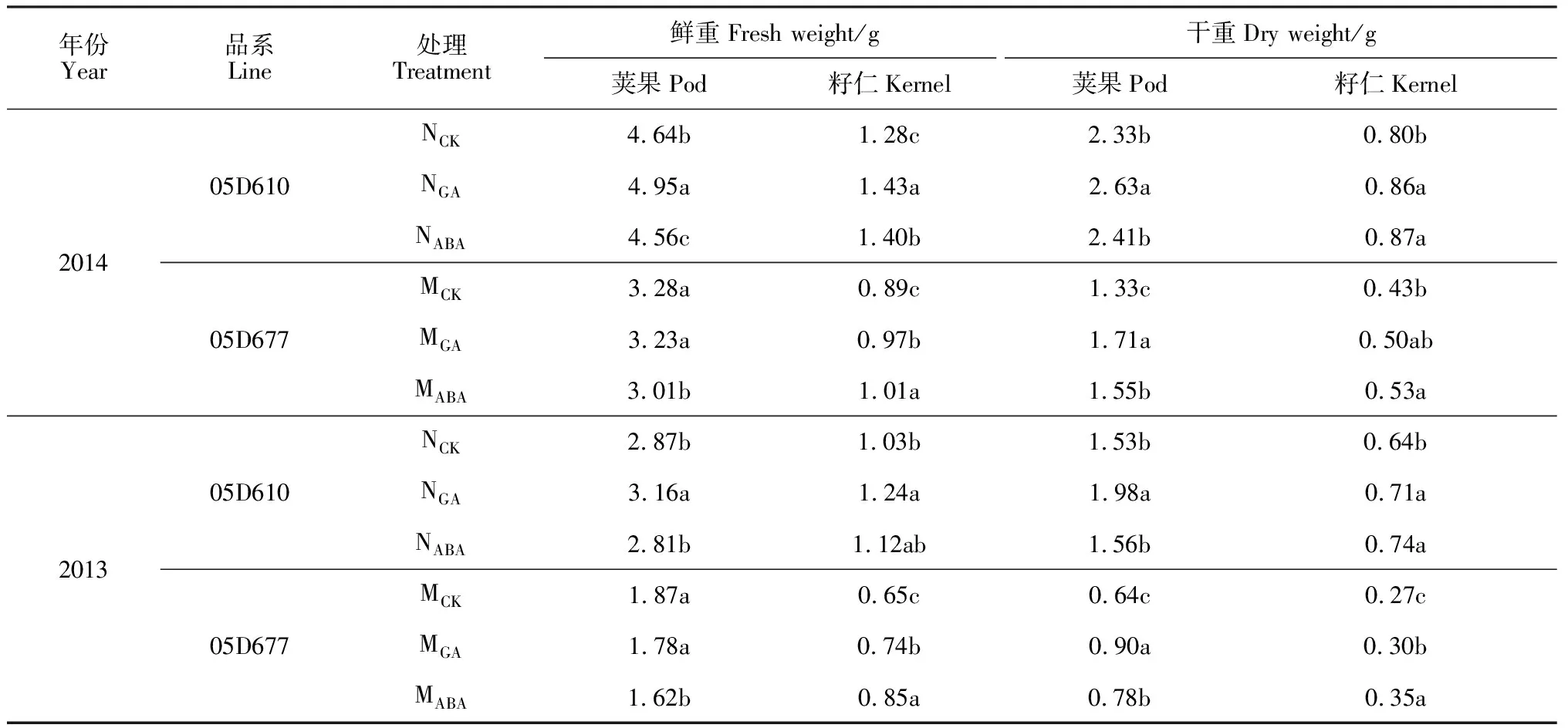
表1 外源GA和ABA处理后花生荚果和籽仁的鲜重及干重变化
2.3.2籽仁重表1显示,外源GA或ABA处理后,收获期‘05D610’和‘05D677’籽仁鲜重均比对照显著上升;而外源GA处理对‘05D610’籽仁鲜重的增重效果更显著,外源ABA处理对‘05D677’籽仁鲜重的增重效果更显著。外源GA或ABA处理也均显著增加了收获期‘05D610’和‘05D677’籽仁的干重;同一激素处理条件下,‘05D610’籽仁增重效果均明显低于‘05D677’;而就同一品种而言,GA处理籽仁增重效果则低于ABA处理(表1)。
3 讨 论
3.1 外源GA处理对荚果或籽仁发育的影响
激素在植物果实和种子的生长和发育中起着重要的调控作用。小麦同化物质的转运及在库中的积累转化都有激素参与调控[13],小麦胚建成早期阶段GA含量迅速提高[14-15];GA主要在小麦籽粒灌浆前期和后期发挥作用,含量高对延长籽粒灌浆持续期有利,不利于提高籽粒灌浆速率[5]。CTK控制着小麦胚乳细胞分裂、分化和调节籽粒的早期发育乃至决定籽粒的最终体积[16],水稻或小麦籽粒中ZT含量决定胚乳细胞增殖的速率,并进而决定籽粒的结实率[17-18]。本课题组前期研究发现,花生籽仁皱缩变异品系‘05D677’的荚果膨大阶段IAA含量高于正常品种,而ABA、细胞分裂素(ZT+ZR)和GA含量低于正常品种,推测内源激素比例失衡,导致荚果发育不良,充实度差,最终籽仁皱缩。
本研究检测了不施加外源激素时,正常品种‘05D610’和变异品系‘05D677’幼果或籽仁中4种内源激素含量的变化,结果与前期研究一致。外源GA处理改变了两品系荚果膨大阶段GA、ZT含量及GA/ABA比值和荚果充实阶段GA含量,提高了荚果充实阶段荚果和籽仁干物质积累速率,显著提高了荚果和籽仁生长发育正常品种‘05D610’的荚果重和籽仁重,极显著提高了皱缩变异品系‘05D677’的荚果重。说明外施GA显著促进了花生荚果的干物质积累。
结合前人研究结果推断,‘05D677’荚果膨大阶段前期(果针入土18~24 d)GA合成不足和峰值出现时间的推迟有可能影响了物质积累,导致收获期籽仁物质积累不足;ZT合成不足有可能影响籽仁子叶细胞的正常分裂、分化,影响库的建成。外源GA处理通过改变荚果膨大阶段GA、ZT含量及GA/ABA比值和荚果充实阶段GA含量,促进了荚果膨大阶段库的建成,提高荚果充实阶段荚果和籽仁干物质积累速率,显著提高了正常品种‘05D610’的荚果重和籽仁重,极显著提高了变异品系‘05D677’的荚果重。
3.2 外源ABA处理对荚果或籽仁发育的影响
ABA能够促进植物果实和种子中贮藏物质积累,特别是贮藏蛋白的合成[19],贮藏蛋白相关基因受ABA信号的诱导而提高表达水平[20],ABA对花生籽仁贮藏蛋白合成的促进作用发生在转录水平上[21]。外源ABA可以促进甜菜根部细胞对同化物的主动吸收能力[22]。水稻灌浆初期,籽粒中ABA含量和ABA/GA比值在籽粒充实度好的组合中高于籽粒充实度差的组合,开花后2 d喷施外源ABA,籽粒中ABA含量和ABA/GA增大;喷施外源GA后籽粒中GA含量增加,ABA/GA减小,有利于提高籽粒的灌浆速率,缩短灌浆持续期[6]。
本研究中,花生皱缩品系‘05D677’和正常品系‘05D610’的ABA含量变化趋势基本一致,‘05D677’幼果或籽仁中ABA含量从果针入土到收获期一直显著低于‘05D610’。外源ABA处理改变了荚果膨大阶段和充实阶段GA、ABA含量及GA/ABA比值,通过提高荚果膨大阶段幼果或籽仁干物质积累速率,提高了荚果和籽仁生长发育正常品种‘05D610’的籽仁鲜重和籽仁干重,极显著提高了皱缩变异品系‘05D677’的荚果干重、籽仁鲜重和籽仁干重。说明外施ABA处理显著增加了物质积累总量,而这种增加主要表现在籽仁干物质积累的增加方面。
结合前人研究推断,‘05D677’籽仁干物质积累期ABA含量的不足可能导致花生籽仁贮藏蛋白合成的减少,进而导致籽仁干物质积累速率的降低,使籽仁最终的干物质合成总量减少而表现出皱缩。
3.3 ‘05D677’品系籽仁皱缩原因分析
外源GA或ABA处理‘05D677’的幼果,对籽仁中GA、ABA、ZT和IAA含量和干物质积累速率及总量均有明显影响。‘05D677’荚果膨大阶段前期GA合成不足和峰值出现时间的推迟有可能影响了物质积累;ZT合成不足有可能影响籽仁子叶细胞的正常分裂、分化,影响库的建成,而且有研究表明外源GA可以促进ZT的生物合成[4];‘05D677’籽仁干物质积累期ABA含量的不足可能导致花生籽仁贮藏蛋白合成的减少,进而导致籽仁干物质积累速率的降低。对于同一品种,外源GA对荚果增重促进效果极显著高于ABA,对籽仁增重促进效果低于ABA,即ABA可能对‘05D677’籽仁皱缩的影响更大。可见,籽仁皱缩变异品系‘05D677’内源GA和ABA合成量不足导致了其籽仁干物质积累速率的显著降低,使籽仁最终的干物质合成总量减少而表现出皱缩。
外施GA和ABA处理,并没有使皱缩品系‘05D677’内源激素含量恢复到与正常品种‘05D610’相近似的水平或变化趋势,其荚果重和籽仁重仍然极显著低于‘05D610’,并且籽仁没有恢复到正常品系‘05D610’的饱满程度,说明‘05D677’籽仁中GA、ZT和ABA含量不足与籽仁生长量不足、皱缩直接相关,但突变品系中多种激素含量不足的调控机制有待进一步研究。
综上所述,在花生荚果膨大阶段初期,外源GA(20 mg·L-1)处理幼果能提高两品系荚果膨大阶段内源GA、ZT含量及GA/ABA比值和荚果充实阶段籽仁GA含量,通过促进荚果膨大阶段库的建成来提高荚果充实阶段荚果和籽仁干物质积累速率,显著提高了荚果和籽仁生长发育正常品种‘05D610’的荚果和籽仁的鲜重、干重,极显著提高了皱缩变异品系‘05D677’的荚果干重和籽仁鲜重。同时,在荚果膨大阶段初期,外源ABA(15 mg·L-1)处理幼果降低了两品系荚果膨大阶段内源GA含量和GA/ABA比值,提高了充实阶段‘05D677’内源ABA含量,通过提高荚果膨大阶段幼果或籽仁干物质积累速率,提高了荚果和籽仁生长发育正常品种‘05D610’的籽仁鲜重和干重,极显著提高了皱缩变异品系‘05D677’的荚果干重、籽仁的鲜重和干重。花生籽仁皱缩变异品系‘05D677’内源GA和ABA合成量不足导致了其籽仁干物质积累速率的显著降低,使籽仁最终的干物质合成总量减少而表现出皱缩;外源GA(20 mg·L-1)或ABA(15 mg·L-1)处理变异品系‘05D677’荚果膨大阶段初期的幼果,均能显著提高其荚果或籽仁的重量。
参考文献:
[1] 许智宏,李家洋. 中国植物激素研究:过去、现在和未来[J].植物学通报, 2006,23(5): 433-442.
XU Z H, LI J Y. Plant hormones research in China: past, present and future[J].ChineseBulletinofBotany, 2006,23(5): 433-442.
[2] 董明辉,刘晓斌,陆春泉, 等. 外源ABA和GA对水稻不同粒位籽粒主要米质性状的影响[J]. 作物学报, 2009,35(5): 899-906.
DONG M H, LIU X B, LU C Q,etal. Effects of exogenous ABA and GA on the main quality characteristics of Grains at different positions of panicle in rice[J].ActaAgronSin., 2009,35(5): 899-906.
[3] 王铭伦,何钟佩,李丕明. 花生荚果及种子发育过程中乙烯、CTK和ABA水平的变化[J].莱阳农学院学报, 1992,9(1): 1-5.
WANG M L, HE Z P, LI P M. Changes of ethylene, CTK and ABA levels during the development of peanut pods and seeds[J].LaiyangAgric.Coll., 1992,9(1): 1-5.
[4] 杨卫兵,王振林,尹燕枰, 等. 外源ABA和GA对小麦籽粒内源激素含量及其灌浆进程的影响[J].中国农业科学, 2011,44(13): 2 673-2 682.
YANG W B, WANG Z L, YIN Y P,etal. Effects of spraying exogenous ABA or GA on the endogenous hormones concentration and filling of wheat grains[J].Sci.Agric.Sin., 2011,44(13): 2 673-2 682.
[5] 刘 霞,穆春华,尹燕枰, 等.花后高温、弱光及其双重胁迫对小麦籽粒内源激素含量与增重进程的影响[J].作物学报, 2007,33(4): 677-681.
LIU X, MU C H, YIN Y P,etal. Effects of high temperature and shading stress after anthesis on endogenous hormone contents and filling process in wheat grain[J].ActaAgron.Sin., 2007,33(4): 677-681.
[6] 杨建昌,王志琴,朱庆森, 等. ABA与GA对水稻籽粒灌浆的调控[J].作物学报, 1999,25(3): 341-348.
YANG J C, WANG Z Q, ZHU Q S,etal. Regulation of ABA and GA to the grain fil1ing of rice[J].ActaAgron.Sin., 1999,25(3): 341-348.
[7] SCHUSSLER J R., BRENNER M L, BRUN W A. Relationship of endogenous abscisic acid to sucrose level and seed growth rate of soybeans[J].PlantPhysiol., 1991, 96: 1 308-1 313.
[8] 赵步洪,张洪熙,朱庆森, 等. 两系杂交稻籽粒充实不良的成因及其与激素含量的关系[J].中国农业科学, 2006,39(3): 477-486.
ZHAO B H, ZHANG H X, ZHU Q S,etal. Causes of poor grain plumpness of two-line hybrids and their relationships to contents of hormones in the rice grain[J].Sci.Agric.Sin., 2006,39(3): 477-486.
[9] 王传堂.花生遗传改良[M].上海:上海科学技术出版社, 2013.
[10] 冯启理,潘瑞炽. 花生结荚期间生长素、赤霉素和乙烯的变化[J]. 植物生理学通讯, 1989,(2): 25-28.
FENG Q L, PAN R C. Changes of auxin, gibberellin and ethylene during the peanut pod stage[J].PlantPhysiologyCommunications, 1989,(2): 25-28.
[11] 骆 兵,刘风珍,万勇善, 等. 不同花生品种(系)荚果和子仁内源激素含量变化与干物质积累特征分析[J].作物学报, 2013,39(11): 2 083-2 093.
LUO B, LIU F Z, WAN Y S,etal. Dynamic changes of endogenous hormones content and dry matter accumulation of pods and kernels in different varieties (Lines) of peanut (ArachishypogaeaL.)[J].ActaAgron.Sin., 2013,39(11): 2 083-2 093.
[12] 崔光军,刘风珍,万勇善. 花生荚果干物质积累与蔗糖代谢的相关性研究[J].中国农业科学, 2010,43(19): 3 965-3 973.
CUI G J, LIU F Z, WAN Y S. Relation-ship between dry matter accumulation and sucrose metabolism during pod development in peanut[J].Sci.Agric.Sin., 2010,43(19): 3 965-3 973.
[13] 史瑞青,谢惠玲,李鹏坤, 等.花后喷施外源物质对小麦激素含量及源库的调节效应[J].河南农业大学报, 2006,40(2): 122-126.
SHI R Q, XIE H L, LI P K,etal. Effects of spraying exterior substance after florescence on wheat hormone contents and source-sink modulation[J].JournalofHenanAgriculturalUniversity, 2006,40(2): 122-126.
[14] BEWLEY J D, BLACK M. In Seeds: Physiology of Development and Germination[M]. New York: Plenum Press, 1994: 367.
[15] ROCK C D, QUATRANO R S. The role of hormones during seed development[M].In: Plant hormones: Physiology, Biochemistry, and Molecular Biology (2nd edition). (eds. P.J. Davies).Kluwer Academic Publishers, Norwell, Massachusetts, USA, 1995: 671-697.
[16] 魏育明,郑有良. 内源激素与多小穗小麦幼穗分化持续时间的关系[J].麦类作物学报, 2000,20(2): 35-38.
WEI Y M, ZHENG Y L. Endogenous hormones and duration of spikelet young ear differentiation of wheat[J].JournalofTriticeaeCrops, 2000,20(2): 35-38.
[17] 杨建昌,刘立军,王志琴, 等. 稻穗颖花开花时间对胚乳发育的影响及其生理机制[J].中国农业科学, 1999,32(3): 44-51.
YANG J C, LIU L J, WANG Z Q,etal. Spikes new flowering time affect and physiological mechanism of endosperm development[J].Sci.Agric.Sin., 1999,32(3): 44-51.
[18] 戴忠民.喷施6BA和ABA对冬小麦籽粒胚乳细胞增殖和淀粉积累的影响[J].麦类作物学报,2008,28(3): 484-489.
DAI Z M. Effects of 6BA and ABA on Endosperm cell propagation and starch accumulation in grains of winter wheat[J].JournalofTriticeaeCrops,2008,28(3):484-489.
[19] FINKELSTEIN R R, GIBSON S I. ABA and sugar interactions regulating development:cross-talkor voices in a crowd[J].Curr.Opin.PlantBiol., 2002, 5: 26-32.
[20] 李 杉,邢更妹,崔凯荣, 等. 植物体细胞胚发生中ATP酶活性时空分布动态与内源激素的变化[J].植物学通报, 2001,18(3): 308-317.
LI B, XING G M, CUI K R,etal. ATPase activity and endogenous hormone changes during plant somatic embryogenesis[J].ChineseBulletinofBotany, 2001,18(3): 308-317.
[21] 黄上志,傅家瑞. 脱落酸对发育中花生胚萌发和贮藏蛋白质合成的影响[J]. 植物生理学报, 1993,19(2): 31-37.
HUANG SH ZH, FU J R. The effects of ABA on developing peanut embryo germination and the influence of storage protein synthesis[J].ActaPhytophysiologicaSinica, 1993,19(2): 31-37.
[22] ROBERT A S, ROGER E W. Effect of plant hormones on sucrose uptake by sugar beet root tissue discs[J].PlantPhysiol., 1984, 74: 951-955.

