石榴赤霉素合成相关基因PgKO的克隆及表达分析
黄 蓉,刘 娜,王 琦,熊 枫,张水明
(安徽农业大学 园艺学院,合肥 230036)
石榴花为两性花即雌雄同株,根据雌蕊发育状况分为完全花与不完全花。完全花是葫芦状花或筒状花,俗称“大屁股果花”;不完全花的萼筒呈喇叭形,称“钟状花”、“尖屁股幌花”[1-2]。其中,不完全花呈萼筒钟状花内虽可见雌蕊,但已明显退化,子房瘦小,胚珠发育不良,雌蕊萎缩,虽可开花但不结实或结实很少,并且雄蕊过度发育导致坐果极低[3]。雌蕊败育已经成为影响石榴产量和经济效益的关键因素之一。如今大量研究表明植株花芽分化与植物激素有关[4]。其中赤霉素不仅有利于不完全花的发育,影响植物的花芽分化,而且有利于幼果的坐果和生长发育[5]。有关学者在对蓖麻、油茶、荔枝、龙眼、光皮树成花的研究中均发现赤霉素对花芽分化具有显著的促进作用[6-7]。内根-贝壳杉烯氧化酶(KO)是赤霉素生物合成的关键调控对象之一,同时是赤霉素内质网及细胞质基质中生物合成的关键酶[8],受NADPH调控,具有一定高度保守的血红素特征结合域P450酶[9]。
近几年人们大多是从生理方面来探寻石榴雌蕊退化败育的原因,而从分子角度的研究报道很少。因此,本研究以石榴‘红玉石籽’为实验材料,运用RT-PCR和RACE技术,克隆得到PgKO, 并采用实时荧光定量PCR,对该基因在不同花型的不同花期、同一花期不同花型3个组织中的表达水平进行分析,为石榴雌蕊退化败育等原因提供参考,也为进一步研究PgKO的功能奠定基础。
1 材料和方法
1.1 实验材料
所用实验材料取自安徽农业大学农业园石榴种质资源圃;分别在蕾期(4月20日)和盛花期(6月15日),采取同一品种 ‘红玉石籽’的筒状花和钟状花,以及盛花期(6月15日)时这两种花型的子房、花药、花萼组织,浸于液氮中带回实验室,随后储存于-80 ℃冰箱中备用。
1.2 方 法
1.2.1基因全长序列的克隆以‘红玉石籽’的花为材料,用RNAprep Pure Plant Kit植物总RNA提取试剂盒(天根公司)提取石榴花总RNA。根据GenBank中已登录的其他多个物种的保守序列,设计兼并引物KO-F1/KO-R1(表1)进行中间片段的扩增。在获取的中间片断基础上,继续设计引物KO-5′GSP1/KO-5′GSP2和KO-3′GSP1/KO-3′GSP2(表1),按照SMARTerTMRACE cDNA Amplification Kit(Clontech)操作步骤, 通过巢式PCR,分别进行KO基因5′和3′端序列的扩增。最后设计引物KO-F/KO-R,将3部分序列进行拼接,使用KOD plus高保真酶全长扩增,连接到pGEM-Teasy载体,送上海生工公司测序。
1.2.2生物学信息分析序列比对和同源性分析使用Clustalx、GENEDOC和DNAMAN软件;运用ExPASy-Protparam Tool在线工具分析其蛋白质理化性质;运用Psort(http://psort.hgc.jp/form.html)进行亚细胞定位分析;构建进化系统发育树使用SPSS和MEGA 软件;运用PBIL LYON-GERLAND数据库(http://npsapbil.ibcp.fr/cgibin/npsa_automat.plpage=/NPSA/npsa_hnn.html)进行氨基酸二级结构预测。
1.2.3荧光定量PCR分析根据获得的PgKO全长序列,使用Primer premier 5.0设计荧光定量PCR引物(表2)。采用Trizol方法提取花、子房、花药和花萼的RNA,分别取4 μg经DNase I处理后的RNA,利用MMLV反转录酶进行反转录,获得cDNA模板。使用ABI STEPONE荧光定量PCR仪进行荧光定量PCR分析,反应体系按TaKaRa SYBR Premix EXTaq试剂盒步骤进行操作:SYBRTM Premix ExTaq10 μL,正、反向引物(10 μmol · L-1)各0.8 μL,ROX Reference Dye 50× 0.4 μL,cDNA模板2.0 μL,ddH2O 6.0 μL。反应程序为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸1 min,共40个循环。以石榴的内参基因actin作为内参,使用2-ΔΔCt法,求得待测样品的相对表达量。
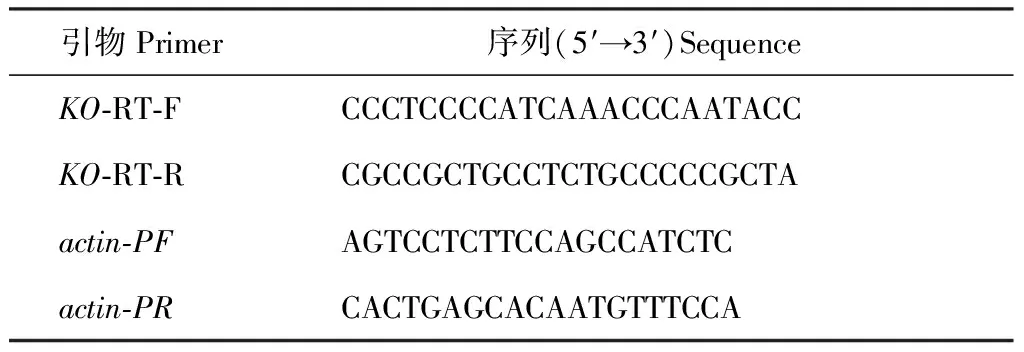
表2 荧光定量PCR扩增所需要的引物及其序列

表1 扩增所需要的引物
2 结果与分析
2.1 石榴PgKO基因全长的克隆与序列分析
根据已经公布的苹果、白梨、橡胶树等物种的KO序列,设计兼并引物KO-F1/KO-R1进行扩增,经回收、转化和阳性菌落PCR检测后送至上海生工测序,得到一个长为268 bp的核酸片段(图1,A)。用基因特异性引物KO-5′GSP1和UPM Long作为第1轮引物,以此PCR产物为模板,KO-5′GSP2与NUP作为引物进行第2轮扩增,获得KO基因的5′端序列,测序得到一个792 bp片段(图1,B),同理得到长为669 bp的片段的5′序列(图1,C)。最后将获得的石榴KO基因中间片段、3′端序列和5′端序列进行拼接,获得全长为1 729 bp的PgKO基因序列(图 3)。该基因的开放阅读框为1 542 bp,编码513个氨基酸。
2.2 石榴PgKO氨基酸序列与进化分析
将克隆的PgKO与NCBI公布的其他植物的KO氨基序列进行比对,结果(图 2)发现,PgKO与其他物种具有一定的相似性,且具有CYP450结构域:脯氨酸富含域(proline-rich domain)、氧还原位点(redio sites)和血红素结合域(heme-binding domain)。
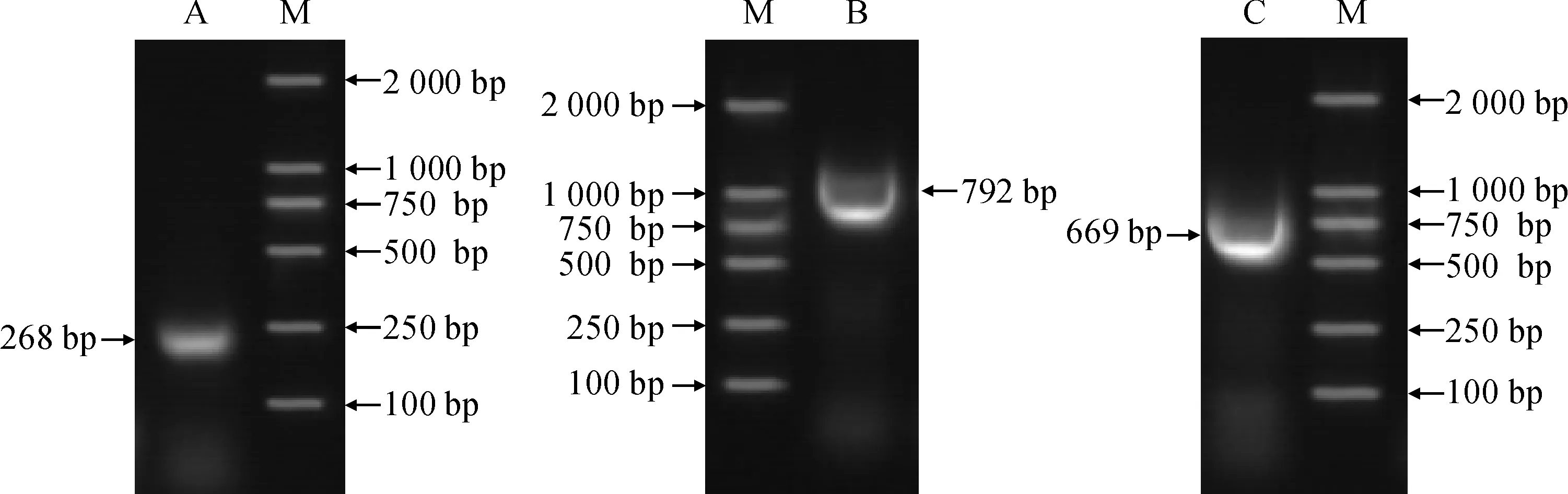
为了确定PgKO与其他物种KO的亲缘关系,利用MEGA5.0软件,将PgKO与桉树、苹果、葡萄等13个物种的KO氨基酸序列进行系统进化分析。结果(图 4)显示,PgKO与桉树EgKO的亲缘关系最近,聚为一枝,而与咖啡CaKO的亲缘关系最远。
2.3 石榴PgKO蛋白结构特征分析
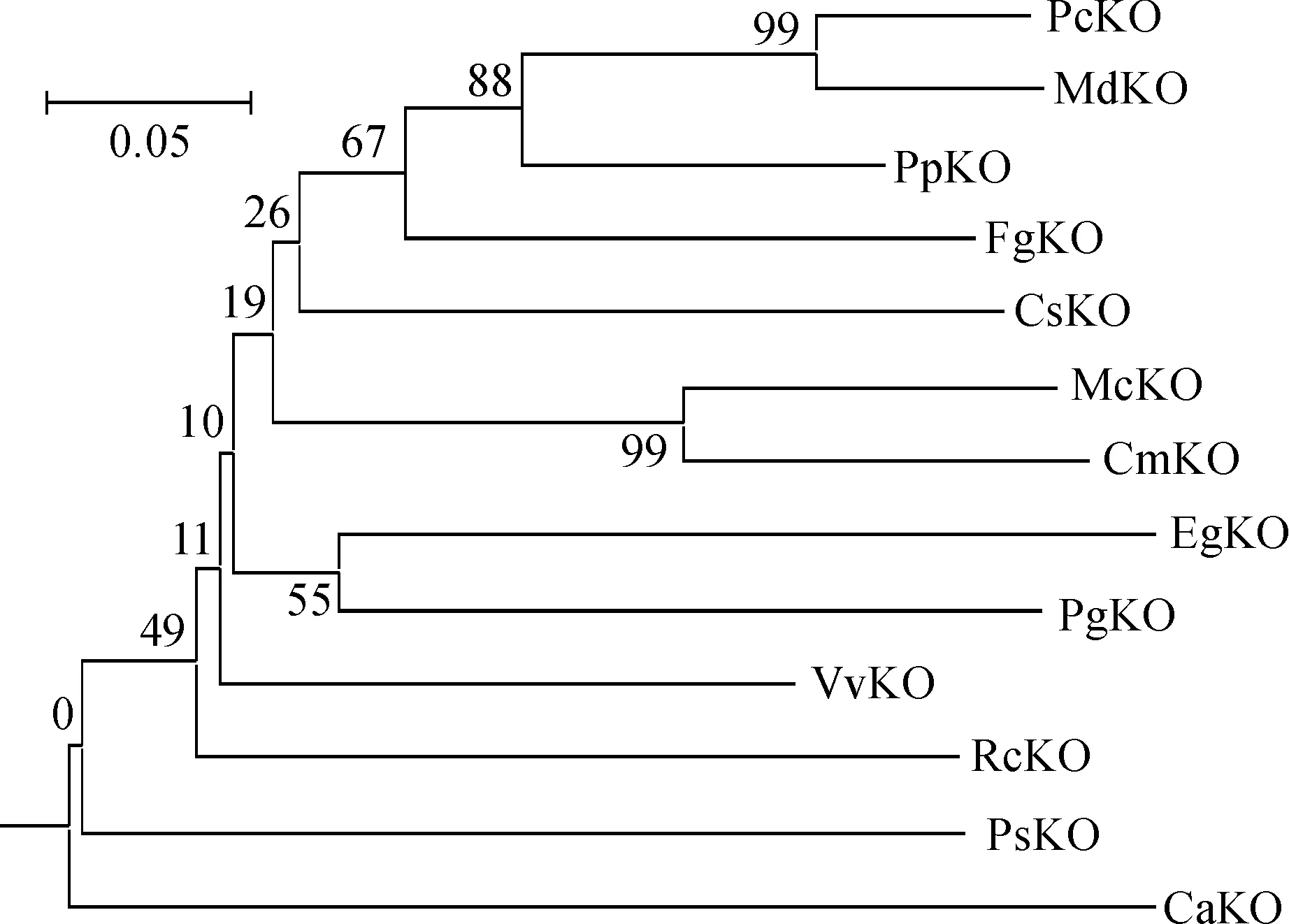
从疏水性分析结果(图5)可以看出,PgKO蛋白的前部和后部有较强亲水区,中部有明显疏水区。在467氨基酸处有最大值3.002,在第161氨基酸处有最小值-3.511,在N端具有跨膜的疏水序列。

PcKO. 西洋梨(JN106464.1);MdKO. 苹果(AY563549.2);VvKO. 葡萄 (JQ086553.1);EgKO. 桉树 (XM_018876571.1);TcKO. 可可 (XM_018125980.1);方框内为CYP450结构域图2 PgKO蛋白及其他物种KO氨基酸多重序列比对PcKO. Pyrus communis(JN106464.1); MdKO. Malus x domestica (AY563549.2); VvKO. Vitis vinifera (JQ086553.1); EgKO. Eucalyptus grandis (XM_018876571.1); TcKO. Theobroma cacao(XM_018125980.1); CYP450 motifs arc in the boxesFig.2 Multiple alignment of the amino acid sequences of PgKO and other KOs
M.DL 2000;A. 中间片断;B.5′-RACE;C.3′-RACE图1 PgKO基因扩增结果M.DL 2000;A. Intermediate fragment;B.5′-RACE;C.3′-RACEFig.1 The amplification results of PgKO

ATG为起始密码子;TAA为终止密码子;方框内序列为开放阅读框图3 石榴PgKO基因核苷酸序列ATG is the initiation codon; TAA is the terminator codon;The sequence in square is open reading frameFig.3 Nucleotide sequence of PgKO gene in pomegranate
PgKO基因合成的蛋白分子式为 C2619H4159N713O745S23,相对分子质量为141.16 kD,总共原子数目为8 259,理论等电点为4.9。该蛋白中含量最多的氨基酸是Leu (L)为10.3%,其次是Ala (A)为8.4%,含量最少的氨基酸是Cys(C)和Trp (W)均为1.6%。总带负电荷残基(Asp+Glu)为60,总带正电荷残基(Arg+Lys)为66;脂肪族氨基酸指数为92.81,总平均疏水指数(GRAVY)为-0.212,该蛋白为疏水性蛋白。
Psort进行亚细胞定位结果表明,PgKO蛋白位于内质网的可能性为44.4%;位于液泡的可能性为22.2%;位于线粒体和高尔基体的可能性都为11.1%,因此推测该白蛋白可能位于内质网中。
2.4 2种花型PgKO基因的表达分析
2.4.1不同花期PgKO基因的表达以品种‘红玉石籽’为材料,对筒状花和钟状花在不同花期中的PgKO基因表达水平进行检测。结果(图6)表明:盛花期时,钟状花的表达量约为0.97,筒状花的表达量约1.2,是钟状花的1.2倍;蕾期时,钟状花的表达量约为0.5,筒状花的表达量约1.1,为钟状花的2.2倍。
2.4.2不同组织PgKO基因的表达为探讨PgKO基因在石榴2种花型在盛花期时不同组织中的表达水平,对筒状花和钟状花的子房、花药、花萼中的PgKO相对表达量进行检测。结果(图7)表明:钟状花的子房表达量最低约为0.95,其次是花萼约为1.39,表达量最高是花药约为1.41,分别是子房的1.48倍、花萼的1.01倍;筒状花的花萼表达量最低约为0.97,其次是花药约为1.1,表达量最高的是子房约为1.2,分别是花萼的1.2倍、花药的1.0倍。
PcKO. 白梨(JN106464); MdKO. 苹果(AAS68017.2); PpKO. 巴旦木(AF495728.1). FgKO. 草莓(AAR18407.2); CsKO. 柑橘(XM_006492496.2);McKO. 苦瓜(ADE06669.1); CmKO. 南瓜(AAG41776.1); EgKO. 桉树(XP_010028718.1); PgKO. 石榴(MG208017); VvKO. 葡萄(JQ086553.1); RcKO. 蓖麻(XP_002510288.1); PsKO. 桃(AAP69988.1); CaKO. 咖啡(ACQ99374.2);分支点数字表示基于500次 重复该节点的自展支持率; 标尺代表遗传距离图4 石榴与不同物种KO蛋白系统进化树PcKO. Pyrus communis (JN106464); MdKO.Malus × domestica (AAS68017.2); PpKO. Prunus persica (AF495728.1). FgKO. Fragaria grandiflora (AAR18407.2);CsKO.Citrus sinensis (XM_006492496.2);McKO.Momordica charantia (ADE06669.1); CmKO.Cucurbita maxima (AAG41776.1); EgKO.Eucalyptus grandis (XP_010028718.1);PgKO.Punica granatum (MG208017); VvKO. Vitis vinifera (JQ086553.1); RcKO.Ricinus communis (XP_002510288.1); PsKO.Pisum sativum (AAP69988.1); CaKO.Coffea arabica (ACQ99374.2); The nodes in the figure show the bootstrap values based on 500 replications. The scale represents the genetic distance Fig.4 Phylogenetic tree constructed by amino acid sequences of KO protein in pomegranate and other plants
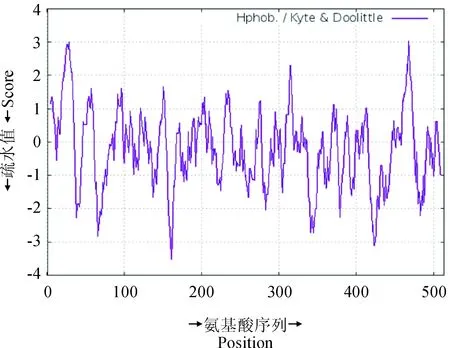
图5 PgKO的疏水性和亲水性预测Fig.5 Predication of hydrophobicity/ hydrophilicity of PgKO
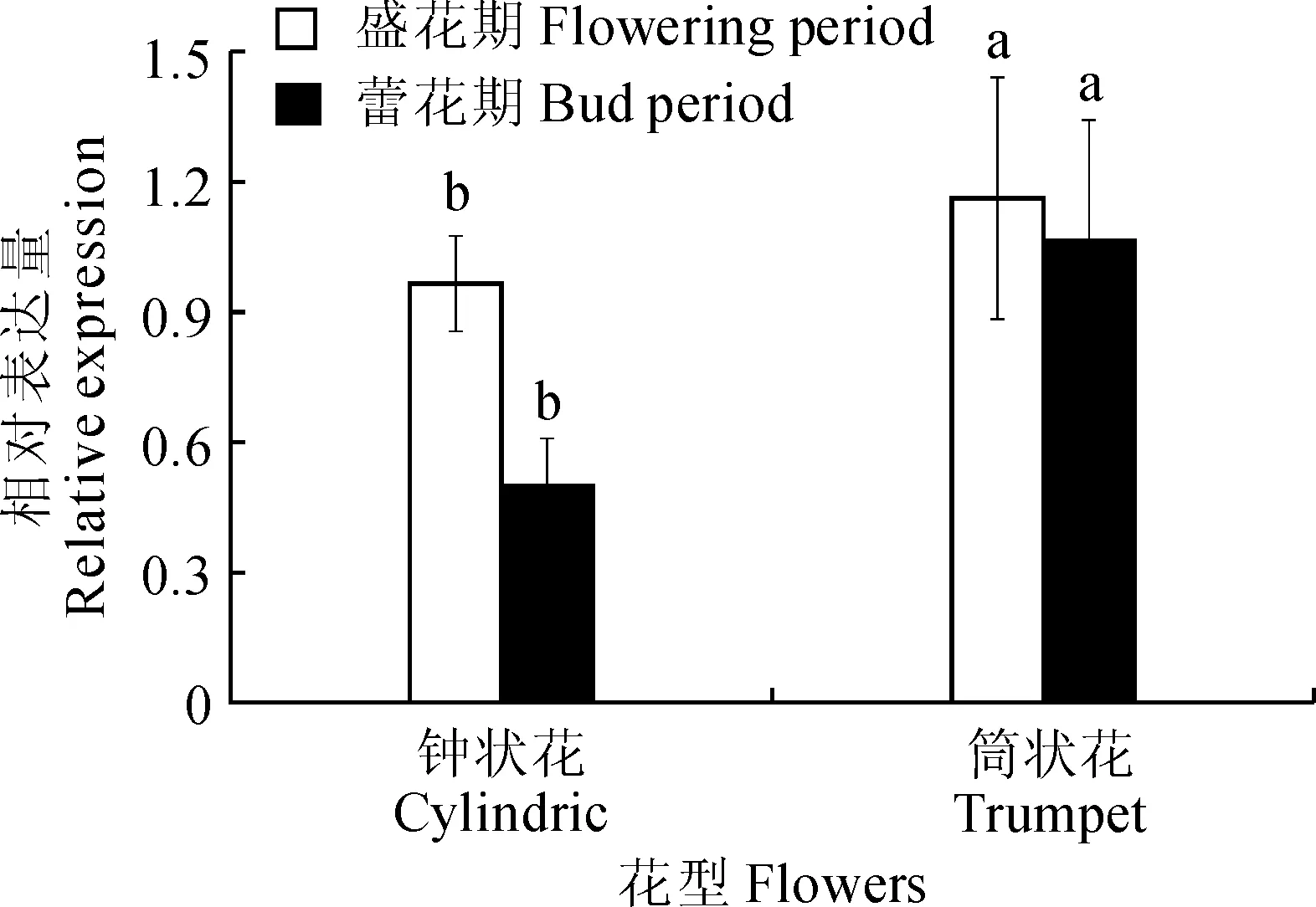
图中不同小写字母表示花型间差异显著(P<0.05)图6 石榴不同花期不同花型PgKO基因表达Different normal letters mean significant difference among flowers (P<0.05)Fig.6 The relative expression of PgKO in different flower patterns at different stages of pomegranate.
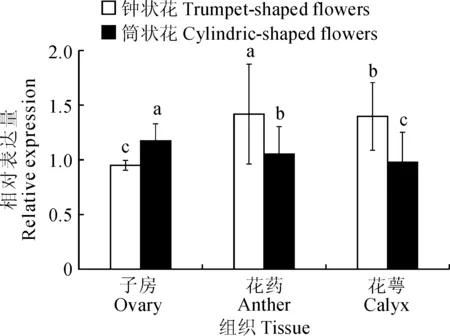
图中不同小写字母表示组织间差异显著(P<0.05)图7 石榴同一花期不同花型不同组织PgKO基因表达Different normal letters mean significant difference among tissues (P<0.05)Fig.7 The relative expression of PgKO in different flower patterns and different tissues at the same stage of pomegranate
3 讨 论
石榴果实中含有丰富的抗氧化剂和多酚类物质,具有较高的营养保健价值[10],但其产量和经济效益严重受到了雌蕊败育的影响。有关研究表明赤霉素对不完全花的发育起关键作用,且高质量分数的GA3有利于坐果和生长发育[5]。对番茄‘Indian River’品种[11]和‘Micro-Tom’品种[12]施加GA3可促使花柱的伸长,促进雌蕊发育,从而提高授粉率和坐果率;程华等[13]通过研究植物激素对板栗花芽分化的影响,发现较高的赤霉素能够促进雌性化。同时赤霉素还能调节雄蕊的生长发育[14],赤霉素中相关受体调节DELLA蛋白泛素化等过程,因此拟南芥三重突变体(gidla、gidlb、gidlc)表现为花丝生长矮小,伸长受到阻碍,而抑制雄蕊的发育,促进雌蕊的生长[15]。GA4+7可以通过调节拟南芥花序中雄蕊的生长发育,缩短雄蕊和雌蕊之间生长的长度差值,从而解决授粉困难坐果率低等问题[16]。Sakata[17]研究发现减少GA3含量可以阻碍花粉的发育,抑制雄蕊的生长,提高水稻的结实率。因此可以通过增加石榴中赤霉素的含量来调节雌蕊和雄蕊的生长发育比率,从而提高果实的授粉率和坐果率,提高产量和经济效益。
近年来,随着市场对石榴的需求增大,为了探寻石榴雌蕊退化败育的原因,人们大多从生理角度进行研究,例如营养物质和过氧化物酶等方面。但是关于石榴雌蕊败育形成原因在分子方面的研究报道很少。这些生理方面的研究只能从外部环境改变石榴的坐果率,并不能从基因上解决石榴坐果率低等问题。
因此本研究从分子角度出发,克隆得到石榴中赤霉素合成关键基因PgKO,并通过荧光定量PCR表明PgKO与石榴的花芽分化和雌雄蕊发育有关。所以研究赤霉素合成关键基因可以初步从分子角度解决石榴雌蕊败育坐果率低等问题,提高石榴的经济产量。同时可为探讨赤霉素对石榴筒状花和钟状花的形成影响奠定基础,对整个石榴产业具有重大意义。
参考文献:
[1] 汪小飞,向其柏,尤传楷,等.石榴品种分类研究[J].果树学报,2007,24(1): 94-97.
WANG X F, XIANG Q B, YOU C K,etal.Advances in research on classification of pomegranate[J].JournalofFruitScience,2007,24(1): 94-97.
[2] 王 珊,蔡斌华,章 镇,等. 果梅完全花与不完全花的差异蛋白分析[J].植物遗传资源学报,2008,9(4): 465-468.
WANG S,CAI B H, ZHANG Z,etal. Analysis of differential proteins in perfect and imperfect flowers of Japanese apricot (PrunusmumeSieb. et Zucc.)[J].JournalofPlantGeneticResources,2008,9(4): 465-468.
[3] WETZSTEIN H Y, YI W, PORTER J A,etal. Flower position and size impact ovule number per flower, fruit set and fruit size in pomegranate[J].JournaloftheAmericanSocietyforHorticulturalScience,2013,138(3): 159-166.
[4] 温 玥, 苏淑钗, 马履一,等. 赤霉素处理对油茶花芽形成和果实品质的影响[J]. 浙江农林大学学报, 2015,32(6): 861-867.
WEN Y, SU S C, MA L Y,etal. Effects of gibberellins on flower bud formation and fruit quality inCamelliaoleifera[J].JournalofZhejiangA&FUniversity, 2015,32(6): 861-867.
[5] 李 进, 杨荣萍, 洪明伟,等. 石榴完全花与不完全花的内源激素变化研究[J]. 云南农业大学学报, 2015,30(6): 986-990.
LI J, YANG R P, HONG M W,etal. Variation of endogenous hormone in perfect and imperfect flowers of pomegranate[J].JournalofYunnanAgriculturalUniversity, 2015,30(6): 986-990.
[6] 彭映辉, 曾冬琴, 陈飞飞,等. 赤霉素及多效唑对3种草本花卉花期与株高的影响[J]. 中南林业科技大学学报, 2007,27(4): 100-103.
PENG Y H, ZENG D Q, CHEN F F,etal. Effects of spraying with GA3or paclobutrazol on the flowering and body height of three herbal flower species.[J].JournalofCentralSouthUniversityofForestry&Technology, 2007,27(4): 100-103.
[7] 孙 颖, 陈 显, 刘 儒,等. 不同浓度赤霉素处理对油桐花芽分化的影响[J]. 经济林研究, 2014,32(1): 97-100.
SUN Y, CHEN X, LIU R,etal.Effects of different concentrations of gibberellin on flower bud differentiation in tung oil tree[J].NonwoodForestResearch,2014,32(1): 97-100.
[8] TANAKA J, YANO K, AYA K,etal. Antheridiogen determines sex in ferns via a spatiotemporally split gibberellin synthesis pathway[J].Science, 2014,346(6 208): 469-473.
[9] SU P, GUAN H, ZHANG Y,etal. Probing the single key amino acid responsible for the novel catalytic function ofent-kaurene oxidase supported by NADPH-cytochrome P450 reductases inTripterygiumwilfordii[J].FrontiersinPlantScience, 2017, 8: 1 756.
[10] BI X F, LI Y. Study on chemical composition and health functions of pomegranate[J].Mod.Agri.Sci.Techn., 2010, (22): 356-357, 360.
[11] HONMA S, BUKOVAC M J. Inheritance of gibberellin induced heterostyly in the tomato[J].Euphytica, 1966,15(3): 362-364.
[12] CARRERA E, RUIZ-RIVERO O, PERES L E P,etal. Characterization of the procera tomato mutant shows novel functions of the S1DELLA protein in the control of flower morphology, cell division and expansion, and the auxin-signaling pathway during fruit-set and development[J].PlantPhysiology, 2012,160(3): 1 581-1 596.
[13] 程 华, 李琳玲, 袁红慧,等. 内源激素含量变化与板栗花芽分化关系研究[J]. 北方园艺, 2013, (22): 5-9.
CHENG H, LI L L, YUAN H H,etal. Study on the relationship between the changes of endogenous hormone content and flower bud differentiation of Chinese chestnut[J].NorthernHorticulture, 2013, (22): 5-9.
[14] PLACKETT A R, THOMAS S G, WILSON Z A,etal. Gibberellin control of stamen development: a fertile field[J].TrendsinPlantScience, 2011,16(10): 568-578.
[15] SONG S, QI T,etal. Regulation of stamen development by coordinated actions of jasmonate, auxin, and gibberellin inArabidopsis[J].MolecularPlant, 2013,6(4): 1 065-1 073.
[16] HUANG Z, FOOTITT S, FINCHSAVAGE W E. The effect of temperature on reproduction in the summer and winter annualArabidopsisthalianaecotypes bur and cvi[J].Ann.Bot., 2014,113(6): 921-929.
[17] SAKATA T, ODA S, TSUNAGA Y,etal. Reduction of gibberellin by low temperature disrupts pollen development in rice[J].PlantPhysiology, 2014,164(4): 2 011-2 019.

