基于FRET技术构建破伤风毒素和B型肉毒毒素酶类抑制剂高通量体外筛选方法
罗 森,丁朋晓,李 涛,王 琴,王 慧
破伤风毒素(Tetanus toxin,Tet)导致的破伤风死亡率高,在全球范围内高达30%~50%[1]。B型肉毒毒素(Botulinum Neurotoxin serotype B,BoNT/B)导致的B型肉毒食物中毒在全世界时有散发[2]。两个毒素都为分子量150 ku的蛋白质,由一条轻链(light chain,Lc)和一条重链(heavy chain,Hc)通过二硫键联结在一起[3]。当全毒素进入血液后,Hc结合并进入神经细胞内释放出Lc[4],两个毒素的作用神经蛋白位点相同,都特异性裂解VAMP-2的Q76 -F77位点[5],阻断神经递质乙酰胆碱的释放,引起神经传导受阻导致人畜中毒死亡。目前,除抗体早期能够中和血液中游离的毒素外,尚缺乏破伤风毒素和肉毒毒素有效的治疗方法和药物。亟需开发新型安全有效的药物,大量潜在药物的筛选需要合适理想的筛选模型。传统的方法是动物筛选模型,对大规模或大批量的样品筛选和分析显然不现实。FRET技术已广泛应用于生命科学领域研究中,该研究拟用底物肽(VAMP33-94)片段作为连接链(lingker)连接CFP 和 YFP两个荧光蛋白构建成底物。加入毒素后酶解linker导致两个荧光分子分离距离较远而不会发生FRET,进而YFP 发射528荧光值大大减弱和CFP发射485荧光值大大增强。基于此原理,建立以双荧光标记的底物分析法满足对破伤风毒素和B型肉毒毒素的检测及抑制剂的高通量体外筛选所需 。
1 材料与方法
1.1材料重组蛋白B型肉毒毒素轻链(Botulinum Neurotoxin serotype B light chain, BLc)、重组蛋白破伤风毒素轻链(Tetanus toxin light chain, TLc)、底物肽(VAMP33-94)片段及重组质粒pET22b-CFP-YFP由本室前期制备和保存;FluoroNunc96孔黑板为丹麦Nunc公司产品。荧光检测和分析通过SynergyTMHT 酶联仪(美国BioTek公司)完成;反应液为50 mmol/L Hepes液: pH 7.5,5 mmol/L DTT,10 μmol/L ZnCl2,10 mmol/L NaCl,0.1% Tween 20。SDS、Amp、X-gal、IPTG购自美国promega公司;酵母提取物和蛋白胨等培养基购自英国OXIOD公司;琼脂糖、Taq DNA聚合酶、限制性内切和酶T4 DNA连接酶购自美国NEB公司; DNA凝胶回收试剂盒、E.coliDH5α、BL21(DE3) Rosetta感受态细胞、pEASY-T1载体、蛋白质相对分子质量标志物和D2 000 bp Marker购自北京全式金生物技术公司;其他试剂均为国产分析纯或超级纯。HisTrap FF柱为GE Healthcare公司产品。
1.2方法
1.2.1表达载体的设计和构建过程设计原理:在pET22b表达载体中利用相应的酶切位点插入CFP基因片段和YFP基因片段,构建重组质粒并命名pET22b-CFP-YFP,见图1。在该重组质粒通过BamHⅠ酶切位点位置插入其底物肽(VAMP33-94)片段。

图1 pET22b-CFP-YFP质粒构建示意图
底物肽(VAMP33-94)片段与克隆载体pEASY-T1连接并立即转化入制备的感受态细胞DH5α中。培养细菌涂平板,挑取单克隆试管培养后PCR鉴定,阳性克隆菌送测序。测序正确的单克隆提取质粒,保存克隆质粒备用。用BamHⅠ37 ℃下过夜酶切重组克隆质粒后DNA凝胶电泳分离并回收,同样方法,用BamHⅠ酶切并回收的pET22b-CFP-YFP载体片段。使用T4 DNA连接酶连接底物肽(VAMP33-94)片段到pET22b-CFP-YFP载体中。连接后连接产物转化感受态细胞DH5α中,培养细菌涂平板,挑取单克隆培养后PCR鉴定,阳性克隆送测序并序列比对,提取序列比对完全一致的质粒克隆菌株,保存备用。
1.2.2重组蛋白在大肠杆菌中的诱导表达与纯化重组表达质粒转化感受态细胞BL21(DE3) Rosetta中,培养后涂平板,挑取单克隆PCR鉴定,将阳性菌落保存备用。表达菌接种于含氨苄的10 ml培养基中,37 ℃、200 r/min培养12 h,以1 ∶100接种于新鲜的LB培养基中,37 ℃继续振荡培养至波长600 nm处吸光度值为0.6左右,加入IPTG至终浓度为1 mmol/L,在20 ℃继续诱导培养24 h。收集菌体6 000 r/min离心15 min后保存备用。PBS重悬菌体,在冰水中进行超声充分破碎, 10 000 r/min离心15 min,收集上清液和沉淀15%SDS-PAGE分析目的蛋白情况。
超声充分破碎处理细菌后以4 ℃、10 000 r/min离心15 min,弃沉淀收集上清备用,用结合缓冲液10个柱体积柱床体积的平衡镍柱,取上清使用镍柱(HisTrap FF柱)上样进行His亲和层析纯化,用10个柱体积洗脱缓冲液 (20 mmol/L 磷酸钠,500 mmol/L NaCl,500 mmol/L咪唑,pH 7.4)线性梯度洗脱。收集洗脱样品进行SDS-PAGE电泳分析。纯化后的目的蛋白透析于缓冲液(50 mmol/L HEPES, pH 7.5)中保存于-20 ℃备用。
1.2.3利用BLc和TLc分别对荧光标记底物进行活性鉴定在反应缓冲液中,将ALc、BLc和TLc分别与荧光标记底物在37 ℃反应20 min,同时在设定阴性对照组中只加反应缓冲液。对反应后的样品进行蛋白电泳检测底物的酶切情况。
1.2.4基于荧光标记底物的分析方法的条件优化利用Lc对荧光标记底物活性的检测指标的确定和反应条件的优化步骤:① 根据以往研究报道显示CFP荧光蛋白的激发波长在434 nm左右,CFP荧光蛋白最强的荧光波长在470 nm左右,本研究检测值为485 nm;YFP荧光蛋白最强荧光波长在527 nm左右,本研究检测值为528 nm。在酶标仪中装入激发波(420/50)滤光片,发射波的分别为滤光片(485/20)和滤光片(528/20);② 于96孔板中加入100 μl的系列浓度的荧光标记底物,37 ℃条件下,于酶联仪中动态检测荧光标记底物发射波长485 nm和528 nm的荧光值变化和发射波长比 (528/485)变化;③ 在相同条件下对比加入BLc (或TLc)对荧光标记底物反应下荧光值485 nm和荧光值528 nm的变化以及荧光值比(528/485)的变化标准化后与底物变化蛋白电泳结果作相关性分析。在96孔板100 μl反应体系中加入含有相应浓度为的底物,处理孔加入TLc (或BLc),对照组加入ALc,未处理孔只加反应液,本底孔只有反应液。处理好后立即用检测酶标仪。检测结果数据通过Gen5软件(BioTek) 处理和分析;④ 对分析方法的几个参数检测及优化:底物从0.01 μmol/L 到100 μmol/L;酶从0.1 nmol/L到100 nmol/L;间隔时间从0.5 min到10 min;检测时间从20 min到180 min。
1.2.5酶活动力学测定在特定浓度下的Lc和系列梯度(300 nmol/L~33 μmol/L)底物对Km和Kcat进行测定。检测条件为激发波长未434 nm,检测发射波长分别为485 nm和528 nm,至少动态检测30 min(2 min/次)。方法参见文献[6]和米氏方程。
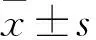
2 结果
2.1重组表达载体构建结果通过扩增后获得VMAP33-94底物片段,片段大小与预测结果大小相符。获得的产物测序结果正确,无碱基突变。VMAP33-94片段PCR回收产物在T4 DNA连接酶作用下连接到克隆载体,转化到克隆菌后挑选阳性克隆测序结果正确。提取克隆质粒经酶切处理得到目的插入片段,连接到表达载体pET22b-CFP-YFP并转化克隆菌,PCR鉴定得到与条带大小一致,测序结果表明与设计的完全一致,质粒构建成功,命名为pET-22b-CYVAMP。
2.2重组蛋白表达与纯化结果质粒pET-22b-CYVAMP转入表达菌后培养,经IPTG诱导后蛋白电泳分析显示,诱导菌有明显蛋白表达,与预期条带大小一致,未诱导对照组未见目的条带,见图2A。超声处理并纯化后的重组蛋白,见图2B,蛋白纯度检测约为90%。纯化得到的双荧光标记底物蛋白命名为CYVAMP。
2.3ALc、BLc和TLc分别对CYVAMP进行活性鉴定分析ALc、BLc和TLc对CYVAMP酶切鉴定,经SDS-PAGE分析结果显示:CYVAMP能被BLc和TLc分别酶解后产生与预期相符的两条蛋白片段,而CYVAMP不能被ALc酶解,见图3、4。
2.4基于荧光标记底物的内肽酶分析法检测指标的确定动态检测CFP、YFP和CYVAMP在528的荧光发射值与485的荧光发射值作图结果表明:3个蛋白的528 nm和485 nm荧光值均随检测的时间进程而逐渐减少,故单独的某一荧光值作为检测指标无意义价值。但对比有无Lc酶作用于浓度为一定浓度(500 nmol/L ) CYVAMP时,将动态收集的528 nm的荧光值与485 nm的荧光值进行相比(即528/485)变化与时间作图得出,只测CYVAMP其荧光值的比(528/485)在均值0.75上下波动,比值较为稳定,见图5A。加入Lc酶组荧光值比(528/485)随着酶切而逐渐减小。将相同条件下处理的样品分别SDS-PAGE电泳分析作图和动态检测荧光值比(528/485)标准化为底物量减少作图,再利用线性回归的最小二乘法对数据进行分析,拟合得到两者呈线性相关(R2=0.96)。
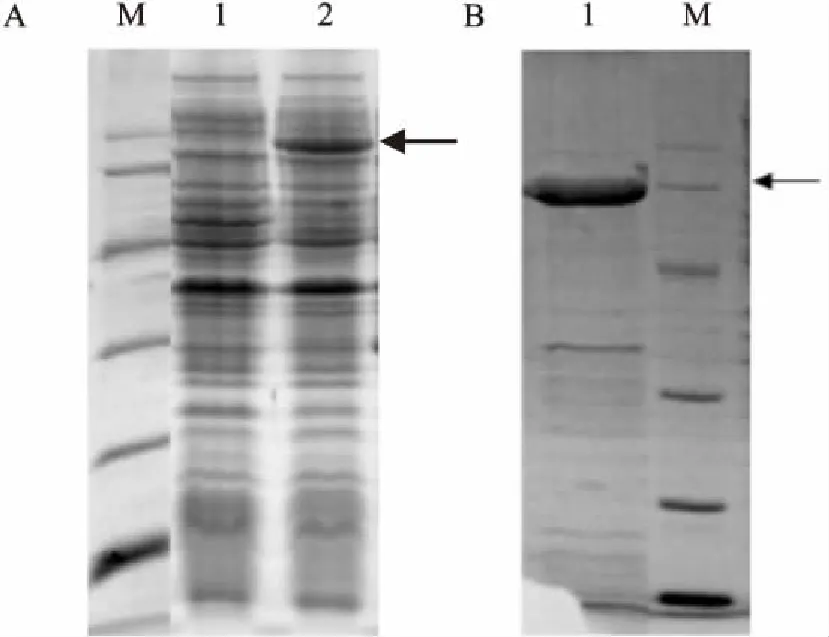
图2 CYVAMP表达及纯化SDS-PAGE分析
A.:CYVAMP表达结果图;1:未诱导全菌蛋白上清液;2:诱导全菌蛋白上清液;箭头标记为目的蛋白CYVAMP条带;B:CYVAMP纯化后结果图;1:纯化后的CYVAMP结果;M:蛋白质相对分子质量标准;箭头标记为目的蛋白条带

图3 SDS-PAGE分析TLc或ALc与CYVAMP蛋白的反应结果
1:CYVAMP;2、3:CYVAMP+1 nmol/L TLc;4、5:CYVAMP+1 nmol/L ALc;M:Marker

图4 SDS-PAGE分析ALc或BLc与CYVAMP蛋白的反应结果
1:CYVAMP未处理对照;2:加入ALc;3、4:加入1 nmol/L BLc;5、6: 加入2 nmol/L BLc;7、8:加入10 nmol/L BLc;CYVAMP箭头标示为完整CYVAMP蛋白;M:Marker

图5 对基于双荧光标记底物的内肽酶分析法CYVAMP检测的底物浓度和BLc浓度的条件优化结果图
A:通过对系列浓度(32、16、8、4、2、1、0.5、0.25、0.125、0.062 5 μmol/L)的CYB在滤光片灵敏度65时发射波长比率(528/485)与检测时间作图;B:通过检测(1、2、4 nmol/L)浓度的BLc酶切32 μmol/L CYB时发射波长比率(528/485)与检测时间作图; C:通过检测(1、2、4 nmol/L)浓度的BLc酶切8 μmol/L CYB时发射波长比率(528/485)与检测时间作图; D:通过检测(1、2、4 nmol/L)浓度的BLc酶切1 μmol/L CYB时发射波长比率(528/485)与检测时间作图; E:通过检测(1、2、4 nmol/L)浓度的BLc酶切125 nmol/L CYB时发射波长比率(528/485)与检测时间作图; F:通过检测(1、2、4 nmol/L)浓度的BLc酶切62.5 nmol/L CYB时发射波长比率(528/485)与检测时间作图
2.5基于荧光标价底物分析方法的条件优化结果通过对倍梯度浓度的CYVAMP在滤光片的灵敏度设置为75时,实时检测荧光值比(528/485)与检测时间作图,见图5A,检测结果显示,CYVAMP浓度不能过低,过低(低于125 nmol/L时)则荧光值比(528/485)随时间检测变化波动较大。实时测定系列浓度(32~0.062 5 μmol/L)的CYVAMP 在(梯度浓度1、2、4 nmol/L) BLc作用下,荧光值比 (528/485)与检测时间作图,分别见图5 B~F。以上作图分析显示CYVAMP在高浓度(约32 μmol/L)时虽然528/485比值较稳定,但是在梯度浓度的BLc酶切后得不出明显的量效关系,导致检测分析不敏感。CYVAMP浓度在低于125 nmol/L时本身荧光值比(528/485)波动较大,加之BLc酶切底物过快而来不及测定准确的定量数据。
对分析方法底物浓度和酶浓度的条件优化后结果得到CYVAMP较适宜的范围为0.2~32 μmol/L之间。当CYVAMP底物浓度为300 nmol/L时, BLc在纳摩尔浓度水平与荧光值比 (528/485)斜率随时间变化呈现出量效关系,动态检测得到BLc在0~10 nmol/L系列浓度梯度,与荧光值比 (528/485) 曲线斜率之间呈正比关系,见图6(图中C2-比率、C3-比率、C4-比率、C5-比率、C6-比率、C7-比率分别对应为0 nmol/L BLc、1 nmol/L BLc、2 nmol/L BLc、4 nmol/L BLc、8 nmol/L BLc、10 nmol/L BLc)。类似地对其他参数进行优化得到:酶联仪滤光片灵敏度设定的较合适的设置范围在65~110之间;(对于96孔板)动态实时检测间隔时间2 min较为合适;检测持续时间从30 min到120 min较合适;CYVAMP在内肽酶BLc作用下荧光值比(528/485)随时时间变化作图最大时在1.5左右,最小在0.5左右。针对TLc检测结果大致相同。
2.6酶活动力学常数测定结果测定酶活动力学参数得到:BLc 切割底物CYVAMP的值Kcat值为(4.16±0.28) s-1和Km为(17.6±2.6) μmol/L;类似地得到TLc 切割底物CYVAMP的Km和Kcat值分别为(40.8±3.5) μmol/L和(2.65±0.32) s-1。
3 讨论
由于破伤风毒素和肉毒毒素都是剧毒物质,对其操作面临潜在的健康危害甚至生命危险[6],且无法有效地使重链和轻链分离。基于以上原因,且能够安全经济和高效快速制备获得毒素轻链,本研究利用基因重组表达获得的轻链以代替全毒素用于体外筛选模型。
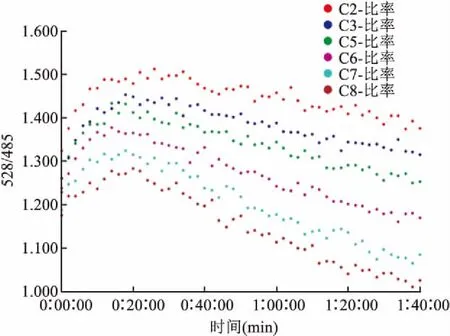
图6 BLc梯度浓度与CYVAMP在浓度为300 nmol/L时动态斜率的关系
破伤风毒素和肉毒毒素的拮抗剂的研究开发一直未取得实质性的进展[7],其中很重要的原因是缺乏高通量的检测模型限制了研发进程。传统经典的动物模型对于大批量的样品的筛选来说显然不现实,曾有国外学者基于短肽底物构建HPLC[8]和MS[9]等筛选方法,但由于缺乏敏感性,或需要很多步骤才能完成分析检测,或需要依赖昂贵的仪器设备等原因[10]限制了新型药物的筛选和研究进程。本研究设计构建并通过成熟的大肠杆菌表达系统制备双荧光标记底物和毒素轻链,该制备方法简单方便且产率高,很容易就获得所需关键试剂。该筛选方法的优势体现在不需要牺牲大量的动物,能够提供实时动态检测,不需要复杂的设备(如其他一些筛选方法需要MS或HPLC平台),甚至对于分析人员来说都不需要严格的训练就能够完成筛选。该体外筛选技术还具有微量、快速、灵敏、省时又经济的特点,可以短时间内对多个样品进行测试筛选。对同一样品可以在破伤风和B型肉毒毒素上同时筛选,将加快新药发现的进程。本课题组已初步用该模型筛选对一系列化合物针对破伤风毒素和B型肉毒毒素[11]进行筛选。该方法也可应用于检测大批量食品是否含有B型肉毒毒素污染。可以快速方便地对制备的破伤风毒素制剂[12]和B型肉毒毒素制剂[13-14]的活性评估。同时,也为其他将以双荧光标记底物构建体外高通量筛选模型的研究作为很好的参考[10]。

