剥夺小鼠睡眠后促觉醒中枢TMN内小胶质细胞在睡眠-觉醒中的变化
洪 艳,施 伍,梁 悦,李晓凤,王 媛,许 奇,伍龙军,王烈成
长期以来,人们对于中枢睡眠和觉醒系统的研究,主要集中在众多的神经核团及其递质上。这些核团和递质彼此间形成相互作用、相互制约的神经网络。目前认为,下丘脑腹外侧视前区(ventrolateral preopticnucleus nucleus,VLPO)与结节乳头体核(tuberomammillary nucleus,TMN)分别是重要的促睡眠和促觉醒的调节中枢[1-2]。随着研究的深入,小胶质细胞作为中枢神经系统中重要的免疫功能细胞,其在中枢神经系统新的功能作用不断地被发现。小胶质细胞是否也在睡眠-觉醒调控中起作用却很少报道。睡眠剥夺常被作为研究睡眠-觉醒机制的一种重要研究方法[3]。该研究采用睡眠剥夺方式,使用已被证明可以抑制小胶质细胞活化的四环素类抗生素药物-米诺环素[4],探讨小胶质细胞在睡眠-觉醒稳态调节中的作用。
1 材料与方法
1.1材料
1.1.1实验动物和分组SPF级雄性8周龄C57BL/6小鼠共50只,25~28 g。均由北京维通利华提供,按不同组别将实验小鼠置于动物房的独立通风笼盒内饲养,光照8:00~20:00,温度适宜,能够自由摄食饮水。实验一:为了观察米诺环素对正常睡眠小鼠是否有影响,将小鼠分为生理盐水自然睡眠组(NS-TODS 组)和米诺环素自然睡眠组(mino-TODS组),即在正式实验的第1~7天,早上8:00分别给两组小鼠腹腔注射生理盐水和米诺环素75 mg/kg。为了观察米诺环素对睡眠剥夺小鼠是否有影响,将小鼠分为NS-TODS 组、睡眠剥夺生理盐水组(NS-SD组)和睡眠剥夺米诺环素组(mino-SD组)。NS-TODS 组仅注射生理盐水,不做其它特殊处理,另外两组是在分别连续注射生理盐水和米诺环素第7天后剥夺睡眠后行多导睡眠描记。实验二:为了观察小鼠在TMN脑区小胶质细胞荧光表达情况,同样实验条件下,连续腹腔注射生理盐水和米诺环素7 d以后,NS-SD组和mino-SD组行睡眠剥夺,NS-TODS 组仅注射生理盐水自然睡眠5 h后,3组小鼠麻醉后行多聚甲醛灌流。
1.1.2仪器68030型小鼠脑立体定位适配器、高速颅骨钻(深圳市瑞沃德生命科技有限公司);MP150多导生理信号记录分析系统(美国Biopac公司);Sleepsign睡眠分析软件(日本KisseiComte株式会社);免疫荧光相关试剂(日本TaKaRa公司);电极用银丝(美国CoonerWire公司);造牙粉、义齿基托树脂(上海二医张江生物材料有限公司);记录排线(东莞市耀博电子有限公司);莱卡冰冻切片机DM1860、莱卡DM2500 荧光显微镜(德国莱卡公司)。
1.1.3试剂戊巴比妥钠(上海化学试剂采购供应站分装厂进口分装)用蒸馏水配成0.04 g/L溶液;米诺环素(美国Sigma公司);一抗:iba-1 兔源(日本Wako公司);二抗:Alexa488 驴抗兔(美国Invitrogen 公司),驴血清,冰冻切片包埋剂,防猝灭封片剂。
1.2方法
1.2.1动物手术小鼠经戊巴比妥行腹腔麻醉后固定于小鼠脑立体定位适配器上,将小鼠头顶毛剪去,酒精消毒皮肤并剪开,血管夹夹紧切口两侧皮肤,分离皮下组织,用生理盐水洗净后使颅骨完全暴露,分别位于前囟前1.0 mm、旁开1.5 mm和后囟前1.0 mm、旁开1.5 mm处用颅骨钻钻通颅骨,但不弄破硬脑膜,将脑电电极埋入,两根肌电电极分别插入两侧的颈部肌肉内。用牙科水泥将电极固定于颅骨上,腹腔注射青霉素,缝合伤口,将小鼠侧卧位放入屏蔽箱恢复笼内。
1.2.2多导睡眠描记方法小鼠手术后放入恢复笼内恢复7 d,第8天将小鼠头部电极通过所焊的记录排线与多通道万向轮连接,适应3 d后,正式记录。屏蔽箱内光照8:00~20:00,记录从早8:00(记为ZT0)开始,用Acqknowlege4.2软件记录小鼠的脑电肌电活动,记录过程中小鼠能够自由饮食和摄水,活动不受限制。每次描记均从8:00开始,连续记录24 h。
1.2.3睡眠状态数据统计标准脑电数据以4 s为时间段分析,将睡眠觉醒周期分为觉醒(wakefulness,W),以低幅快波脑电和明显肌电活动为特征;非快动眼睡眠(non-rapid eye movement,NREM),以高幅慢波脑电和肌电活动明显减少为特征;快动眼睡眠(rapid eye movement,REM),以低幅慢波脑电和肌电安静为特征;总睡眠时间(total sleep time,TST)是 REM 睡眠和 NREM 睡眠时间之和。
1.2.4睡眠剥夺方法睡眠剥夺时将小鼠置于有机玻璃圆桶(直径22 cm,高38 cm),从8:00 ~ 13:00 (ZT 0~5)对小鼠每隔15 s 用毛刷轻轻触碰小鼠臀部,小鼠被强迫保持清醒状态,以此达到睡眠剥夺的目的。此方法对小鼠的应激水平较低,可以完全剥夺NREM睡眠和REM睡眠,较容易观察小鼠睡眠剥夺后的反应,所以本实验采用的是触碰法[3]。
1.2.5冰冻脑组织制备小鼠麻醉后,经左心室插管行心内灌注固定。由胸骨剑突入刀,剪开胸腔充分暴露心脏包膜,用眼科剪刀剪开心包膜暴露整个心脏,止血钳夹闭下腔静脉,然后左心室插入输液器针头,迅速剪开右心耳。灌注分为两部分:先快速灌注4 ℃生理盐水,至流出液体变清;随即灌注固定液4%的多聚甲醛(用PBS缓冲液配制)。灌注速度先快后慢,约20~30 min灌完。待僵硬后取出组织(较为完整的小鼠脑),灌流完成。将取出的脑组织置于4%多聚甲醛(PBS缓冲液配制)中固定24 h,然后分别置于含10%、20%和30%蔗糖的PBS中脱水,待组织沉底后方可进行冰冻切片。
1.2.6冰冻切片将用包埋剂包埋的脑组织迅速冰冻后进行脑切片。切片的厚度为30 μm,对照小鼠脑立体定位图谱(第二版,George Paxinos, Keith B J Frallklin),选取小鼠含有TMN脑区(图1A),视交叉上核(suprachiasmatic nucleus,SCN)脑区的脑片放置于4 ℃冰箱保存(图1B)。
图1 对照图谱选择TMN、SCN脑片示意图
1.2.7TMN和SCN中小胶质细胞免疫荧光检测将含有TMN和SCN脑切分别用0.01 mol/L PBS清洗和0.3% TritonX-100通透处理后,再分别用一抗和二抗孵育。一抗为iba-1,小胶质细胞/巨噬细胞特异性蛋白抗体;二抗为Alexa fluor488,绿色荧光标志物。
1.2.8定量分析小胶质细胞直径和光密度高倍镜视野(×40倍镜) 下分别采集3个 SCN和TMN 区域图像,使用 ImageJ-win32/fiji分析软件处理图像,用平均荧光密度(area of interest,AOI)值、细胞平均直径、细胞个数反映各脑区蛋白表达水平。
2 结果
2.1米诺环素对自然睡眠小鼠睡眠-觉醒的影响自然睡眠状态下小鼠分别腹腔注射生理盐水和米诺环素7 d ,采用自由活动脑电24 h连续监测,结果显示NS-TODS组和mino-TODS组的觉醒、REM睡眠以及NREM睡眠呈昼夜节律变化,两者之间差异无统计学意义(图2)。
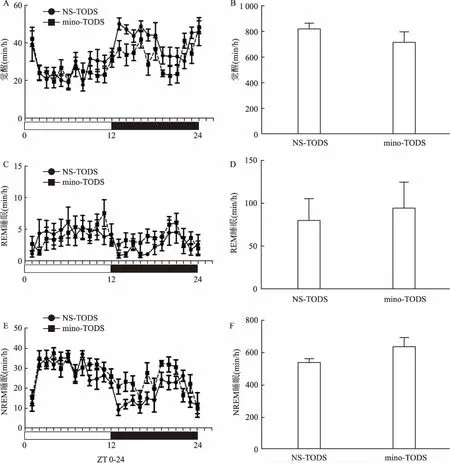
图2 NS-TODS组和 mino-TODS组小鼠的24 h睡眠-觉醒统计图
A:两组小鼠觉醒量分布图;B:两组小鼠24 h总觉醒量统计图;C:两组小鼠REM 睡眠量分布图; D:两组小鼠24 h总REM睡眠时间统计图; E:两组小鼠NREM睡眠量分布图; F:两组小鼠24 h总NREM睡眠时间统计图
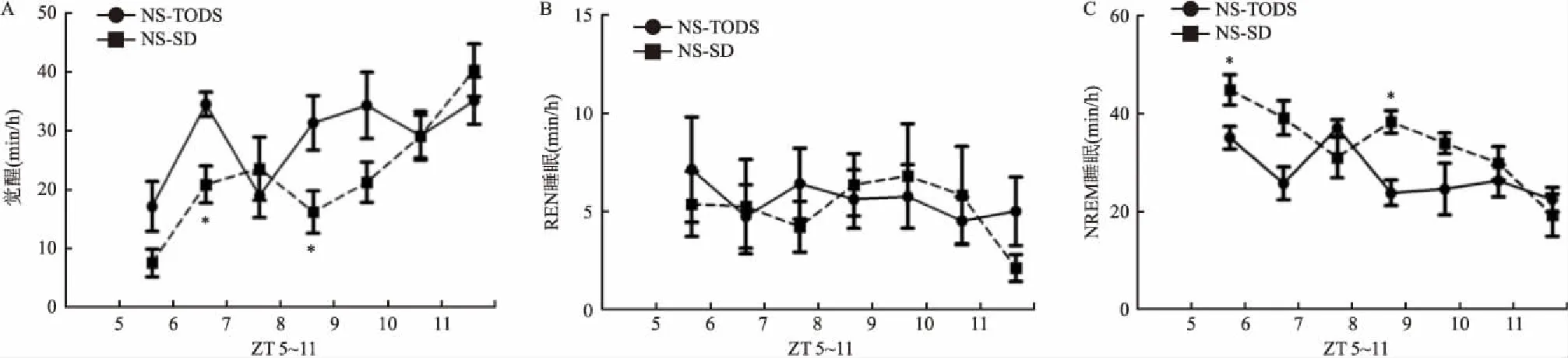
图3 睡眠剥夺5 h后NS-TODS组和NS-SD组小鼠的觉醒、REM睡眠和NREM睡眠时间的变化
A:两组小鼠ZT 5~11觉醒量分布图;B:两组小鼠ZT 5~11 REM睡眠量分布图;C:两组小鼠ZT 5~11 NREM睡眠量分布图;与NS-TODS组比较:*P<0.05

图4 睡眠剥夺5 h后NS-SD组和mino-SD 组小鼠的觉醒-睡眠量统计
A:两组小鼠ZT 5~11觉醒量分布统计图;B:两组小鼠ZT 5~6觉醒量统计图;C:两组小鼠ZT 5~11睡眠量分布统计图;D:两组小鼠ZT 5~6睡眠量统计图;与NS-SD组比较:*P<0.05
2.2睡眠剥夺后对小鼠睡眠-觉醒的影响在腹腔连续注射生理盐水第7天后剥夺小鼠睡眠5 h,然后开始记录7 h的小鼠脑电(ZT 5~11)。结果显示,与NS-TODS组相比,NS-SD组小鼠觉醒量有所减少,NREM睡眠量有所增加,差异有统计学意义(图3)。
2.3腹腔注射米诺环素对睡眠剥夺小鼠睡眠-觉醒的影响同样,在腹腔连续注射米诺环素第7天后剥夺小鼠睡眠5 h,然后进行多导睡眠记录。与NS-SD组(13.30±2.378)相比,mino-SD组在ZT 5~6的时间段内,其觉醒总量(23.10±1.768)有显著性增加(P<0.05)。而在ZT 6~11时段内,没有显著性变化(图4 A、B)。对睡眠总量进行统计,结果显示mino-SD组在ZT 5~6时间段内,其TST睡眠总量(41.87±4.616)较NS-SD组(31.60±2.298)有明显减少,差异有统计学意义(P<0.05),而ZT6~11时间段内,没有显著性变化(图4 C、D)。
2.4睡眠剥夺后小鼠TMN和SCN脑区小胶质细胞的活力变化
2.4.1睡眠剥夺后小鼠TMN脑区小胶质细胞的活力变化经过7 d腹腔注射米诺环素和生理盐水,NS-TODS组小鼠自然睡眠5 h, NS-SD组、 mino-SD组小鼠睡眠剥夺5 h后即给予小鼠麻醉,制备冰冻切片。通过iba-1免疫荧光染色后,高倍荧光镜下观察,可见TMN区域小胶质细胞呈现绿色,细胞容易辨认,结构清晰,突起分明(图5 A-C)。NS-SD组小胶质细胞较NS-TODS组胞体更大,分支数目多,分支长度更长,荧光强度更亮。与mino-SD组相比,mino-SD组小胶质细胞明显细胞胞体变小,分支数目减少,长度变短。再将3组TMN区域的小胶质细胞的直径、荧光强度和数量进行统计,与NS-TODS组相比,NS-SD组小胶质细胞直径较大(t=3.747,P<0.01),荧光强度较强(t=2.326,P<0.05),而mino-SD组小胶质细胞和NS-SD组相比,有变小的趋势,但差异无统计学意义。见图4 D-F。
2.4.2米诺环素对睡眠剥夺小鼠SCN脑区小胶质细胞活力的影响同条件下NS-TODS组、NS-SD组和mino-SD组小鼠冰冻切片通过iba-1免疫荧光染色后,高倍荧光镜下观察,可见SCN区域小胶质细胞呈现绿色,细胞容易辨认,结构清晰,突起分明(图6 A-C),从细胞胞体、细胞分枝数目、长度、荧光亮度对比,并未见明显差别,将3组SCN区域的小胶质细胞的直径、荧光强度和数量进行统计,3组差异无统计学意义(P>0.05)。见图6 D-F。
3 讨论
已有研究[5]显示免疫系统对睡眠是有一定的影响,但此影响是否与脑中的先天的免疫细胞-小胶质细胞有关还是未知的。小胶质细胞是中枢神经系统的常驻吞噬细胞,通过持续监测周围的微环境,感知神经元活动,在细胞受伤和死亡后清除神经元碎片,促进健康大脑发育性突触的修剪[6]。任何对脑内稳态的干扰,包括炎症,都会激活小胶质细胞,急性和慢性睡眠剥夺可导致无明显感染或损伤的促炎状态[7]。文献报道,在人类和啮齿类动物中,睡眠缺失会导致白细胞计数升高,c-fos蛋白,IL-1,IL-6,TNF的增加[8],血脑屏障增强通透性增加等[9]。小胶质细胞特异性抑制剂,米诺环素,已被证明可以通过血脑屏障,抑制细胞因子、一氧化氮和前列腺素等产物的产生,减弱大脑由于这些产物造成的神经化学变化[10]。因此,本实验采用腹腔注射米诺环素的方法抑制小胶质细胞的活性来检测小胶质细胞在睡眠觉醒调控中的作用。实验结果提示该抑制剂对正常睡眠小鼠的睡眠结构没有明显的影响。
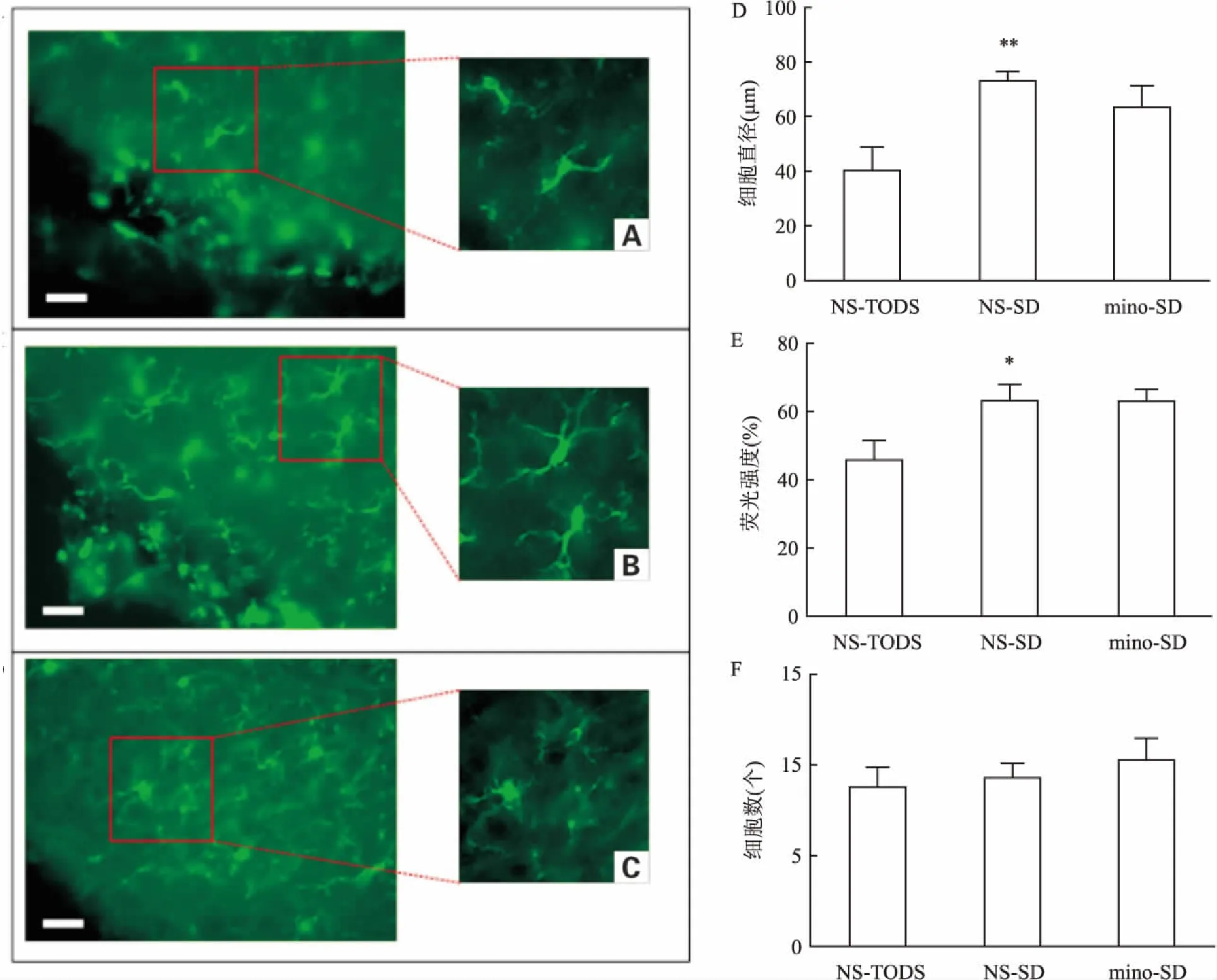
图5 NS-TODS组、NS-SD组和mino-SD组小鼠TMN区域小胶质细胞的荧光表达情况
A:NS-TODS组小鼠TMN区域的荧光图;B:NS-SD组小鼠TMN区域的荧光图;C:mino- SD组小鼠TMN区域的荧光图;D:3组TMN区域小胶质细胞直径统计图;E:3组TMN区域小胶质细胞荧光强度统计图;F:3组TMN区域小胶质细胞数量统计图;与NS-TODS组比较:*P<0.05,**P<0.01
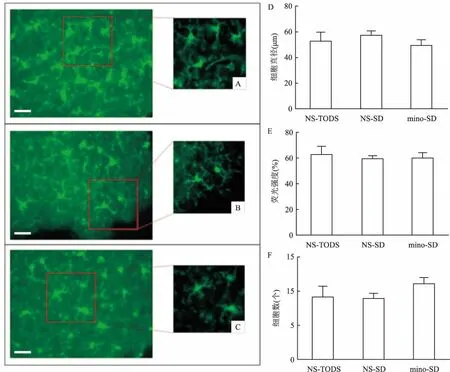
图6 NS-TODS组、NS-SD组和mino-SD组小鼠SCN区域小胶质细胞的荧光表达情况
A:NS-TODS组小鼠SCN区域的荧光图;B:NS -SD组小鼠SCN区域的荧光图;C: mino-SD组小鼠SCN区域的荧光图;D:3组SCN区域小胶质细胞直径统计图;E:3组SCN区域小胶质细胞荧光强度统计图;F:3组SCN区域小胶质细胞数量统计图
实验的第7天给予睡眠剥夺后,与注射盐水组相比,注射米诺环素组早期出现觉醒的急性增加,可以推断早期米诺环素抑制了小胶质细胞的活化,从而减少由于小胶质细胞活化导致的炎症反应,觉醒增多,睡眠减少。Iba-1是小胶质细胞/巨噬细胞特异性蛋白抗体,通过观察Iba-1的表达,反应小胶质细胞形态和不同状态下的的活力[11],睡眠剥夺与自然睡眠组相比较,在TMN,促觉醒脑区,小胶质细胞的平均直径增大、亮度增强,提示此脑区中的小胶质细胞活跃程度增加。由此推测睡眠剥夺阶段,由于觉醒脑区的持续激活,代谢产物,如细胞因子、一氧化氮和前列腺素等不断堆积,导致觉醒区域的小胶质细胞增大,变亮,作为免疫吞噬细胞来清除这些产物,以保护觉醒神经元的过度激活。同时实验结果还显示,应用小胶质细胞抑制剂米诺环素组的小鼠睡眠剥夺后小胶质细胞变小,亮度有变暗的趋势,但差异无统计学意义。可以进一步推断米诺环素减弱了小胶质细胞的活化作用,在促觉醒脑区TMN区,小胶质细胞对觉醒-睡眠的调节起了一定的作用。
同时本实验还观察了和觉醒无关的脑区,反应昼夜节律的脑区-视交叉上核(SCN)中小胶质细胞的标志物iba-1的表达情况,统计结果显示SCN区域小胶质细胞的直径、荧光强度和数量在3组实验动物未见明显差异。说明在小胶质细胞在此区域在此实验条件下并未对昼夜节律的调节发生明显改变。
通过此实验推测,小胶质细胞在过度激活状态下对睡眠-觉醒的稳态有调控作用,米诺环素抑制小胶质细胞活性,维持觉醒,延迟觉醒向睡眠推进的时间。
参考文献

