热休克蛋白90在胃癌患者外周血中的表达及其临床意义
, , ,
(1.雅安市人民医院肿瘤科,四川 雅安 625000;2.雅安市人民医院消化内科)
胃癌是全世界最常见的恶性肿瘤之一,其发病率和死亡率排名均位于前列,不仅增加了家庭经济和国家医疗资源负担,更给患者身心造成了严重创伤,严重威胁着无数人的生命[1]。胃癌死亡率非常高,主要原因在于胃癌临床表现比较滞后,一般出现临床特征时已达到中晚期,并且内镜检查、活检等胃癌诊断方法也很难真正做到普及,这都导致胃癌很难能够被及时发现,极大耽误了胃癌患者最佳治疗时间[2]。大量临床实践证明,血清标志物不仅能够有助于早期发现肿瘤,而且还与浸润、转移等恶性肿瘤生物学行为相关,能够对预后情况进行评价[3]。因此,本文旨在探讨血清热休克蛋白90(heat shock protein 90, HSP90)对胃癌诊断的价值,并分析其与肿瘤直径、临床分期、浸润深度、组织分化程度、淋巴结转移相关等临床病理特征的相关性,评估其对肿瘤生物学行为的评价意义。
1 资料与方法
1.1研究对象选取2014年1月至2017年1月期间我院收治的70例胃癌患者(胃癌组)和70名健康志愿者(对照组)作为研究对象,所有患者均经病理学检查确诊为胃癌。胃癌组男性43例,女性27例,中位数年龄61岁(29~76岁);对照组男性45例,女性25例,中位数年龄59岁(27~78岁),两组性别比和年龄均无统计学差异(P>0.05)。本研究已获得所有胃癌患者和志愿者的知情同意。
1.2方法
1.2.1 血样采集与检测 所有研究对象均于清晨空腹抽取静脉血,低温高速离心机4 ℃低温离心,取上层血清保存于-80 ℃冰箱中备用。采用双抗体夹心酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)检测血清中HSP90含量,试剂盒由武汉伊莱瑞特生物科技股份有限公司提供,严格按照试剂盒进行检测,大致操作步骤如下:将血清样本从冰箱拿出后平衡至室温,酶标板各孔对应加入血清或标准品,恒温孵育箱中37 ℃避光孵育1.5 h,倾去液体后加入生物素化抗体工作液,再次孵育1 h,洗涤后甩板,加入酶结合物工作液,继续孵育0.5 h,再次洗涤后加入底物溶液,待标准品出现明显梯度后加入终止液,测定吸光度并计算HSP90含量。
1.2.2 统计学处理 采用SPSS19.0软件进行统计,所有数据以中位数及四分位数M (P25~P75 )表示,HSP90的胃癌诊断价值通过采用受试者工作特征(receiver operating characteristic, ROC)曲线进行评价,并记录约登指数(Youden index,两组间比较采用Mann-Whitney U检验,多组间比较采用Kruskal-Wallis检验,P<0.05代表有统计学差异。
2 结 果
2.1各组血清热休克蛋白90含量的比较
与对照组比较,胃癌组血清中HSP90含量显著升高,中位数为对照组的1.75倍,差异有统计学意义(P<0.01),结果见表1。
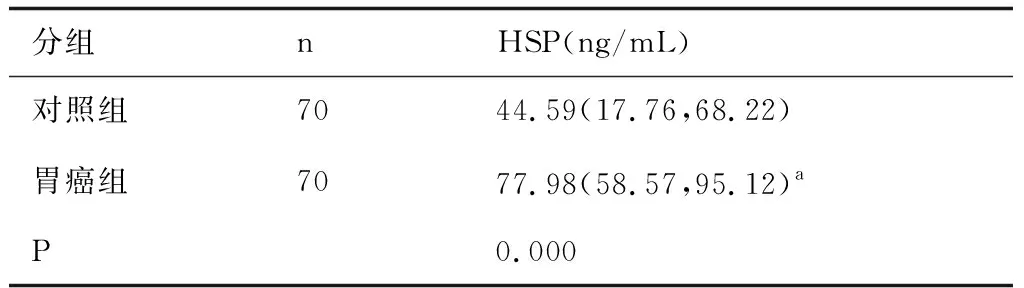
表1 各组血清热休克蛋白90含量的比较[M(P25~P75)]
2.2血清热休克蛋白90对胃癌的诊断价值分析本研究采用ROC曲线评价血清HSP90对胃癌的临床诊断价值,结果表明,血清HSP90诊断胃癌的ROC曲线下面积为0.754,95%置信区间为(0.673,0.835),以约登指数作为准确度评价指标,当约登指数取最大值0.429时,灵敏度和特异性分别为80.00%和62.86%,ROC曲线见图1。
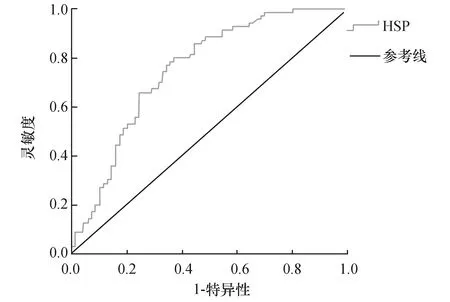
图1 血清HSP90诊断胃癌的ROC曲线分析
2.3血清热休克蛋白90表达与胃癌临床病理特征的相关性分析本研究分析结果表明,胃癌患者血清HSP90在不同性别、年龄、肿瘤直径、临床分期、浸润深度、组织分化程度、淋巴结转移等分组中均无显著性差异(P>0.05),结果见表2。

表2 血清HSP90表达与胃癌临床病理特征的相关性分析
3 讨 论
HSP90是指机体在应激原的刺激下,细胞内快速合成的一类蛋白质,广泛存在于原核生物和真核生物中,有研究结果显示HSP90在肿瘤细胞中表达显著高于正常细胞的2~10倍[4]。在正常情况下,HSP90表达相对较低,但当细胞处于应激状态时HSP90表达会升高数倍[5]。HSP90具有高度保守性,属于ATP依赖型的分子伴侣,是细胞内活跃程度最高的分子伴侣之一,介导蛋白质折叠、装配和转运等过程,对于维持蛋白质构象和活性、调控蛋白降解等过程有着重要意义[6]。HSP90作为细胞内重要的调节蛋白,是众多细胞信号通路的关键组成蛋白,广泛参与细胞增殖、机体发育、免疫调控等生理过程,对于维持机体正常运转意义重大[7]。
随着研究的不断深入,研究发现HSP90与肿瘤细胞凋亡、肿瘤免疫、肿瘤发生发展密切相关,HSP90主要负责调节肿瘤细胞所需周期蛋白、激酶等蛋白的活性,介导相关癌蛋白构象成熟、转运和转化等过程[8]。Tas等[9]研究表明,黑色素瘤患者血清HSP90含量显著高于健康人群,具有一定的临床诊断价值,但HSP90表达与患者年龄、性别、病变部位、组织学分级、淋巴结转移、临床分级以及化疗效应均无显著相关性。Sun等[10]在肝细胞癌血清标志物筛选中发现,相对于正常人群,肝细胞癌患者血清HSP90含量异常升高超过6倍,该结果提示血清HSP90很可能成为肝细胞癌诊断的血清学指标。Wang等[11]对322份胃癌组织样本进行研究发现,胃癌组织中HSP90阳性率为69.6%, HSP90表达与浸润深度、淋巴结转移、临床分级等显著相关,并且可作为无复发生存期和总生存期的独立预后因素,表明肿瘤组织HSP90对于胃癌诊断、化疗效果评估、预后判断等具有参考价值。综上所述,血清HSP90可能对于胃癌诊断、肿瘤恶性生物学行为评价等具有重要临床参考价值,并且可行性较高。
本研究结果表明,胃癌患者血清HSP90含量显著高于健康人群。ROC曲线分析结果显示,血清HSP90区别健康人群和胃癌患者的曲线下面积0.754,表明血清HSP90具有中等胃癌诊断价值。准确度评价指标约登指数最大值为0.429,此时对应的灵敏度和特异性分别为80.00%和62.86%,表明血清HSP90用于诊断胃癌具有较高的灵敏度,不易发生漏诊的情况,但特异性较低,易导致误诊的发生,因此,在实际临床工作中,应根据具体情况对诊断结果进行分析。本研究还对血清HSP90表达与性别、年龄、肿瘤直径、临床分期、浸润深度、组织分化程度、淋巴结转移等的关系进行了分析,结果表明血清HSP90与临床分级、淋巴结转移等恶性生物学行为无显著相关性,对于评价胃癌患者肿瘤生物学行为无重要价值。HSP90具有提高细胞生存能力,维持蛋白稳定性功能,在胃癌的发育、生长、分化及基因转录过程中均起到十分重要的作用[12]。在各种应急因素刺激下,HSP基因可被异常激活,HSP蛋白表达量增加,有效激活细胞自我防御功能,维持细胞稳定,避免细胞调查,且可有效保护胃癌细胞面授凋亡因素刺激,进而促进胃癌的发生及发展[13]。
综述所述,血清HSP90表达与胃癌诊断关系较大,但与临床病理特征、胃癌患者化疗效果评价、预后判断等的相关性不大,有待进一步探讨。
参考文献:
[1] 黄世明,罗燕薇,尹亮, 等. F-FDG PET/CT与CT诊断胃癌淋巴结转移直接比较的系统评价[J]. 标记免疫分析与临床,2017,24(4):384-9.
[2] 郎丰平,赵毓毅,范鹏. 甲磺酸阿帕替尼治疗晚期胃癌的疗效及安全性分析[J]. 实用癌症杂志, 2017, 32(6):996-8.
[3] 付生弟,谢辉. 肿瘤标志物CEA、CA19-9、CA72-4及CA242在胃癌诊断及预后判断中的应用价值[J]. 标记免疫分析与临床,2016, 23(4):428-30;50.
[4] 李艳光, 曹富民. HSP90的功能及HSP90抑制剂的研究进展[J]. 食管外科电子杂志, 2013,1(4):168-72.
[5] 陈明帅,徐超,宋兴超, 等. 热休克蛋白的研究进展[J]. 经济动物学报,2016, 20(1):44-53.
[6] HASSANPOUR H, BIGHAM AS, Karimi I, et al. Comparative analysis of HSP70, HSP90, IL-4, TNF, KITLG and KIT-receptor gene between varicocele-induced and non-varicocele testes of dog[J]. Int J Fertil Steril, 2017, 11(3): 148-55.
[7] OH YJ, SEO YH. A novel chalcone-based molecule, BDP inhibits MDA MB 231 triple-negative breast cancer cell growth by suppressing Hsp90 function[J]. Oncol Rep, 2017, 38(4):2343-50.
[8] BAR JK, LIS-NAWARA A, Grelewski P, et al. The association between HSP90/topoisomerase I immunophenotype and the clinical features of colorectal cancers in respect to KRAS gene status [J]. Anticancer Res, 2017, 37(9):4953-60.
[9] TAS F, BILGIN E, ERTURK K, et al. Clinical significance of circulating serum cellular heat shock protein 90 (HSP90) level in patients with cutaneous malignant melanoma [J]. Asian Pac J Cancer Prev, 2017, 18(3):599-601.
[10] SUN Y, ZANG Z, XU X, et al. Differential proteomics identification of HSP90 as potential serum biomarker in hepatocellular carcinoma by two-dimensional electrophoresis and mass spectrometry[J].Int J Mol Sci, 2010, 11(4):1423-33.
[11] WANG J,CUI S,ZHANG X,et al. High expression of heat shock protein 90 is associated with tumor aggressiveness and poor prognosis in patients with advanced gastric cancer[J].PLoS One, 2013, 8(4):e62876.
[12] 郭阳, 张志勇, 褚文慧,等. 热休克蛋白90β1在胃癌中的表达及意义[J]. 现代肿瘤医学, 2016, 24(10):1565-7.
[13] 朱琴琴, 费素娟. 热休克蛋白在胃癌诊疗中的价值[J]. 临床误诊误治, 2017, 30(8):109-13.

