后腹腔镜治疗肾上腺巨大肿瘤22例报告
,志军,
(南华大学附属第二医院泌尿外科,湖南 衡阳 421001)
随着腔镜技术不断成熟以及微创理念的推广,腹腔镜因其能直视下获得良好的视野的同时达到对患者创伤“最小化”的优势,近年来已逐渐取代传统开放手术,甚至成为了部分泌尿外科疾病手术治疗的“金标准”。肾上腺肿瘤因其解剖位置隐蔽,加之丰富的动静脉血供,尤其是处理直径在6 cm以上的巨大肿瘤时,腔镜手术难度往往较大。本研究回顾性收集我院我科自2010年11月至2015年7月共计22例巨大肾上腺肿瘤并实施经后腹腔镜巨大肾上腺肿瘤切除术的患者资料,进行如下汇报。
1 资料与方法
1.1一般资料本组22例,男12例,女10例。年龄20~65岁,平均43岁。左侧9例,右侧13例。因腰痛就诊7例;因发现腹部肿块来就诊为15例,术前均行肾上腺B超、CT平扫增强+三维重建等检查证实肾上腺肿瘤。肿瘤的大小8~14 cm,平均约11 cm。行肾上腺功能检查6例二十四小时尿香草扁桃酸(anillylmandelic acid,VMA)高于正常值,16例二十四小时尿17-羟皮质类固醇(17-hydroxy-cortico-steroid, 17-OHCS),17-酮皮质类固醇(17-keto-steroid, 17-KS),VMA均在正常范围内。影像学检查均未发现局部淋巴结转移、远处转移及肾静脉或腔静脉癌栓。
1.2手术方法采用气管插管全身麻醉后,留置导尿管,患者取健侧卧位,抬高腰桥,于腋中线髂嵴上2 cm处作一2 cm横行切口,在大弯钳指引下用食指推开腹膜返折,置入自制气囊并注入600 mL气体维持5分钟,取出气囊并留置10 mm穿刺鞘(Trocar)。再分别于腋后线12肋缘下、腋前线肋缘下置入10 mm、5 mm Trocar,同时于腋中线10肋间置入一个5 mm Trocar,作为置入辅助操作器械用。用巾钳夹闭、丝线缝合切口防止漏气和皮下气肿,充气维持压力12~14 mmHg,置入观察镜及腔内操作器并显露腹膜后间隙,先游离去除腹膜后脂肪,腹腔镜直视下用超声刀于肾脏背侧纵行切开肾周筋膜,推开肾周脂肪,沿肾脏表面及前后间隙向肾上极游离,一般可于肾上极内侧见到肿瘤,紧贴肿瘤包膜游离肿瘤,遇到较大的血管时用钛夹或结扎夹(Hem-o-lok)夹闭后离断。仔细游离肾上腺组织,处理肾上腺下极时,稍稍抬起肾上腺并下压肾上极,分离切断肾脏及肾上腺之间的结缔组织。找到肾上腺中央静脉后,近端予以两个钛夹或Hem-o-lok夹闭,远端一个钛夹夹闭后离断。游离过程中用辅助操作器械将肿瘤反方向推开游离。完全游离肿瘤后,将其装入自制标本袋中,略延长腋后线切口,将标本袋的开口拉出体外,然后在标本袋内切开肿瘤并分块取出。取出标本后,再仔细检查创面是否有活动性出血,彻底电凝止血,自腹膜后创面留置一根伤口引流管。术前怀疑为嗜铬细胞瘤的患者术前2周应用α受体阻滞剂哌唑嗪及输液扩容,术前2天视情况补充血容量,术中行中心动静脉置管监测动静脉压。术后加强循环、呼吸等监护,24~48 h内严密监测各项生命指征,防止低血压、休克或肾上腺危象的发生。
2 结 果
22名患者均顺利完成手术,2例中转开放手术。其中1例为术中发现肿瘤存在周围组织侵犯,与周围组织粘连严重,肿瘤浸润范围较大,故中转开放行肿瘤的姑息性切除术。1例为术中发现肾动静脉被肿瘤包绕,难以剥离;行腹腔镜手术者手术时间60~140 min,平均110 min,术中出血120~260 mL,平均176 mL,术后住院时间4~6 d,平均5 d。术后无继发出血、气胸等并发症。术后病检提示节细胞神经瘤(图1)12例,嗜铬细胞瘤(图2)6例,髓质脂肪瘤(图3)5例。随访6~24个月,未见肿瘤复发及穿刺通道的种植转移。
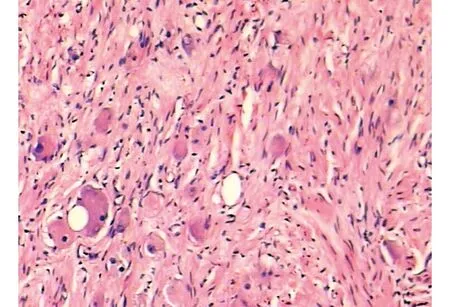
图1 节细胞神经瘤
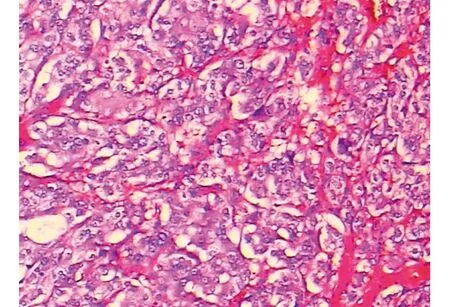
图2 嗜铬细胞瘤

图3 髓质脂肪瘤
3 讨 论
肾上腺肿瘤手术路径的选择与肿瘤本身的大小和内分泌功能特征密切相关,其中经腹途径、腹膜后途径和胸腹联合途径被广泛应用于各类肾上腺肿瘤切除中。由于肾上腺解剖位置隐蔽且较深,肾上腺肿瘤血供情况复杂,与周边组织可能存在广泛黏连,对肾上腺手术的顺利进行提出了挑战[1]。传统的开放肾上腺手术因为手术创伤大,视野显露不清,在处理肾上腺肿瘤尤其是较大的肿瘤时,往往增加了病人出血、周围器官损伤、术中意外以及术后伤口感染等风险,并延长了患者住院时间。腹腔镜直视下的肾上腺手术,通过对深部解剖的直观成像,使术者对肾上腺肿瘤及周边情况形成直观清晰地印象,增加了术者的信心和局部解剖的理解,有利于手术平稳顺利地进行。腹腔镜手术切口范围小,省去了伤口缝合带来的时间损耗,手术进行过程中,在直视术野下清晰的解剖完全能够满足手术同时确切止血的要求,随着腹腔镜操作技巧的熟练,即便是巨大肾上腺肿瘤的手术时间相比开放手术亦可大幅度缩短。
腹腔镜手术是否同样适用于直径大于6 cm肾上腺肿瘤一直是国内外专家争论的焦点。多数学者[2]认为直径<6 cm的肾上腺肿瘤更适合于腹腔镜手术,直径>6 cm的肿瘤恶性可能则明显增加,且瘤体血供丰富,与周围组织粘连明显,分离、切除难度较大,出血和副损伤的几率增大[3]。但国内外多数学者并不认为肾上腺肿瘤的大小是限制腹腔镜手术的因素[4-8]。我们亦认为肿瘤大于6 cm并非腹腔镜下切除的绝对禁忌症,完整的肿瘤包膜,与周围组织如肾动静脉、下腔静脉清晰的解剖关系等,均为仍可行后腹腔镜肿瘤切除术的重要指证。本组2例改开放手术的患者即为早期开展该项术式时未重视肿瘤的包膜及与周围血管关系所致。
本组行腹腔镜巨大肾上腺肿瘤切除者手术时间、术中出血量、术后患者恢复情况及术后住院时间等方面均明显优于传统开放手术,尤其是后期引入3D腹腔镜后,提供了更精确的空间定位和操作的准确性。对于后腹腔镜巨大肾上腺肿瘤切除术,我们体会是:①腹腔镜肾上腺肿瘤切除术可采取经腹腔或腹膜后腔途径,两者各有优缺点,选择哪种术式应该根据患者情况、肿瘤大小和位置、主刀医师的习惯与经验决定。经腹腔途径的优点是视野清晰,操作空间较大,解剖标志清楚,可对双侧病变进行探查;但缺点是存在肠道损伤、腹腔感染和术后肠麻痹等并发症的风险,一定程度影响患者术后肠道恢复。腹膜后路径虽然空间较狭小,但可直接到达手术目标区域,避开了胃肠道等腹膜内脏器的干扰,减少副损伤和对其他器官影响,且更为泌尿外科医生所熟悉,已成为主流术式[9-10],而且后腹腔镜手术的最佳适应症中就包括了肾上腺相关疾病[11],因此我们选择后腹腔进行手术。②Trocar的置入:因肿瘤较大、位置较高,腹腔镜操作钳常受肋弓影响而难以到达手术区域,我们的经验是将腋前线与腋后线的Trocar稍靠下,腋后线的Trocar向腋中线偏移。于10肋间腋中线置入第4个Trocar,使4个Trocar成菱形分布,这样就可避免操作时器械的相互干扰,第4个Trocar也可在游离肿瘤时帮助暴露解剖界面。③术中沿腰大肌从上到下剥离腹膜后脂肪,可清楚暴露肾周筋膜、腹膜反折等解剖标志,虽然肿瘤较大,瘤体周围的肾周脂肪减少,但仍尽量多清除膈肌脚至肾中上极的肾周脂肪,将同侧肾脏下压,降低了对手术视野的遮挡和腔镜操作的干扰,扩大了手术操作的空间,加快了手术进程,有利于手术顺利进行。④肿瘤的游离及肾上腺中央静脉的处理:因肿瘤较大,游离时空间相对较小,我们的经验是紧贴肿瘤游离,从潜在空间相对较大的腹侧开始游离,依次游离肿瘤的背侧、外侧,再处理血管密集的肿瘤内侧,这时肿瘤的活动度已较大,加上操作器械的辅助暴露,血管的游离及处理均较方便,不易造成血管的副损伤。应尽可能完整保留肿瘤包膜,因其内血管较丰富,肿瘤质地较脆,易出血。肾上腺中央静脉的处理是手术的关键,特别是处理右侧肿瘤时。因右侧肾上腺中央静脉直接注入下腔静脉,行程较短,处理时需谨慎。我们的经验是紧贴肿瘤处上一个钛夹,靠近下腔静脉处三重钛夹或hem-o-lok夹闭后离断。⑤切除标本的取出:因肿瘤较大,如完整取出,则需扩大腰部切口,不能真正做到切口美容的效果,且术后恢复时间较长。我们的经验是在体内将肿瘤置入一个自制不透水的标本袋中,稍为延长约2 cm切口,然后将标本袋的袋口拉出体外,在袋中将肿瘤“十”字形剖开后分次取出。这样即可不明显增加切口长度,而且也不会造成肿瘤的种植转移,最后送检所有分块的肿瘤组织,不影响病理诊断分析。⑥由于标本取出需适当延长切口,术后早期少数患者常常因切口疼痛而拒绝下床,为此缝合切口时我们在各切口注射盐酸罗哌卡因注射液局部浸润麻醉,可大大降低患者对阿片类药物或镇痛泵的需求,以利于患者尽早离床活动。
综上所述,肾上腺肿瘤直径>6 cm,只要术前检查肿瘤包膜完整,与周围血管关系清晰,可结合术者经验采取后腹腔镜技术切除,该技术具有创伤小、出血少、术后恢复快等特点,充分体现了腹腔镜手术的微创优势。
参考文献:
[1] 王养民, 郭秀全, 吕海迪, 等. 后腹腔镜下巨大肾上腺肿瘤切除术5例并文献回顾 [J]. 中国内镜杂志, 2014, 20(2): 196-9.
[2] Walz MK, Alesina PF, Wenger FA, et al. Laparoscopic and retroperitoneal paragangliomas: results of 161 tumors in 126 patients[J]. World J Surg, 2006, 30(5): 899-908.
[3] Henry JF, Sebag F, Iacobone M, et al. Results of laparoscopic adrenalectomy for large and potentially malignant tumors [J]. World J Surg, 2002, 26(8): 1043-7.
[4] Shen WT, Sturgeon C, Clark OH, et al. Should pheochromcytoma size influence surgical approach A comparison of 90 malignant and 60 benigh pheochromocytomas[J]. Surgery, 2004, 136(6): 1129-37
[5] Meria P, Kempf BF, Hermieu JF, et al. Laparoscopic management of primary hyperaldosteronism: clinical experience with 212 cases [J]. J Urol, 2003, 169(1): 32-5.
[6] 杨璐, 高亮, 陈勇吉, 等. 腹腔镜经腰腹联合途径行较大肾上腺肿瘤切除的临床研究 [J]. 四川大学学报(医学版), 2015,46(2): 336-9.
[7] 唐正严, 黄亮, 王桂林,等. 解剖性后腹腔镜巨大肾上腺肿瘤切除术的临床经验及探讨 [J]. 中国内镜杂志, 2015,21(2): 186-9.
[8] 梅红兵, 王风, 常江平,等. 后腹腔镜肾上腺肿瘤手术的临床解剖应用 [J]. 中国内镜杂志, 2010, 16(7): 748-50.
[9] Dogra PN, Gautam G, Ansari MS. Retroperitoneoscopic adrenalectomy for phaeochromocytoma in a morbidly obese patient: a case report [J]. Int Urol Nephrol, 2007, 39(1): 99-101.
[10] Vrielink OM,Wevers KP,Kist JW, et al. Laparoscopic anterior versus endoscopic posterior approach for adrenalectomy: a shift to a new golden standard? [J]. Langenbecks Arch Surg,2017, 402 (5): 767-73.
[11] 刘清波, 祖雄兵. 后腹腔镜肾上腺肿瘤切除术29例临床分析 [J]. 中国内镜杂志, 2008, 14(03): 318-9.

