新型解剖型纳米椎间融合器在腹腔镜下腰椎前路椎间盘切除椎间植骨融合术的初步临床应用
, ,,,,, , ,军*
(1.南华大学附属第一医院脊柱外科,湖南 衡阳 421001;2.南华大学附属第一医院肝胆外科)
自Zuchenman等[1]于上世纪九十年代首次报道腹腔镜下腰椎前路腰椎间盘切除椎间植骨融合术成功应用以来,至今已20余年。近年来,伴随着普腹外科腹腔镜技术的高速发展和逐渐成熟,通过腹腔镜辅助进行L5/S1节段前路腰椎间盘切除椎间植骨融合术已经得到越来越多脊柱外科医生的认可。但之前国内该术式均采用进口前路块状Cage进行植骨融合,该类Cage价格昂贵,且按照欧美人群解剖特点设计,与国人匹配性差[2],限制了该术式的进一步推广应用。为解决以上问题,本研究团队自主研发了一种可在腹腔镜辅助下进行植入的新型解剖型纳米羟基磷灰石/聚酰胺66椎间融合器,并对21例L5/S1椎间盘突出症患者采用该新型椎间融合器进行腹腔镜下腰椎前路椎间盘切除椎间植骨融合术,现将其初步临床应用情况报道如下。
1 资料与方法
1.1椎间融合器设计由本研究团队自主设计的解剖型纳米羟基磷灰石/聚酰胺66椎间融合器(图1)是具有自主知识产权的新型解剖型腰前路椎间融合器(实用新型专利,专利号:ZL201620232917.9),并已委托四川国纳科技有限公司进行专利转化及生产。该新型椎间融合器有以下几点创新设计:(1)其主体材料采用纳米羟基磷灰石/聚酰胺66复合材料,该材料具有良好的生物相容性、生物活性及骨诱导性能;(2)外形设计上则采用横截面呈肾形的空心柱状体作为主体,共有4个型号,其长度分别为34、36、38、40 mm,宽度分别为16、17、18、19 mm,高度分别为10、12、14、15 mm,体积和表面积均较普通椎间融合器更大;(3)融合器的前壁和后壁形成具有2°~8°的坡面,使得融合器植入后能够满足腰椎生理曲度的要求,并在前后壁上共设有4个植骨孔,为融合器内植骨与外部正常骨组织融合提供空间;(4)前壁与后壁中间位置连接有中隔筋,用于分担融合器所承受的压力,同时为了融合器顶面与上终板贴合更加紧密、受力更加均匀,将中隔筋顶面设置为弧面结构。

图1 解剖型纳米羟基磷灰石/聚酰胺66椎间融合器
1.2临床资料本研究共纳入南华大学附属第一医院脊柱外科于2015年1月~2017年6月收治的21例L5/S1腰椎间盘突出症患者。其中男性12例,女9例,年龄35~62岁,平均42.7岁。该组患者临床症状均以腰痛为主,均行椎间盘造影并行疼痛诱发试验确认责任间盘,患者均经过严格保守治疗6 个月疗效不佳,手术愿望强烈。术前均通过详细体格检查,并完善腰椎正侧位片、动力位片、CT、MRI等影像学检查再次确认患者手术指征,术前行腰骶前血管计算机断层摄影血管造影三维重建术(three dimensional computed tomographic angiography,3D-CTA),排除相关手术禁忌征,术前常规进行腹腔镜手术术前准备。
1.3手术方法患者取全麻,常规仰卧位,消毒铺单后,于脐上做宽约1 cm横切口,置入气腹针,气腹压力维持在12 mmHg。于脐上切口穿刺放置10 mm Trocar,置入腹腔镜,探查腹腔大致情况,改头低脚高位。分别于双侧髂前上棘内上2.5 cm处穿刺放置5.5 mm Trocar,置入镜下操作器械。将肠管向头侧推移,确定双侧髂血管分叉位置,超声刀分离骶前筋膜,homlock可吸收夹断扎骶正中血管,显露L5/S1椎间隙并予X线定位。在髂前下棘连线与腹正中线交点处穿刺放置15mm Trocar,腹腔镜监视下应用髓核钳、铰刀等工具行椎间盘切除、处理软骨终板。将15 mm Trocar直径扩大至25 mm,通过该操作孔,确认椎间隙高度并置入椎间融合器试模透视,取合适规格的解剖型纳米羟基磷灰石/PA66椎间融合器,并在融合器内装填同种异体松质骨。将融合器置入病变椎间隙,予以正侧位透视位置满意后,检查手术操作区域无出血等异常情况,冲洗手术操作区域后,放置引流管关闭各孔道。手术各切口遂予以缝合,常规敷料覆盖。
1.4术后处理术后常规禁食,并予以预防感染及营养支持等对症支持治疗,术后观察引流量小于30 ml/24 h后拔除盆腔引流管,术后3天嘱患者可在支具保护下下床活动,术后一周复查腰椎正侧位片,术后3个月根据复查CT结果评估手术节段植骨融合情况,如融合情况欠佳,支具保护需延长至6个月,术后6个月再次复查腰椎正侧位片及CT,追踪手术节段融合情况。
1.5观测指标术中记录手术时间、出血量以及双下肢感觉运动等情况。根据疼痛视觉模拟评分(VAS)法评价术前﹑术后一周﹑术后3月和术后6月时患者主观症状,术后根据患者情况追踪随访并复查X线片、三维CT等影像学资料,评估患者L5/S1椎间隙高度变化情况,并通过随访的CT资料按照Brantigan融合分级标准[3]进行评价(表1)。
1.6统计学分析采集患者术前、术后1周、术后3月和术后6月的VAS评分以及正侧位X线片测量得到的L5/S1椎间隙高度,本组数据均采用SPSS 18.0统计软件进行统计学分析,计量资料以均数±标准差表示并进行单因素方差分析,对两两结果采用LSD多重比较,P<0.05认为差异有统计学意义。
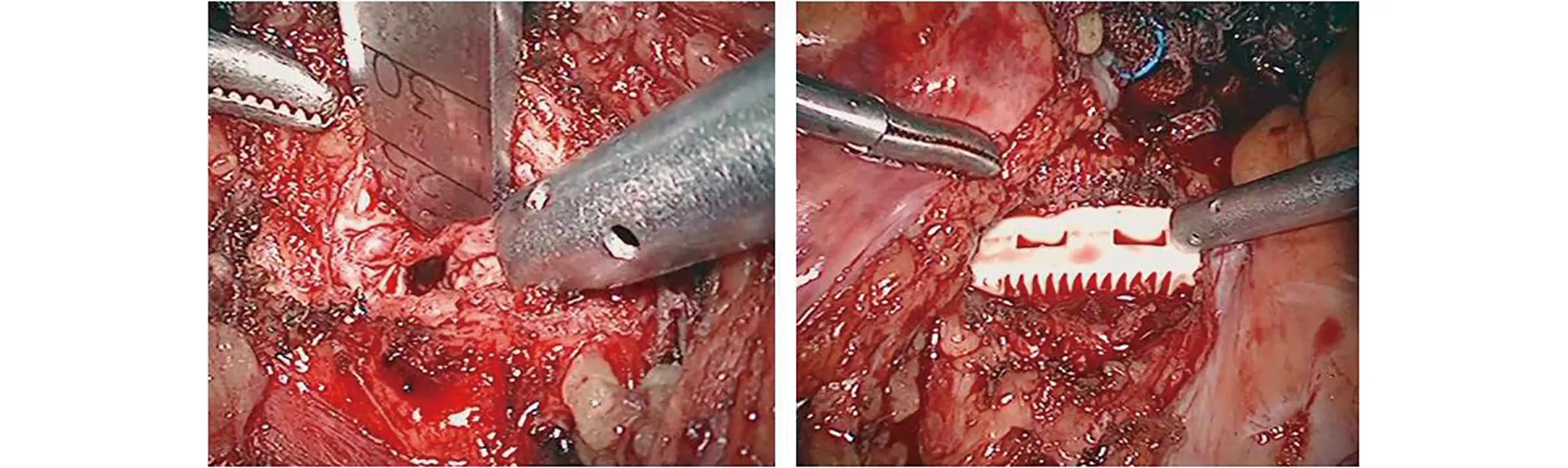
图2 融合器应用腹腔镜下应用绞刀切除椎间盘(左图),植入解剖型纳米羟基磷灰石/聚酰胺66椎间融合器后(右图)

分级A级B级C级D级E级融合情况不融合可能不融合可能融合可能融合坚强融合表现明显的假关节、植骨吸收、支撑体移位、椎间高度丢失、支撑体或内固定物损坏可疑假关节形成,明显的植骨吸收,融合区可见透光区或透光带融合区域出现小部分透亮影或小片骨吸收整个融合区域骨桥形成且密度至少与术后即刻相似融合区域融合骨密度在影像学上比术后即刻更成熟致密,成熟骨小梁形成骨桥
2 结 果
全组病例置入的cage均为带有6°的前凸角,高度为14 mm。手术时间 90~150 min,平均 125 min;术中出血量50~150 mL,平均80 mL;住院时间 7~11天,平均 9天;术后均在3~5天内拔出引流管后,即可在支具保护下下床活动,平均卧床时间为4.3天。全组病例均未发生大血管或神经等损伤及逆向射精/尿失禁等并发症。所有患者均完成6个月的随访,患者腰痛症状均得到明显改善,VAS评分由术前的平均7.57±1.16分,改善至术后一周的3.10±0.77分,术后3月及术后6月复查时VAS评分均呈持续改善趋势,具有统计学差异(P<0.05)。根据Brantigan融合分级标准,全组病例中术后3月时,9例达到了D级,其余12例均为C级,而术后6月复查时全组患者Brantigan分级中其中18例达到D级,另外3例呈E级表现。术前椎间隙高度平均为8.57±1.50 mm,术后恢复至13.68±0.30 mm,同时对术后1周﹑术后3月和术后6月复查X线及CT测量得到的椎间隙高度进行多重比较,发现均无统计学意义(P1-3=0.347,P3-6=0.493),全组患者术后均未出现明显融合器下沉,典型病例见图3。随访过程中全组病例均未出现内置物松动、脱落等并发症。

表2 数据分析结果
与前一时间点相比,aP<0.05
3 讨 论
3.1腹腔镜下L5/S1椎间盘切除椎间植骨融合术随着我国居民日常生活习惯的改变,腰椎间盘突出症的发病呈高发态势且逐渐显现出呈低龄化发展的趋势[4]。而腰椎间盘突出症的大多数发病节段则集中在L4/5和L5/S1[5],对于症状严重,反复保守治疗无效的患者往往需要手术治疗,目前手术治疗的方式很多,而腹腔镜下L5/S1椎间盘切除椎间融合器植骨融合术优势而受到广大脊柱外科医生的关注。该手术方式的优点为:(1)该术式通过双侧髂血管之间的空隙,可利用腹腔镜对操作区域内的血管和其他组织结构非常方便的进行处理,如本组病例中平均出血量仅80mL,均低于传统前路或后路开放手术;(2) 该术式从前路进入无需侵入椎管从而避免了术中对椎管内组织产生过多骚扰,减少了术后神经根水肿、粘连甚至神经损伤带来的严重并发症,同时前路手术对腰椎后部相关骨性结构以及肌肉没有造成损伤,术后腰椎稳定性高,可在支具保护下早期下床活动,本组患者均在术后3至5天即在支具保护下下床活动;(3) 在腹腔镜下可利用30°角光源镜伸入到椎间隙中清楚显示纤维环后部及后纵韧带,在镜下对病变节段椎间盘进行操作,对退变椎间盘及软骨终板进行彻底清除,可大幅提高椎间植骨融合率。因此腹腔镜下L5/S1椎间盘切除椎间植骨融合术具有腹腔内脏器干扰小,椎体前壁血管、神经等组织创伤小,椎间盘组织处理充分、止血彻底等优势。当然该技术学习曲线长、操作复杂等特点也会增加腹腔脏器、神经及大血管损伤等并发症发生的几率,因此该技术仍需要严格掌握适应证,同时手术中需在经过正规培训的腹腔镜专科医师的协助下进行[6]。但毫无疑问,该技术的微创优势以及良好的手术效果是明显的,在严格把握适应症并熟练掌握相关关键技术的前提下具有良好的临床应用前景。
3.2解剖型纳米羟基磷灰石/聚酰胺66椎间融合器自Bagby及Kuslich于1988年首次成功将椎间融合器应用于腰椎间融合术治疗椎间盘源性腰痛以来[7],各种类型的椎间融合器相继问世,并被大多数临床医师所接受。但国内市面上尚缺少理想的能应用于腰椎前路椎间植骨融合术的国产椎间融合器产品,目前的相关产品主要由国外进口,但价格昂贵且与国人的解剖数据并不匹配,故大多数学者仍采用后路椎间融合器,甚至是采用双椎间融合器的方式进行植骨融合[8],无疑这样的手术将会因所采用的不合适的椎间融合器导致术后效果的不确切性。本研究中使用的解剖型纳米羟基磷灰石/聚酰胺66椎间融合器是为了克服上述不足之处,而新研发的完全按照国人解剖特点设计的能有效恢复腰椎生理曲度和避免融合器下沉的的完全国产化的腰椎椎间融合器。该融合器具备以下优势:(1)通过采用纳米羟基磷灰石/聚酰胺66复合材料,利用该采用具有良好的生物相容性、生物活性及骨诱导性能,使得椎间融合器本身可与骨组织界面充分融合,有利于植骨融合。且该材料具有与自体皮质骨相匹配的弹性模量,应力遮挡低,能有效降低椎间融合器塌陷的发生机率。(2)在融合器设计时根据国人腰椎生理解剖特点设计,在满足椎间融合器临床应用要求的前提下增加了融合器与上下终板的接触面积,进一步降低了融合器的下沉几率;同时在融合器上下两面均设计了防滑齿,使融合器植入后不易脱出;而且融合器的前、后壁高度差异使融合器植入后能够有效恢复腰椎生理曲度,前、后壁之间的弧顶中隔筋,利用“牵张-压缩”原理[9],使得融合器与上终板贴合更加紧密,从而使融合器受力更加均匀。(3)融合器设计与生产均具有自主知识产权,实现了完全国产化生产,费用较进口产品显著降低,具有良好的市场推广应用价值。
3.3解剖型纳米羟基磷灰石/聚酰胺66椎间融合器在腹腔镜下L5/S1椎间盘切除椎间植骨融合术中的应用在本研究中,我们对在腹腔镜下L5/S1椎间盘切除椎间植骨融合术中应用解剖型纳米羟基磷灰石/聚酰胺66椎间融合器进行了初步的临床应用,对该组患者均进行了不少于 6 个月的随访。患者术后腰痛症状均得到显著改善,VAS评分由术前的平均7.57±1.16分,改善至术后一周的3.10±0.77分,且术后3月及术后6月复查时VAS评分均呈持续改善趋势(P<0.05),分别平均为1.38±0.67分和0.76±0.70分。我们发现该组患者在术后1周时VAS评分便得到显著改善,这说明该术式能有效解决患者顽固性腰痛的症状,同时伴随着椎间植骨融合的进一步稳定,残余症状仍有持续改善的趋势。根据Brantigan融合分级标准,全组病例中术后3月时,9例达到了D级,其余12例均为C级,而术后6月复查时全组患者Brantigan分级中其中18例达到D级,另外3例呈E级表现,而通常将D级及E级视为已经出现骨性融合[3]。该新型椎间融合器所拥有较为满意的植骨融合率,我们分析这可能与该新型融合器采用与国人完全匹配的解剖学数据和椎间融合器与上下终板较大接触面积以及植骨量是密不可分的。而在椎间隙有效撑开及高度维持方面,本组病例术前平均椎间隙高度仅为8.57±1.50 mm,术后恢复至13.67±0.30 mm,这说明该型椎间融合器可以对患者手术节段椎间隙进行有效撑开。同时通过对术后1周﹑术后3月和术后6月复查X线及CT测量得到的椎间隙高度进行多重比较,发现均无统计学意义(P1-3=0.347,P3-6=0.493),这都表明在实际临床应用过程中纳米羟基磷灰石/聚酰胺66复合材料所具有的与自体皮质骨相匹配的弹性模量以及宽大的椎间融合器接触面积的确能够减少患者术后出现融合器下沉的几率。
综上所述,在腹腔镜下L5/S1椎间盘切除椎间融合器植骨融合术中应用新型解剖型纳米羟基磷灰石/聚酰胺66椎间融合器可有效恢复并维持融合节段椎间隙高度且具有满意的植骨融合率,初步临床应用获得了满意的效果,但中远期临床疗效仍有待于进一步观察。
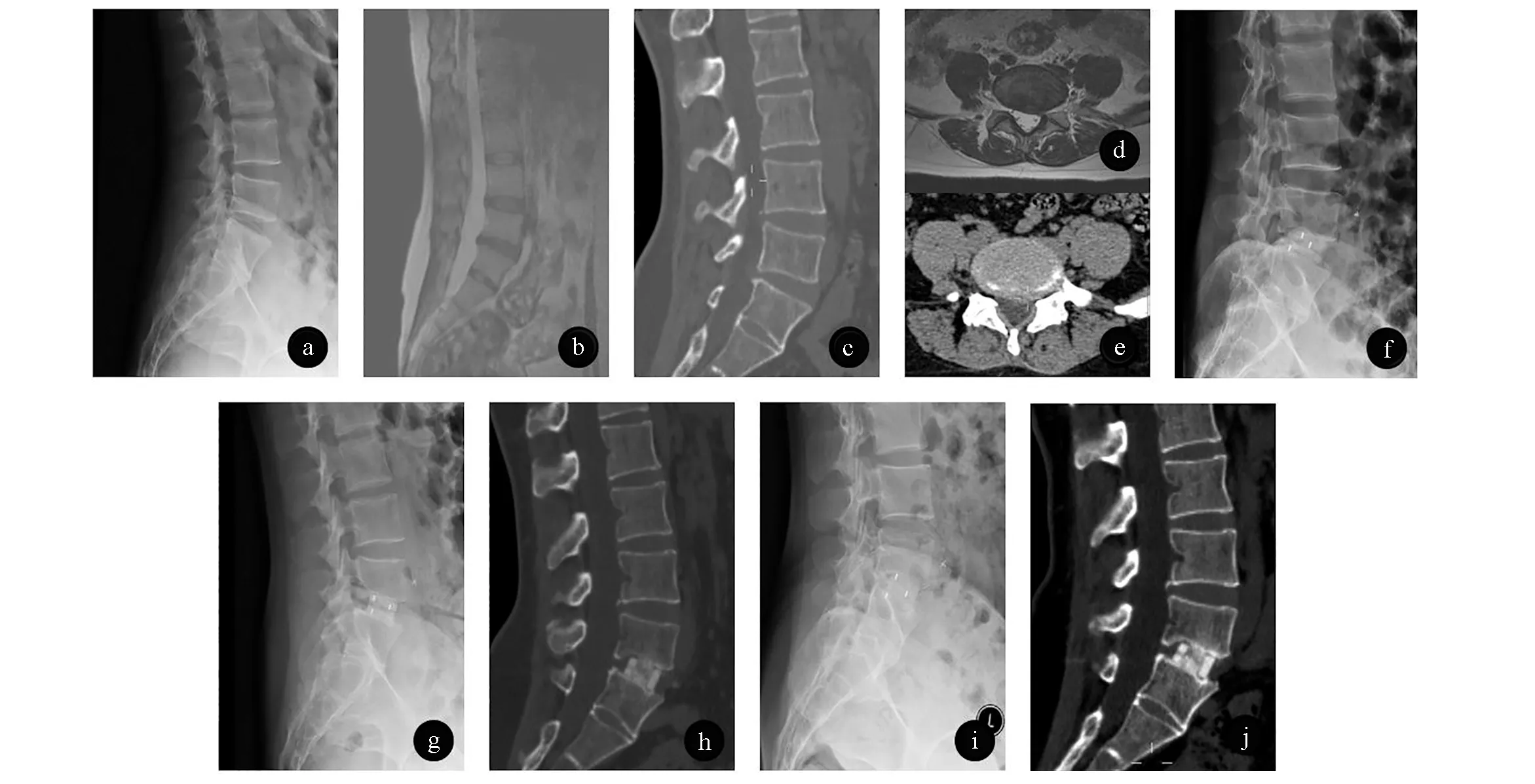
图3 女,39岁,因“反复下腰部疼痛8年,加重8个月”入院腰椎检查照片a.腰椎X线侧位片提示L5/S1椎间隙狭窄;b-e.CT及MRI提示L4/5、L5/S1椎间盘突出;f.术后1周复查腰椎侧位片提示L5/S1内可见椎间融合器显影,位置可,椎间隙较术前明显撑开;g.术后3月复查腰椎侧位片提示L5/S1内可见椎间融合器内密度较术后一周明显增高,无下沉及移位,椎间隙较术后复查无明显变化;h.术后3月复查CT提示椎间融合器周边可见明显骨组织生长,植骨融合效果良好;i.术后6月复查腰椎侧位片提示L5/S1内椎间融合器位置较术后3月时无明显变化,且椎间融合器内密度较前进一步增高;j.术后6月复查CT提示椎间融合器内杆骨进一步生长并与骨界面整合,融合器植骨窗内及周边可见明显骨组织生长,提示植骨节段已骨性融合。
参考文献:
[1] ZUCHERMAN JF, ZDEBLICK TA, BAILEY SA, et al. Instrumented laparoscopic spinal fusion. preliminary results[J]. Spine (Phila Pa 1976), 1995,20(18):2029-34.
[2] 王文军, 薛静波, 晏怡果,等. 新型解剖型纳米笼架在腰椎前路椎间融合中的应用[J]. 中国矫形外科杂志, 2017, 25(19): 1735-40.
[3] BRANTIGAN JW, STEFFEE AD. A carbon fiber implant to aid interbody lumbar fusion. Two-year clinical results in the first 26 patients[J]. Spine (Phila Pa 1976), 1993,18(14):2106-7.
[4] 王国基, 王国军, 彭健民, 等. 腰椎间盘突出症致病因素的流行病学研究[J].现代预防医学,2009,36(13):2401-3.
[5] 吴建新. 20年腰椎间盘突出症病例回顾分析及中长期随访研究[D].上海:第二军医大学,2008.
[6] 王洪伟, 李长青, 周跃. 内窥镜技术在腰椎间盘突出症治疗中的应用进展[J].中国脊柱脊髓杂志,2011,21(3):248-51.
[7] KUSLICH SD, ULSTROM CL, GRIFFITH SL, et al. The Bagby and Kuslich method of lumbar interbody fusion. History, techniques, and 2-year follow-up results of a United States prospective, multicenter trial[J]. Spine (Phila Pa 1976), 1998,23(11):1267-78.
[8] KIM Y. Prediction of mechanical behaviors at interfaces between bone and two interbody cages of lumbar spine segments[J]. Spine (Phila Pa 1976), 2001,26(13):1437-42.
[9] GOH JC, WONG HK, THAMBYAH A, et al. Influence of PLIF cage size on lumbar spine stability[J]. Spine (Phila Pa 1976), 2000,25(1):35-9.

