3种早春植物叶片蛋白质SDS-PAGE分析
陈虹,李涛,白晋华,郭红彦
(山西农业大学 林学院,山西 太谷 030801)
日本晚樱(Cerasus serrulatalannesiana),西府海棠(Malusmicromalus),华北珍珠梅(Sorbariakirilowii)是3种蔷薇科早春观叶开花植物,喜阴耐寒,繁殖能力强,花期较长,在园林观赏应用、城市规划建设中日渐受到重视[1]。日本晚樱,西府海棠的花期为4-5月,华北珍珠梅为6-7月[2~4]。这3种早春开花植物叶片在成长过程中都具有较强的光合作用能力,为植物花期的花器官发育提供了充足的营养物质。
蛋白质组学作为功能基因组学研究的重要支柱,已成为新世纪生命科学研究的前沿和热门领域[5]。由于植物组织中含有大量色素、酚类、有机酸、脂类及其他次生代谢产物,干扰蛋白分离和蛋白图谱,而且不同植物材料中的干扰物质也不尽相同使得植物蛋白质组学研究进展相对落后于动物和微生物蛋白质组学[6]。蛋白质提取是聚丙烯酰胺凝胶电泳的第一步,如若提取效果好,在电泳试验中会使蛋白质充分分离及最后结果的可靠性。
关于这3种具有早春观赏价值的蔷薇科植物叶片中,蛋白质的提取与组分研究较为缺乏,不利于后期对这三种植物开展蛋白组学研究。故本试验通过采用酚提取法,改良的酚提取法,改良的Tris-HCl法和TCA-丙酮法等4种不同的蛋白质提取方法,以期筛选出最优的叶片蛋白质提取方法。继而以3种早春植物叶片为研究材料,提取其叶片蛋白质。采用考马斯亮蓝(G-250)法测定其蛋白质含量、SDS-PAGE(十二烷基硫酸钠-聚丙烯酰胺凝胶)法进行分析这3种植物叶片的蛋白质组分变化规律,为早春植物的栽培管理和提高抗逆性中发挥重要的作用。
1 材料与方法
1.1 试验材料
1.1.1 4种蛋白质提取法试验材料
试验材料选自山西农业大学植物园10年生日本晚樱3月20日上午9点用冰盒采样装回,材料采回后立即用蒸馏水冲洗,用滤纸吸干水分,在-70 ℃冰箱中保存备用。
1.1.2 3种早春植物叶片蛋白质提取法试验材料
试验材料选自山西农业大学植物园10年生日本晚樱、西府海棠、华北珍珠梅的叶片。4月初、4月中旬、5月初、5月中旬、6月初上午9点各采样一次。采样方法及材料处理同上以。
1.2 植物叶片蛋白质的4种提取方法
1.2.1 酚提取法
参照郝强[7]等方法,称取叶片约2 g,加入适量PVPP(交联聚乙烯吡咯烷酮),同时在预冷的研钵中加入液氮迅速研磨,再加入3 mL蛋白质提取缓冲液(1 mmol·L-1DTT,20 mmol·L-1Tris-HCl(pH7.0),250 mmol·L-1蔗糖,10 mmol·L-1EGTA,1%(V/V)TritonX-100,1 mmol·L-1PMSF)悬浮1 h,继续研磨混匀后转移到5 ml Eppendorf管中。4 ℃15 000 r·min-1离心5 min,取400 μL的上层苯酚于5mlEppendorf管中,加入5倍体积的0.1 mol·L-1乙酸铵-甲醇,-20 ℃冰箱过夜。4 ℃15 000 r·min-1离心5 min,去上清,沉淀用预冷的甲醇冲洗3次,预冷的丙酮冲洗3次,沉淀在35 ℃恒温烘箱中烘干,干粉密封保存在-20 ℃冰箱内待用。
1.2.2 改良的酚提取法。
参照刘淑芹[8]等方法称取约2 g放入预冷的研钵中迅速加入液氮充分研磨,在Eppendorf管中加入预冷的含10%TCA、0.07%β-巯基乙醇的丙酮溶液,-20 ℃冰箱静置1 h后4 ℃15 000 r·min-1离心20 min,离心后的沉淀用预冷丙酮(含0.07%β-巯基乙醇)2 mL悬浮,在-20 ℃冰箱内静置1 h;在4 ℃条件下以15 000 r·min-1离心5 min,沉淀在35 ℃恒温烘箱中烘干。称取0.1 g干粉悬浮于0.8 ml苯酚和0.8 mL SDS缓冲液(30%蔗糖;2%SDS;0.1 mol·L-1Tris-HCl(pH7.0);65 mmol·L-1DTT)混匀后转移到2 mlEppendorf管。4 ℃15 000 r·min-1离心5 min后取约400 μL的上层苯酚到2 mLEppendorf管中。加入5倍体积的0.1 mol·L-1乙酸铵-甲醇,-20 ℃冰箱中放置30 min。之后,在4 ℃12 000 r·min-1离心5 min,再用冷的甲醇乙酸铵溶液冲洗2次,用80%丙酮洗2次,沉淀在35 ℃恒温烘箱中烘干,干粉密封保存在-20 ℃冰箱内待用。
1.2.3 改良的Tris-HCl法
参照曾广娟[9]等方法,称取约2 g叶片放入预冷的研钵中迅速加入液氮充分研磨准确称取0.5 g粉末置10 mLEppendorf管,加入适量PVPP和3 mL蛋白质提取缓冲液(62.5 mmol·L-1Tris-HCL(pH7.0);0.5%SDS;10%甘油;5%β-巯基乙醇),-20 ℃冰箱静置1 h后4 ℃15 000 r·min-1离心20 min,取1.5 mL上清液至10 mLEppendorf管,加入4.5 mL预冷丙酮,摇匀,-20 ℃静置1 h之后4 ℃15 000 r·min-1离心10 min。弃上清,沉淀在-20 ℃放置1 h,使丙酮完全挥发。干粉密封保存在-20 ℃冰箱内待用。
1.2.4 采用TCA-丙酮法
参照杨秋玉[10]等方法,提取叶片蛋白质,称取约2 g叶片放入预冷的研钵中迅速加入液氮充分研磨,在Eppendorf管中加入预冷的2倍体积的TCA/丙酮溶液,-20 ℃冰箱静置1 h后4 ℃15 000 r·min-1离心20 min,去上清留沉淀,再加入丙酮(-20 ℃预冷,含0.05%DTT)。在-20 ℃冰箱过夜,次日相同条件下离心10 min,去上清留沉淀,再加入预冷的丙酮浸提1 h后相同条件下离心。沉淀在35 ℃恒温烘箱中烘干,干粉密封保存在-20 ℃冰箱内待用。
1.3 3种早春植物叶片蛋白质提取
3种植物叶片5个时期的蛋白质提取步骤与“1.2.4”相同。
1.4 3种植物叶片蛋白质含量的测定
3种植物叶片蛋白质含量采用考马斯亮蓝染色法测定[11]。称取上述干粉0.5 g加5 mL蒸馏水研磨后,4 ℃,15 000 r·min-1离心10 min,上清液即为蛋白样品液,提取1 mL上清液,加入5 mL考马斯亮蓝G-250摇匀,2 min后595 nm波长下比色,每个样品重复3次。
1.5 标准曲线的制备
以牛血清蛋白为标准蛋白,用考马斯亮蓝G-250染色法。试验选取牛血清蛋白做标准曲线,配制100 mL·L-1牛血清蛋白标准溶液,做标准曲线。
加试剂2~3 min后再分光光度计上595 nm处比色,制作蛋白质含量标准曲线。
1.6 蛋白质SDS-PAGE电泳
采用SDS-PAGE单向电泳[11]进行蛋白质组分分析。称取蛋白质干粉各30 mg装入Eppendorf管中,分别加入400 μL蛋白质提取液,35 ℃恒温水浴锅震荡水浴30 min,4 ℃15 000 r·min-1离心20 min,得到的上清液即为上样液。上样量为30 μL。凝胶浓度为:分离胶12%,浓缩胶4.4 %。电泳程序为60 V,20 min;160 V,1.5 h。溴酚蓝指示剂迁移至凝胶底部1 cm处停止电泳。分别加入30 μLMarker和20 μL Marker筛选最佳上样量。
电泳结束后用染色液染色2 h,脱色液脱色至色带清晰为止[12],最后拍照保存并对蛋白质分子量进行统计分析。
2 结果与分析
2.1 蛋白质标准曲线
以吸光值为横坐标,蛋白质含量为纵坐标, 标准曲线方程Y=163.5X-4.690 3,相关系数是R2=0.992。
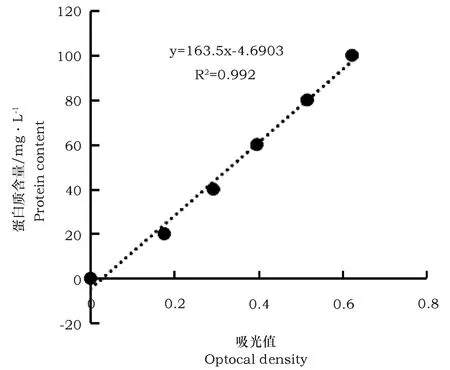
图1 蛋白质含量测定标准曲线Fig.1 Standard curve of the protein content
2.2 不同蛋白质提取方法的SDS-PAGE分析
通过图2的SDS-PAGE单向电泳可以看出,30 μLMarker蛋白条带出现饱和重叠,颜色过深和脱尾现象,不易辨别。20 μL Marker蛋白条带清晰可辨,可以用作指示蛋白条带所对应的分子量大小。酚提取法,改良的酚提取法没有出现可以清晰可辨的蛋白条带,TCA-丙酮法比改良的Tris-HCl法所得蛋白条带更加清晰可辨,蛋白组分更丰富,为最优提取方法。
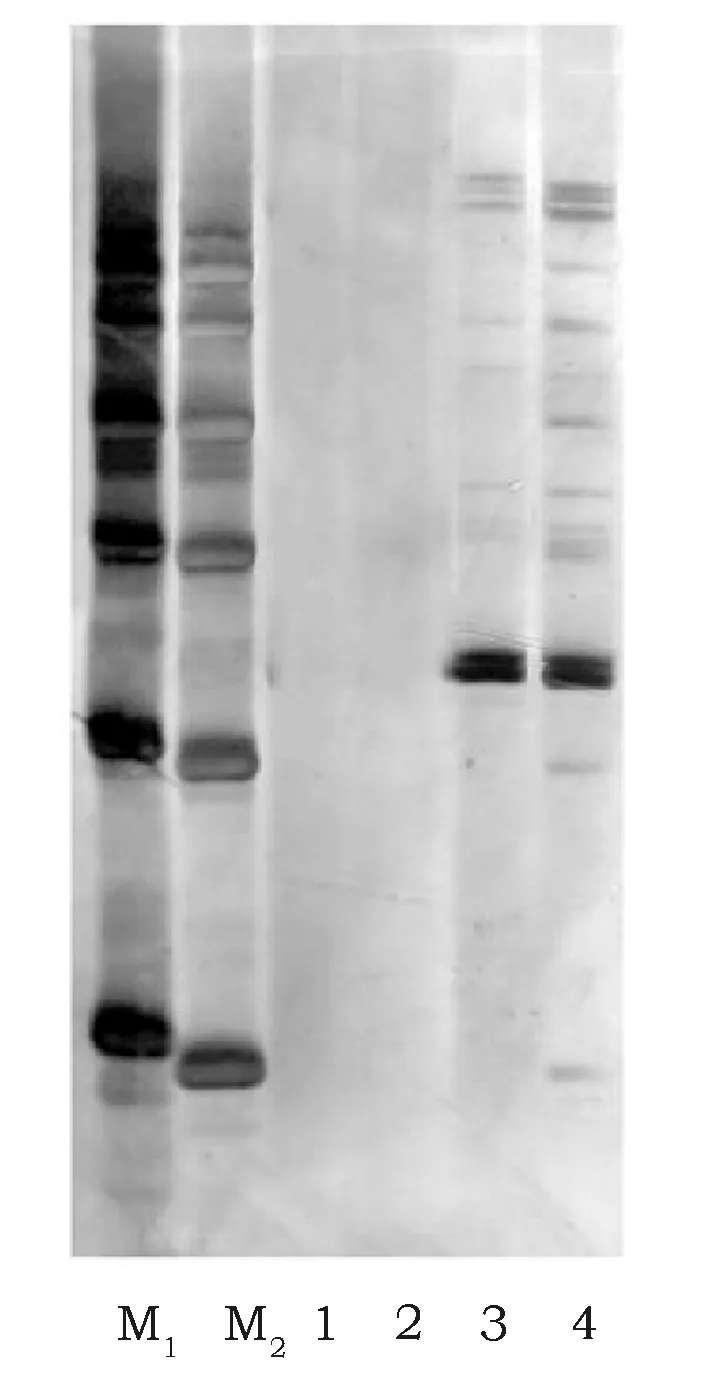
图2 4种方法提取蛋白质的单向电泳Fig.2 4 ways to extract protein SDS-PAGE 注:M1表示Protein Marker30 μL,M2表示Protein Marker20 μL,1~4依次表示:酚提取法,改良的酚提取法,改良的Tris-HCl法,TCA-丙酮法。 Note:M1means Protein Marker30 μL,M2means Protein Marker20 μL,1~4 means:phenolic extraction,modified phenolic method,modified Tris-HCl method,TCA-acetone extraction method.
2.3 3种植物叶片蛋白质含量的动态变化
对5个不同时期的3种植物叶片中蛋白质的含量进行分析,结果表明从4月中旬到6月初3种植物叶片蛋白质含量变化均呈现出先增长后下降的变化规律图。随着新生叶片的生长,叶片蛋白质含量从4月初至5月中旬均呈现上升趋势,且上升比例分别为日本晚樱35%、西府海棠11%、华北珍珠梅13%,5月中旬含量最高,6月初开始缓慢下降。华北珍珠梅叶片蛋白质量为2.14~3.29 mg·g-1明显低于花期比它早的日本晚樱和西府海棠。
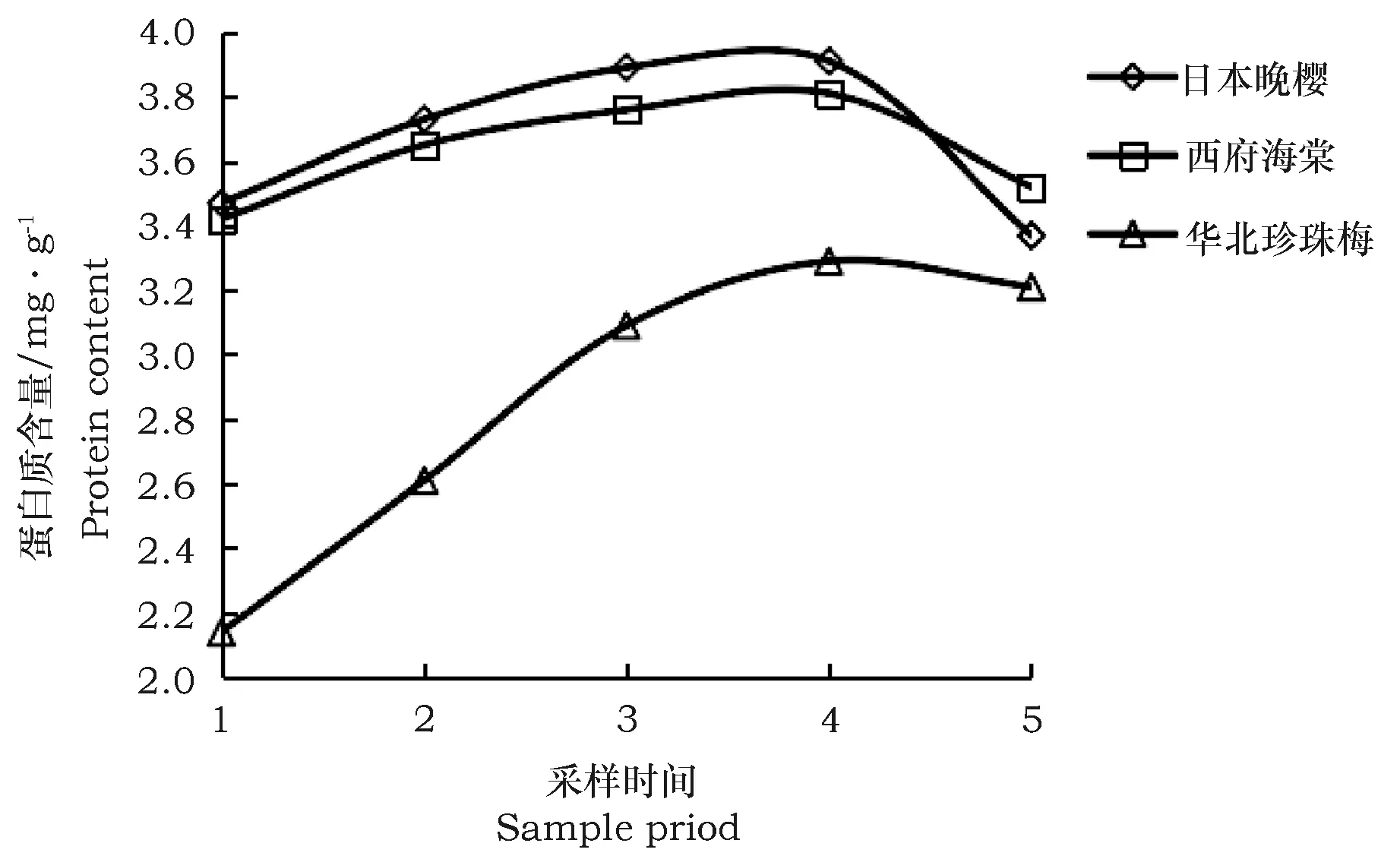
图3 3种植物叶片蛋白质含量的变化Fig.3 Protein content variation in leaves of three plant species 注:1~5依次表示4月初,4月中旬,5月初,5月中旬,6月初。 Note: 1~5 means early April, mid-April, early May, mid-May, early Jun.
2.4 3种植物叶片蛋白质组分分析
根据图4的SDS-PAGE图谱可知,3种植物叶片蛋白质条带数目、位置以及染色的深浅存在明显的差异。日本晚樱和西府海棠叶片蛋白质条带较多,分别得到32条和30条较清晰的蛋白条带;华北珍珠梅为24条。其中46 kDa蛋白在3种植物叶片蛋白图谱中都出现,71 kDa,33 kDa,5 kDa蛋白在日本晚樱和西府海棠叶片蛋白图谱中均出现,在华北珍珠梅蛋白图谱中没有出现。

图4 3种植物叶片单向电泳Fig.4 SDS-PAGE of three kinds of plant leaf注:M表示Protein Marker,1~5表示4月初,4月中旬,5月初,5月中旬,6月初。Note: M means Protein Marker, 1~5 means early April, mid-April, early May, mid-May, early June.
图4-A日本晚樱叶片中普遍存在的蛋白质组分包括:71 kDa、46 kDa、37 kDa、33 kDa、18 kDa、5 kDa蛋白。4月中旬出现的蛋白条带最多。4月初到6月初5个采样时期都出现的蛋白质为71 kDa、46 kDa、5 kDa 3种蛋白。18 kDa蛋白在除5月中旬外的4个采样时期均出现。33 kDa蛋白在4月中旬,5月初,5月中旬都有明显的蛋白质条带出现,4月初和6月初模糊不清,难以辨认。
图4-B西府海棠叶片中普遍存在的蛋白质组分包括:71 kDa、62 kDa、46 kDa、33 kDa、24 kDa、15 kDa、5 kDa蛋白。4月中旬出现的蛋白条带最多。其中4月初到6月初5个采样时期都出现的蛋白质为46 kDa蛋白。33 kDa、15 kDa和5 kDa蛋白具有明显的动态变化:从4月初至4月中旬33 kDa蛋白条带颜色逐渐变浅,5月初消失,5月中旬至6月初条带逐渐清晰6月初条带颜色达到最深,说明蛋白质组分含量达到最高。15 kDa蛋白从4月中旬开始出现,条带在剩余4个时期差异不大。5 kDa蛋白4月初开始出现,持续4个采样时期,6月初消失不见,期间条带颜色逐渐加深后又变浅。
图4-C华北珍珠梅叶片中普遍存在的蛋白质包括:65 kDa、46 kDa、35 kDa、12 kDa蛋白。5月中旬出现的蛋白条带最多。4月初到6月初都出现的蛋白质:65 kDa、35 kDa、12 kDa3种蛋白。其中65 kDa蛋白无明显变化,35 kDa蛋白条带颜色逐渐变浅在5月初时模糊不清,5月中旬和6月初又清晰可辨,12 kDa蛋白在5月初时蛋白条带颜色最深最清晰。46 kDa蛋白发生规律性变化4月中旬开始出现至6月初颜色逐渐变浅。
3 讨论与结论
本试验通过比较分析了酚提取法,改良的酚提取法,改良的Tris-HCl法和TCA-丙酮法4种蛋白质提取方法,得出TCA-丙酮法在SDS-PAGE图谱上蛋白条带最多,最清晰。是最适宜早春植物叶片蛋白质的提取方法。本试验结果与杨秋玉的TCA-丙酮-酚法是最适于杜鹃属植物叶片蛋白质的提取方法[10];杜邵华最适宜枣树叶片蛋白质提取法是改良的丙酮沉降法[13]试验结果不相符。与刘淑芹分蘖洋葱叶片总蛋白提取[8];袁坤杨树叶片蛋白质提取法[14]的试验结果相一致。目前文献报道过的蛋白质样品制备方法较多,但并无一种可以通用的蛋白质样品制备方法,反而由于实验样本的多样性和复杂性(微生物、动物、植物等)以及研究目标蛋白质(如膜蛋白、翻译后修饰的蛋白等)的不同而需要针对性的对蛋白质样品制备方法进行一定程度的优化才可满足实验要求[15]。
3种植物叶片蛋白质含量在4月初至5月中旬呈现持续增长的状态,5月中旬开始到6月初时有小幅的下降。华北珍珠梅叶片蛋白质含量明显低于花期和叶片成长期都比它早的日本晚樱和西府海棠叶片蛋白质含量。
3种植物叶片中的蛋白质组分丰富,变化多样。日本晚樱叶片中普遍存在的蛋白组分有6种,西府海棠叶片中普遍存在的蛋白组分有7种华北珍珠梅叶片中普遍存在的蛋白质有4种。4月初和4月中旬日本晚樱叶片中有14条带,西府海棠叶片中有13条带,华北珍珠梅叶片中有9条带。随着植物生长发育,这3种早春开花植物叶片中的蛋白图谱发生了复杂的变化,6月初日本晚樱叶片中有4条带,西府海棠叶片中有5条带,华北珍珠梅叶片中有5条带,条带的减少和颜色的变浅说明蛋白质组分发生了降解。花期为4~5月的日本晚樱叶片和西府海棠叶片蛋白质表达的种类相对较多,蛋白质条带也较清晰;花期为6~7月的华北珍珠梅叶片蛋白质条带和发生明显变化的蛋白质种类都比较少,这与花期积累蛋白质完全吻合[16]。
早春开花植物的花期影响着叶片中的蛋白质,蛋白质条带的可辨程度和染色深浅是蛋白质含量的直接体现,条带颜色越深、越宽,说明含量越高,反之越低[16~18]。由蛋白质含量和SDS-PAGE电泳图谱可知3种早春植物叶片蛋白在电泳图谱中条带的多少和深浅与蛋白质含量的高低相对应的结论。
本试验结果与王改萍等的银杏叶片蛋白质含量中叶片可溶性蛋白质含量变化与树木营养生长的变化规律相同的结果相一致[19]。不同梓属树种、楸树花器官内蛋白质含量的高低与蛋白质条带数量的多少成正相关的试验结果一致[20,21],说明花器官内蛋白含量与叶片内蛋白含量可能存在一定的关联性,可以进一步深入的探究。
参 考 文 献
[1]王静,常青,柳冬良.早春草本植物开花物候期对城市化进程的响应——以北京市为例[J].生态学报,2014,34(22):6701-6710.
[2]周小娟,孙毅宁.西府海棠栽培与繁殖技术[J].农业科技通讯,2017(1):213-215.
[3]张灵灵,蒋细旺.2个日本晚樱品种组织培养和快繁技术研究[J].西南林业大学学报,2015,35(4):27-32.
[4]江波.梅花花期调控机理初步研究[D].杭州:浙江农林大学,2014.
[5]Pandey A, Mann M. Proteomics to study genes and genomes[J]. Nature, 2000, 405(6788):837-846.
[6]Dan Liang, Jianwei Tang, Rober to Javier Peinva, et al. Characterization of CIMMY bread wheats for low-molecuar weight glutenin subunits and other quality-related genes with SDS-PAGE, RP-HPLC and molecular markers[J]. Euphytica,2010,172(2):235-250.
[7]郝强,葛秀秀,张睿鹂,等.北方常绿阔叶木本植物叶片蛋白质双向电泳技术体系优化[J].西北植物学报,2010,30(9):1906-1912.
[8]刘淑芹,吴凤芝.分蘖洋葱叶片总蛋白提取与双向电泳条件优化[J].东北农业大学学报,2013,44(1):71-76.
[9]曾广娟,李春敏,张新忠,等.适于SDS-PAGE分析的苹果叶片蛋白质提取方法[J].华北农学报,2009,24(2):75-78.
[10]杨秋玉,耿兴敏,彭方仁.杜鹃叶片3种蛋白质提取方法的比较[J].安徽农业大学学报,2014,41(3):440-444.
[11]李莹莹,吴彩娥,杨剑婷,等.白果蛋白质提取及SDS-PAGE分析[J].食品科学,2010,31(22):36-40.
[12]吴少辉,巫秀美,张成桂,等.SDS-聚丙烯酰胺凝胶电泳4种染色方法的比较研究[J].安徽农业科学,2012,40(10):5763-5764.
[13]杜绍华,卜志国.枣树叶片蛋白质提取及SDS-PAGE单向电泳条件优化[J].安徽农业科学,2012,40(13):7631-7632.
[14]袁坤,王明庥,黄敏仁.一种适合杨树叶片的蛋白质提取方法[J].南京林业大学学报(自然科学版),2007,31(3):119-121.
[15]Se-Ra Won, Deug-Chen Lee, Seuk Hyun Ko. Honey major protein characterizaton and its application to adulteration detection[J]. Food Research International,2008,41(10):952-956.
[16]尚宏丽,孟鑫,张挺.薏米蛋白提取及其SDS-PAGE电泳分析[J].中国农学通报,2012,28(18):260-265.
[17]Hongcheng Liu, Georgeen Gaza-Bulseco, Chris chumsas, et.al. Characterization of lower molecular weight artifact bands of recombinant monoclonal IgGl antibodies of non-reducting SDS-PAGE[J]. Biotechnologll Letters, 2007,29(11):1611-1622.
[18]王改萍,彭方仁,汤文娟.几种木本植物蛋白质的电泳分析[J].西南林学院学报,2008,28(2):42-44.
[19]王改萍,彭方仁,李生平.银杏叶片蛋白质含量动态变化的电泳分析[J].南京林业大学学报(自然科学版),2006,30(4):114-118.
[20]王改萍,鲁丹,彭方仁,等.不同梓属树种花器官蛋白电泳分析[J].林业科技开发,2012,26(3):54-57.
[21]王改萍.楸树花器官特性及自交不亲和性研究[D].南京:南京林业大学,2013.

