氟的毒理学研究
王俊东,孙子龙
(山西农业大学 动物科技学院,生态畜牧与环境兽医学山西省重点实验室,山西 太谷 030801)
1 氟及其对健康影响的研究概述
氟居卤族元素顶端,电负性最强,可以形成多种化合物,广泛存在于自然界的土壤、岩石和水中。在自然情况下,氟化物相当稳定,很难把氟从中分离出来加以单独认识,直至1886年法国化学家Henri Moissan用电解法分离出氟并获得1906年诺贝尔化学奖,这才对它开始有了认识。
氟与斑釉齿的流调观察。晋代学者嵇康(三国魏国人,公元223—262)的《养成论》中有“齿居晋而黄”的记载(当时认为是食枣所致)。直到1771年医学文献有了斑釉齿的记载,1901年又有牙齿有黄黑色斑点描述,1916年,美国牙医(Black and McKay)当时把发生在美国西南部几个州,使人们的牙变质的这种病称作“得克萨斯牙齿”和“克罗拉多棕色斑(brown stain)”。1931年,Smith MC等在Science上发表题目为“斑釉的原因”,肯定氟是大鼠与绵羊斑釉的原因,搞清了氟与氟斑牙的关系,这是对氟流行病学调查结果的实验证实,具有里程碑意义。1932年丹麦学者Moller 等人报道了氟引起的骨硬化,并提出了Fluorosis (氟中毒) 这一名词,并延续使用至今[1~3]。
全世界地质高氟的环境很多,加上其化学性质非常活泼,导致氟的安全范围极窄,稍有过量就会引起毒性作用。正因为如此,氟中毒是全世界广泛存在的一种人畜共患性地方病。亚洲、非洲、欧洲、北美洲、南美洲及大洋洲的50多个国家均广泛存在该病,特别是在全世界经济不发达的高氟地区其危害更大[2,4]。
人类的氟中毒主要分为饮水型氟中毒、燃煤污染型氟中毒和饮茶型氟中毒。动物的氟中毒主要是饮水高氟、高氟火山灰污染以及工业冶炼排氟污染所致。
我国是地方病流行较为严重的国家,31个省(区、市)不同程度地存在地方病危害,主要有地方性氟中毒、地方性砷中毒、大骨节病和克山病等。其中,饮水型地方性氟中毒病区分布于28个省(区、市)的1 137个县(市、区),受威胁人口约8 728万;燃煤污染型地方性氟中毒病区分布于13个省(市)的188个县(市、区),受威胁人口约3 582万;饮茶型地方性氟中毒病区分布于7个省(区)的316个县(市、区),受威胁人口约3 100万[5]。
2005年8月北京青年报报道,我国氟中毒令4 000万人“笑不敢露齿”,“青年壮汉拄拐杖”。氟不但影响牙齿与骨骼,而且有的地方影响到儿童智商的发育,如2005年11月25 日人民日报报道,山西农村饮用高氟水的人口达347万,水氟有的高达11.9 mg·L-1。2006年1月27日山西日报指出永济市北部地区地下水氟普遍在4 mg·L-1,有的高达8 mg·L-1。共有氟斑牙患者12.3万人,儿童智力低下。有的村十几年适龄青年无一人能达到参军体检标准,无一人考上大中专学校。
由于氟的地质性原因导致了解决问题的长期性与艰巨性。此外,由于我国环境污染的严重性与长期性,对直接暴露在污染环境中的动物的影响远比人类本身要严重得多。所以,无论站到动物健康角度,还是站到公共卫生角度,以及比较医学角度,研究氟的毒理学影响具有极为重要的现实意义[1,6~8]。
2 氟中毒的临床特征
2.1 氟对牙齿的影响
在自然高氟区,最早注意到氟对牙齿与骨骼有明显的影响[9]。经过长期研究观察,发现无论地方高氟区还是工业氟污染区,如果在当地出生或在恒牙形成之前进入高氟区的人与动物,均表现氟斑牙的症状,其病变程度与日进氟量、持续时间有关。临床变化可分为3种类型:①白垩型:切面失去光泽,呈石灰状外观。②着色型:由于牙齿发育不良,疏松多孔,食物中色素沉着,使牙齿表面呈黄色或黄褐色斑块。③缺损型:牙齿的病理损伤除外观着色外,实质性的问题是牙齿的硬度无一例外下降,牙齿变脆,易剥脱,牙面凸凹不平,易磨损,乃至提前脱落,影响采食与咀嚼。(图1~图5)
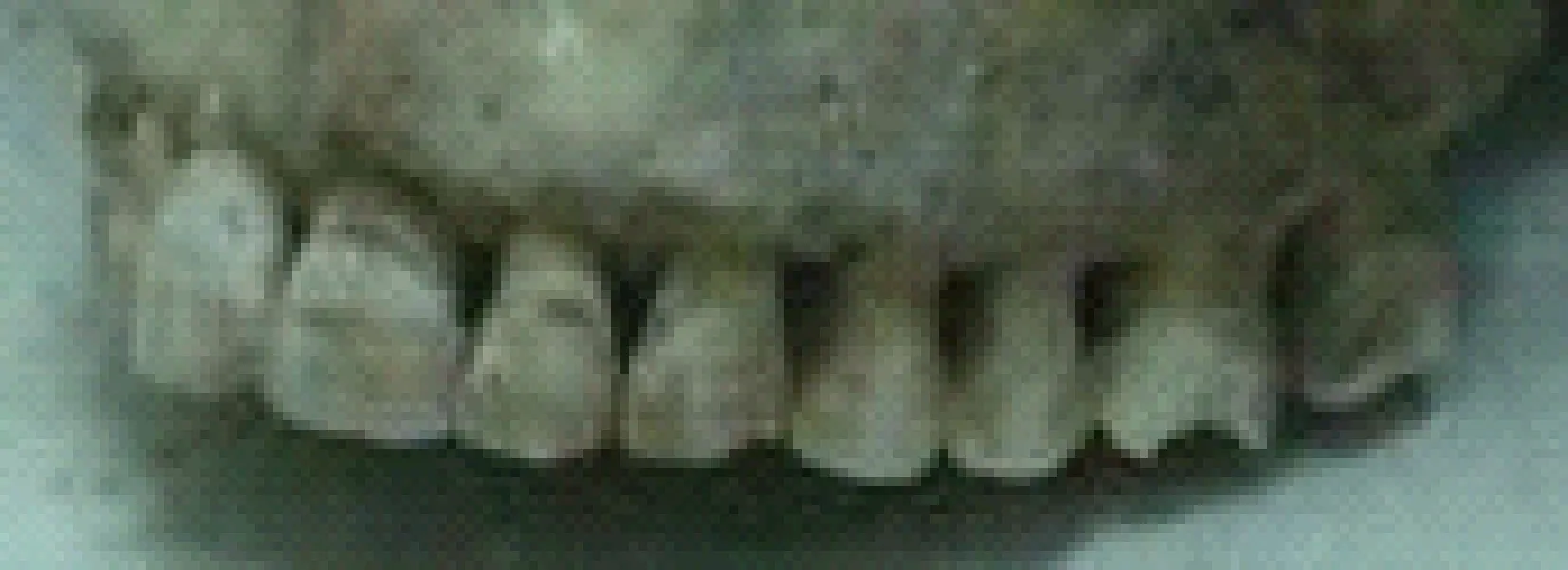
图1 3000年前殷墟士兵氟斑牙齿Fig.1 Dental fluorosis of soldiers in Yin Ruin 3,000 years ago
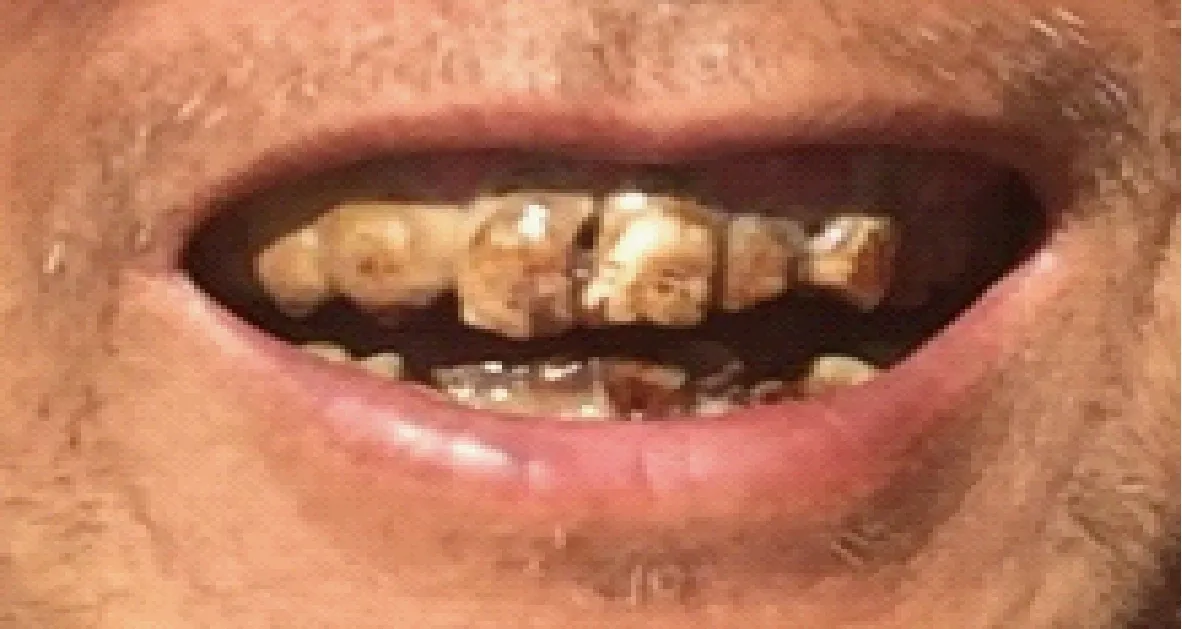
图2 现代人燃煤型氟斑牙齿(2016)Fig. 2 Coal-burning endemic dental fluorosis of modern people(2016)
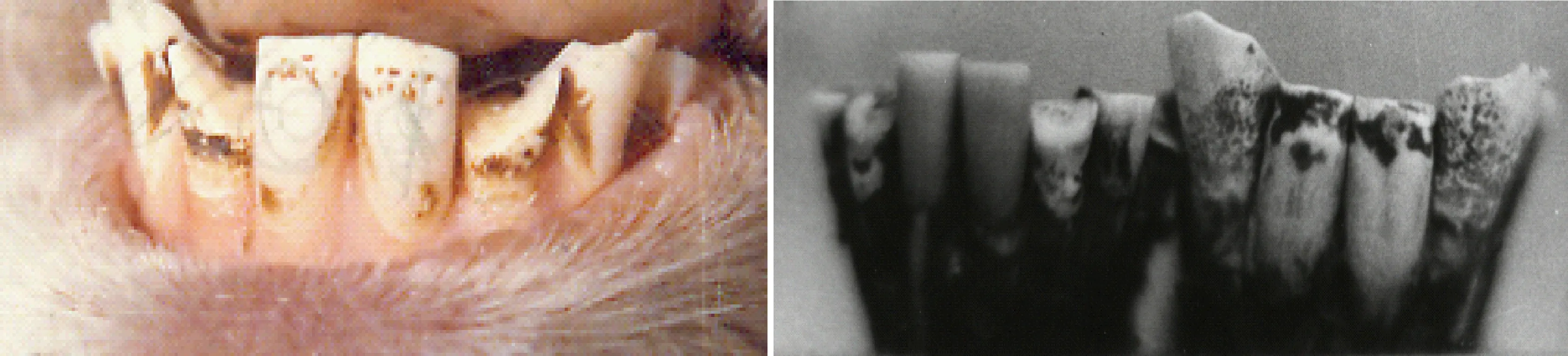
图3 20世纪八十年代羊的牙齿氟中毒:氟斑与过度磨灭与缺损Fig.3 Dental fluorosis of sheep in 1 980 s: enamel fluoride, excessive abrasion and defect

图4 工业氟中毒羊的切齿氟斑与臼齿过度磨损2016Fig.4 The enamel fluoride on incisors and excessive defect of molar of sheep with industrial fluorosis

图5 工业氟中毒牛的切齿2016Fig.5 Incisors of cattle with industrial fluorosis
本课题组通过对工业氟污染区放牧羊牛,及家兔、豚鼠、大鼠、小鼠等实验动物研究提出,氟先影响胶原的发育(立体框架结构),后进一步影响矿物质沉积钙化,并阐明了氟中毒影响胶原合成的分子机理[10~15]。
2.2 氟对骨骼的影响
骨骼为亲氟组织,骨骼是机体内氟的主要沉积场所,如果环境氟不变,骨骼终生处于蓄氟状态。氟中毒可出现骨硬化、疏松或软化等。氟所致的骨硬化可能是由于氟中毒破坏了骨再建过程中骨吸收和骨形成之间偶联平衡的结果。低剂量的氟可刺激成骨细胞活性增强,从而使骨基质形成增加,成骨作用大于破骨作用,导致骨质硬化。高剂量的氟使破骨细胞活性增强,从而造成骨的吸收过度,导致骨质疏松或软化[2,12,14,16](图6)。在我国,就地方病而言,地氟病影响最大,原来的卫生部统计,氟骨症在落后的高氟地区发病率也很高。这个问题随着社会的发展、公共卫生的进步,会不断减少。动物的骨骼与健康问题,主要是工业氟污染区,如果未来污染得以解决,就可以从根本上解决这一问题。
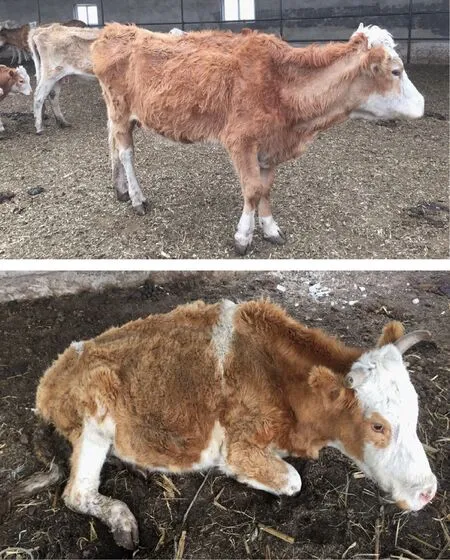
图6 2~3岁氟中毒牛严重消瘦、关节变形、不能起立2016Fig.6 Serious emaciation, joint deformation and astasia of 2~3 years old cattle induced by fluorosis(2016)
3 氟的多系统毒性
氟中毒除了典型的氟斑牙和氟骨症外,研究逐渐发现氟中毒还会导致大量非骨相系统损伤。2006年出版的Fluoride in Drinking Water: A Scientific Review of EPA's Standards一书是由美国国家科学研究委员会(United States National Research Council)饮水中的氟委员会(Committee on Fluoride in Drinking Water)编写,由美国国家学术出版社(National Academies Press)出版,书中从氟对牙齿、骨骼肌、生殖发育、神经、内分泌、胃肠、肾、肝、免疫系统、遗传毒性、致癌性等诸多方面进行了详尽的论述[1]。
3.1 氟对肝脏和肾脏的影响
肝脏是机体新陈代谢和解毒的重要器官,研究表明氟中毒可引起肝脏组织结构和功能异常[1,2]。肾脏是机体主要的排氟器官,体内80%的氟经肾脏排出。大剂量的氟化物能造成肾小管的坏疽,出现肾小球性肾炎,造成严重的肾功能衰竭,出现多尿、烦渴、非蛋白氮含量增加。由于肾功能的降低,对氟的清除降低,则加重氟的蓄积,自然更加重了氟的毒性[2,4]。所以正常的肾脏功能对减轻氟在体内蓄积起到至关重要的作用。
3.2 氟对神经系统的影响
来自中国、印度、伊朗、墨西哥、巴西、芬兰等的流行病学调查发现,氟可引起儿童智商降低。虽然血脑屏障结构较复杂,是一种对脑外异物过滤能力较强的生物屏障,但目前已在氟暴露动物的海马、皮质、下丘脑、纹状体、小脑、中脑、延髓中检测到不同水平的氟蓄积。动物试验表明氟中毒大鼠及小鼠学习记忆能力降低,神经细胞突触、线粒体等亚细胞结构损伤,同时,出现脑组织氧化应激和DNA损伤[17~19]。本课题组着重从蛋白质组学、学习记忆相关神经递质、突触重塑、神经细胞骨架结构等方面阐释氟的神经毒性机理[20~25]。
3.3 氟对生殖系统的影响
流行病学调查和实验室研究发现高氟可降低人和实验动物的生育率。大量体内、外研究表明,一定浓度的氟可以对精子的密度、活率、活力、畸形率、获能、顶体反应、超激活运动、化学趋向性等造成不同程度的损伤[26]。睾丸是精子发生的场所,所以睾丸一直以来作为氟生殖毒性的靶器官进行研究。进一步研究表明,氟可以损害睾丸的组织结构、氧化应激、细胞凋亡、酶活性、激素生成、血睾屏障、免疫豁免等,影响睾丸的精子发生和激素的生成,从而造成动物的生殖能力下降[3,26]。通过NCBI和国际氟化物协会官方杂志《Fluoride》检索Fluoride和reproduction,迄今为止支持氟生殖毒性作用的文献多达170余篇,文献单位的国别来源包括了中国、印度、墨西哥、芬兰、俄罗斯、美国等,均表明氟对人及动物的生殖器官结构与功能有较强的毒副作用。目前,氟的生殖毒性机理研究已经细化至细胞水平,如通过睾丸中生精细胞、支持细胞、间质细胞的培养,借此找到氟的睾丸毒性的靶细胞。另一方面,借助日趋成熟的测序技术和生物信息学分析手段,筛选氟作用下睾丸损伤的具体靶分子与信号通路更是整体探索的研究趋势。本课题组已在各项国家自然科学基金和省部级项目的资助下,完成了氟对睾丸基因组、蛋白质组,附睾蛋白质组,精子基因组、蛋白质组及miRNA表达谱的研究[27~32],首次提出了氟对睾丸血睾屏障和免疫豁免功能,以及间质细胞自噬的毒性作用[33~35],氟对精子超激活运动和化学趋向性的影响[36,37]。
3.4 氟对免疫系统的影响
有大量的研究报道氟对机体免疫器官和免疫细胞的毒性作用,主要涉及细胞免疫、体液免疫、细胞因子和神经内分泌免疫四个方面。氟影响机体免疫系统的方式是多样的,它能抑制细胞蛋白质合成,抑制DNA合成,诱发细胞DNA和染色体损伤,影响细胞内多种酶活性等,进而抑制免疫细胞的生成及其增殖和分化,使免疫细胞代谢发生障碍,细胞的免疫活性降低,免疫功能受到抑制,最终使机体的免疫功能下降[4,38,39]。
4 饮水加氟
早期的调查发现,适量氟有预防龋齿的作用,以至于自1945年以来,世界上许多地区广泛实施饮水加氟用来预防儿童龋齿。比较具有代表性的是美国的饮水加氟。
1945年1月25日美国开始在密歇根州的大急流城(Grand Rapids)进行社区饮水加氟,至1951年变为美国公共卫生署的一项官方政策,1960年有5 000万美国居民在引用氟化水,到2006年,占到61.5%的居民饮用了社区水系统提供的氟化水,至2012年,这个比例达到67.1%。美国疾病控制中心认为社区饮水加氟是20世纪十大公共健康成就之一[2,3]。正如初期的发现一样,预防龋齿的同时加重了氟斑牙的发生,随着饮水加氟的进行,一项全国调查发现40%的儿童牙齿出现条纹或斑点,使得美国政府在2015年4月,将原来的0.7~1.5 mg·L-1的规定降低至最低推荐剂量0.7 mg·L-1,报道最后强调说,这是50多年来的第一次调整[40]。能把美国的水氟标准堡垒攻破,是广大氟研究者长期孜孜不倦研究的结果,是对氟的公共安全与人类健康做出的巨大贡献。
除了美国,法国、阿根廷、墨西哥、斯里兰卡、利比亚、加蓬、塞内加尔、坦桑尼亚、津巴布韦等也实施饮水加氟。还有一些国家曾经实施,现在已经停止的有德国、芬兰、荷兰、瑞士、瑞典、日本等;2014年8月,以色列停止了饮水加氟,声称:只有1%的水用来饮用,99%的水用于工业、农业及其他,而且有科学证据表明过量氟有损健康,当饮水加氟时,无法控制氟的摄入量,强迫很多不愿意摄氟的人群也摄入了。我国广州市1965年开始自来水加氟,到1983年因出现慢性氟中毒而停止了,经过18年的饮水加氟儿童氟斑牙患病率竟达52%,龋齿患病率平均在42%左右,与加氟前比较未见明显降低[41~43]。
5 结语
综观国内外的研究资料,膳食营养对氟中毒的发生发展具有毋庸置疑的延缓或促进作用。我们发现营养不良(特别是蛋白质缺乏)能降低机体的免疫力及对氟的耐受量,由此氟的毒性作用就会变得明显甚至严重,所以在平衡膳食的基础上提供优质蛋白,会增强机体的抗氟中毒的能力[2,44~48]。除了蛋白质,钙、镁、硒等制剂可以抑制氟的吸收,拮抗氟的毒性。维生素C是一种抗氧化剂,维生素D能够调节体内钙和矿物质代谢,一定程度上可以抑制氟的毒性作用。
就人的公共卫生而言,氟中毒问题主要是饮水型与燃煤型氟中毒。饮水高氟地区各种降氟措施都不可能一劳永逸,燃煤氟中毒地区改灶效果也难以持之以恒,所以地氟病往往根深蒂固,不容易彻底解决。当各种主动积极的措施到位时,会有好的控制或缓解作用;如果措施不到位,或者措施不能有效坚持,就有可能重新回到复发的老路上去。
而就动物而言,工业氟污染造成的放牧动物氟中毒是各类氟中毒中最严重的一种。由于动物直接暴露在高氟污染的环境中,大剂量的氟对牙齿的发育影响非常大。而牙齿是动物生存的前提,牙齿质量不好,直接影响动物的生存与生产性能的发挥。特别是草食动物,2年左右动物便因为牙齿问题失去饲养价值不得不被淘汰。由于单个动物的经济意义所限,不可能像人一样通过修补牙齿的技术为其解决吃草问题。因此有实际生产意义的防控措施是在牙齿发育期间,从群体角度看,改换牧草、减少氟的摄入,增加蛋白质营养,这样群体动物的牙齿质量就会有一定的改善,有利于动物的生存与生产性能的有效发挥。
参 考 文 献
[1]Doull J, Boekelheide K, Farishian BG, et al. Fluoride in drinking water: a scientific review of EPA's standards[M]. National Academies Press, Washington, 2006:3-10;23-24.
[2]王俊东.氟中毒研究[M]. 北京: 中国农业出版社, 2007:1-2;6-7;123-124;302-303;356-359;376.
[3]孙子龙.氟中毒动物生殖毒性研究[M]. 北京: 中国轻工业出版社, 2016:6-8;10;96.
[4]王俊东.环境兽医学(第二版)[M]. 北京: 中国农业出版社, 2016:389-415.
[5]卫生部, 发展改革委, 财政部.全国地方病防治“十二五”规划, 2012
[6]Barbier O, Arreola-Mendoza L, Del Razo LM. Molecular mechanisms of fluoride toxicity[J]. ChemBiol Interact,2010, 188 (2):319-333.
[7]Jagtap S, Yenkie MK, Labhsetwar N, et al. Fluoride in drinking water and defluoridation of water[J]. Chem Rev,2012, 112 (4):2454-2466.
[8]Perumal E, Paul V, Govindarajan V, et al. A brief review on experimental fluorosis[J]. ToxicolLett,2013, 223 (2):236-251.
[9]Denbesten P, Li W. Chronic fluoride toxicity: dental fluorosis[J]. Monogr Oral Sci,2011(22):81-96.
[10]Li WT, Yang LF, Zhou BH, et al. Effect of industrial fluoride pollution on COL2A1 gene expression in rib cartilage of Inner Mongolia cashmere goats[J]. Fluoride,2006, 39 (4):285-292.
[11]Wang JD, Zhan CW, Chen YF, et al. A study of damage to hard tissues of goats due to industrial fluoride pollution[J]. Fluoride,1992, 25 (3):123-130.
[12]Yan X, Feng C, Chen Q, et al. Effects of sodium fluoride treatment in vitro on cell proliferation, apoptosis and caspase-3 and caspase-9 mRNA expression by neonatal rat osteoblasts[J]. Arch Toxicol,2009, 83 (5):451-458.
[13]Yan X, Hao X, Nie Q, et al. Effects of fluoride on the ultrastructure and expression of Type I collagen in rat hard tissue[J]. Chemosphere,2015(128):36-41.
[14]Zhao Y, Li Y, Gao Y, et al. TGF-beta1 acts as mediator in fluoride-induced autophagy in the mouse osteoblast cells[J]. Food ChemToxicol,2018(115):26-33.
[15]Wang JD, Hong JH, Li JP, et al. Effect of high fluoride and low protein on tooth matrix development in goats[J]. Fluoride,2002, 35 (1):51-55.
[16]Yan X, Morrison A, Han T, et al. Fluoride induces apoptosis and alters collagen I expression in rat osteoblasts[J]. ToxicolLett,2011, 200 (3):133-138.
[17]Wang JD, Ge YM, Ning HM, et al. Effects of high fluoride and low iodine on biochemical indexes of the brain and learning-memory of offspring rats[J]. Fluoride,2004, 37 (3):201-208.
[18]牛瑞燕.氟神经毒性研究[M]. 北京: 中国轻工业出版社, 2015:17-21.
[19]Choi AL, Sun G, Zhang Y, et al. Developmental fluoride neurotoxicity: a systematic review and meta-analysis[J]. Environ Health Perspect,2012, 120 (10):1362-1368.
[20]Ge Y, Niu R, Zhang J, et al. Proteomic analysis of brain proteins of rats exposed to high fluoride and low iodine[J]. Arch Toxicol,2011, 85 (1):27-33.
[21]Niu R, Chen H, Manthari RK, et al. Effects of fluoride on synapse morphology and myelin damage in mouse hippocampus[J]. Chemosphere,2018(194):628-633.
[22]Niu R, Liu S, Wang J, et al. Proteomic analysis of hippocampus in offspring male mice exposed to fluoride and lead[J]. Biol Trace Elem Res,2014, 162 (1-3):227-233.
[23]Niu R, Xue X, Zhao Y, et al. Effects of fluoride on microtubule ultrastructure and expression of Tubalpha1a and Tubbeta2a in mouse hippocampus[J]. Chemosphere,2015(139):422-427.
[24]Niu R, Zhang Y, Liu S, et al. Proteome alterations in cortex of mice exposed to fluoride and lead[J]. Biol Trace Elem Res,2015, 164 (1):99-105.
[25]Niu RY, Sun ZL, Cheng ZT, et al. Decreased learning ability and low hippocampus glutamate in rats exposed to fluoride and lead in different developmental stages[J]. Environ Toxicol Phar,2009, 28 (2):254-258.
[26]Long H, Jin Y, Lin M, et al. Fluoride toxicity in the male reproductive system[J]. Fluoride,2009, 42 (4):260-276.
[27]Su K, Sun Z, Niu R, et al. Cell cycle arrest and gene expression profiling of testis in mice exposed to fluoride[J]. Environ Toxicol,2017, 32 (5):1558-1565.
[28]Sun Z, Li S, Yu Y, et al. Alterations in epididymal proteomics and antioxidant activity of mice exposed to fluoride[J]. Arch Toxicol,2018, 92 (1):169-180.
[29]Sun Z, Liu C, Li S, et al.iTRAQ- based proteomic analysis of testis from mice exposed to fluoride[J]. Fluoride,2017, 50(1):15-28.
[30]Sun Z, Niu R, Wang B, et al. Fluoride-induced apoptosis and gene expression profiling in mice sperm in vivo[J]. Arch Toxicol,2011, 85 (11):1441-1452.
[31]Sun Z, Zhang W, Li S, et al. Altered miRNAs expression profiling in sperm of mice induced by fluoride[J]. Chemosphere,2016(155):109-114.
[32]Huo M, Han H, Sun Z, et al. Role of IL-17 pathways in immune privilege: a RNA deep sequencing analysis of the mice testis exposure to fluoride[J]. Sci Rep,2016(6):32173.
[33]Sun Z, Nie Q, Zhang L, et al. Fluoride reduced the immune privileged function of mouse Sertoli cells via the regulation of Fas/FasLsystem[J]. Chemosphere,2017(168):318-325.
[34]Zhang J, Li Z, Qie M, et al. Sodium fluoride and sulfur dioxide affected male reproduction by disturbing blood-testis barrier in mice[J]. Food ChemToxicol,2016(94):103-111.
[35]Zhang J, Zhu Y, Shi Y, et al. Fluoride-induced autophagy via the regulation of phosphorylation of mammalian targets of rapamycin in mice leydigcells[J]. J Agric Food Chem,2017, 65 (40):8966-8976.
[36]Lu Z, Wang S, Sun Z, et al. In vivo influence of sodium fluoride on sperm chemotaxis in male mice[J]. Arch Toxicol,2014, 88 (2):533-539.
[37]Sun Z, Niu R, Su K, et al. Effects of sodium fluoride on hyperactivation and Ca2+ signaling pathway in sperm from mice: an in vivo study[J]. Arch Toxicol,2010, 84 (5):353-361.
[38]Ma H, Shi Z, Dong Y, et al. Effect of fluoride on endocytosis and surface marker expression levels of mouse B cells in vitro[J]. Cell PhysiolBiochem,2016, 39 (2):596-603.
[39]Zhou BH, Wang HW, Wang JM, et al. Effects of malnutrition and supplemented nutrition on nonspecific immune function changes induced by fluoride in rabbits[J]. Fluoride,2007, 40 (3):169-177.
[40]Gooch BF. U.S. Public Health Service Recommendation for Fluoride Concentration in Drinking Water for the Prevention of Dental Caries[J]. Public Health Rep,2015, 130 (4):318-331.
[41]沈雁峰, 孙玉富. 饮水氟化研究进展[J]. 中国地方病学杂志,2003, 22 (7):27-28.
[42]https://en.wikipedia.org/wiki/Water_fluoridation. 2018.
[43]Wei Z, Wei Y. Fluoridation in China: a clouded future[J]. Fluoride,2002, 35 (1):1-4.
[44]Wang JD, Hong JP, Li JX. Studies on alleviation of industrial fluorosis in Baotou goats[J]. Fluoride,1995, 28 (3):131-134.
[45]Wang JD, Hong JH, Li JX, et al. The effect of nutrition supplementation during the annual dry grass season on tooth wear in industry-fluorosedgoats[J]. Fluoride,1994, 27 (3):136-140.
[46]Wang JM, Niu RY, Sun ZL, et al. Effects of protein and calcium supplementation on bone metabolism and thyroid function in protein and calcium deficient rabbits exposed to fluoride[J]. Fluoride, 2008, 41 (4):283-291.
[47]Yan XY, Li WT, Zhou BH, et al. Effect of supplemented protein and Ca nutrition on fluoride-induced disturbance of rib COL1A1 gene expression in rabbits[J]. Fluoride,2007, 40 (2):140-148.
[48]He Y, Niu RY, Wang JM, et al. Effects of protein versus calcium supplementation on bone metabolism and development in fluoride-exposed offspring rats fed protein- and calcium-deficient diets[J]. Fluoride, 2008, 41 (3):192-198.

