不同品种小鼠实验性自身免疫性睾丸炎模型的建立
吴盼红,吕晓倩,裴雪静,孙子龙,王俊东
(山西农业大学 动物科技学院,山西 太谷 030801)
生殖细胞抗原是被认定的自身抗原之一。对于睾丸来说,由于曲细精管内的生殖细胞受到血睾屏障的保护而独立于自身免疫系统之外,所以睾丸是一个免疫豁免器官。一旦血睾屏障破坏,生殖细胞抗原暴露将引发强烈的自身免疫性睾丸炎症,致使生精障碍,导致免疫性雄性不育[1]。实验性自身免疫性睾丸炎(experimental autoimmune orchitis,EAO)模型是人类自身免疫性睾丸炎的动物模型,是一种慢性炎症模型,有助于阐明睾丸损伤的发病机制,在睾丸炎的研究中有着重要的作用[2]。迄今为止,有多种方法可以诱导EAO模型的产生。Tung等[3]用完全弗氏佐剂乳化的睾丸匀浆和百日咳波氏杆菌免疫注射小鼠诱导EAO,这是在大鼠和小鼠上建立EAO的常用方法。Terayama等[4]研究证明,在小鼠腹腔或皮下空间放置TEV(睾丸、附睾以及输精管)足以诱导小鼠睾丸产生EAO。刘争辉等[5]用完全弗氏佐剂乳化的睾丸匀浆在小鼠腘淋巴结附近免疫注射成功诱导EAO。Itoh、Kuerban等[6~8]用无佐剂的同系睾丸生殖细胞主动免疫小鼠,成功建立EAO模型。Musha等[9]研究证明,佐剂处理可以增强机体对抗睾丸抗原的免疫应答,有助于建立EAO模型。本试验对ICR、BALB/C以及C57三种品系的雄性小鼠皮下注射完全弗氏佐剂乳化的睾丸匀浆,通过对小鼠精子密度以及睾丸损伤程度的分析,来判断这3种品系小鼠EAO模型的建立情况。
1 材料与方法
1.1 材料
CFA购自Sigma公司;Bouin’s固定液与HE染色试剂盒购自索莱宝公司;血球计数板、伊红、无水乙醇、二甲苯及石蜡均为实验室常规试剂。
1.2 完全弗氏佐剂乳化的同系睾丸匀浆的制备
不同品系小鼠脱颈处死,消毒后取小鼠双侧睾丸,并用PBS洗涤;在含有冷的PBS的平皿中小心撕去睾丸白膜,室温轻微震荡15 min后,冰浴匀浆;然后200目尼龙布过滤,400 g离心15 min;用PBS洗涤3次后,并重悬于PBS中;台盼蓝染色计数活细胞后,调至1x108个·mL-1;最后把制得的匀浆与CFA等体积混合制得完全弗氏佐剂乳化的同系睾丸匀浆[5,10]。
1.3 试验动物及处理
由中国辐射防护研究所提供8~9周龄的ICR、BALB/C以及C57三种品系的雄性小鼠各12只,适应一周,然后把各品系小鼠随机分为对照组与EAO组,每组6只。对照组小鼠皮下注射完全弗氏佐剂乳化的PBS;EAO组小鼠皮下注射完全弗氏佐剂乳化的同系睾丸匀浆0.2 mL,注射3次,每次间隔2周。所有小鼠自由采食与饮水,并保证合适的温度与湿度。在第一次免疫注射50 d后,脱颈处死小鼠,取附睾尾与输精管检测精子密度;取小鼠睾丸制作切片,HE染色后用于组织病理学观察,判断EAO的严重程度[5]。
1.4 精液品质检测
1.4.1 精子密度检测
取出小鼠附睾尾与输精管,剔除表面脂肪,立刻放于盛有1 mL 37℃PBS的培养皿中,剪碎附睾尾并用注射器冲出精子,制成精子悬液放入1.5 mL EP管中。把盖玻片盖于计数板上,用移液枪吸入少量精子悬液,从盖玻片边缘滴入计数板;在显微镜下,依据红细胞计数法,计数中央大格内5个中方格的精子总数。
1.4.2 精子活力检测
参考《世界卫生组织人类精液及精子——宫颈粘液相互作用实验室检验手册》[11]中的分级标准,将精子活动状态分为4个等级。Ⅰ:精子活动良好,呈快速、活泼的直线前向运动;Ⅱ:精子能活动,但方向不明确,呈快速或迟钝的直线或非直线前向运动;Ⅲ:精子活动不良,原地打转或旋转,前向运动能力差;Ⅳ:精子不活动。高倍镜下(×400)连续计数200个精子,并记录不同活动等级的精子数。按下式计算精子活力:精子活力/%=Ⅰ+Ⅱ/(Ⅰ+Ⅱ+Ⅲ+Ⅳ)×100
1.4.3 精子活率检测
采用伊红染色法,对精子活率进行检测。迅速吸取精子悬液10 μL滴于干净的载玻片上,加入等体积的1%伊红,充分混匀后覆以盖玻片,染色1 min,死精子为红色,活精子不着色。高倍镜下(×400)计数200个精子,计算精子活率。
1.5 睾丸组织病理学
取出小鼠睾丸放于Bouin’s组织固定液中,4 ℃固定24 h,切取3~4 mm厚的组织块,流水冲洗。放于70%无水乙醇中8 h,中间换液2~3次,依次放入80%、90%、95%与100%的梯度无水乙醇脱水,然后二甲苯透明,常规浸蜡包埋,制成5 μm厚的石蜡切片,进行常规HE染色,中性树胶封片。切片晾干后,光学显微镜下拍照观察,进行睾丸组织病理学分析。
1.6 数据分析
试验结果用平均数±标准差表示。对照组与EAO组的差异显著性用GraphPad Prism 5软件的t检验进行分析。
2 结果
2.1 精液质量检测结果
由图1可知,各品系小鼠的EAO组与同品系的对照组(control)相比,ICR与C57小鼠的EAO组,精子密度无显著变化;BALB/C小鼠的EAO组,精子密度显著降低(P<0.05)。3种品系小鼠EAO组的精子活力和活率都显著降低。
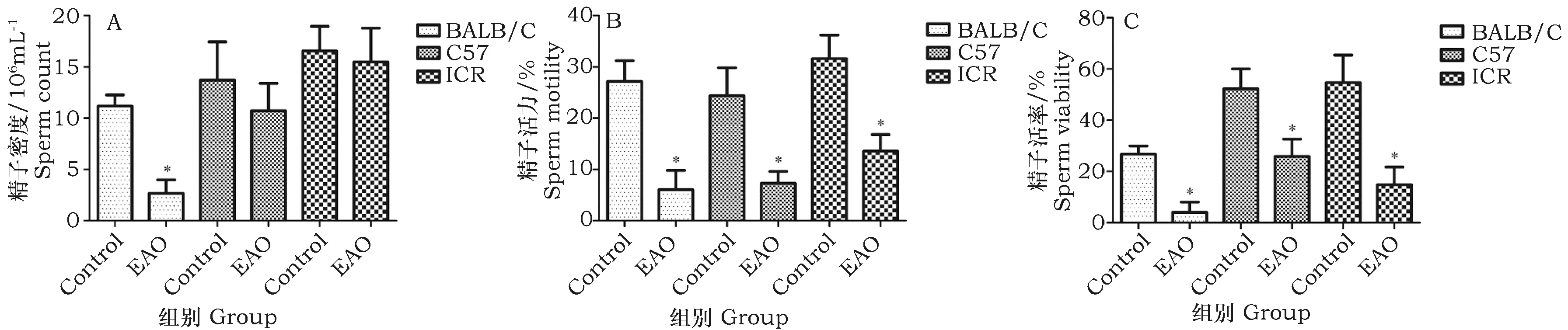
图1 精液质量状况(*表示与同系对照组相比差异显著,P<0.05)Fig.1 Semen quality status(*indicated significant difference at P<0.05 between control and EAO group)
2.2 睾丸形态学损伤程度
对各品系小鼠睾丸组织切片进行HE染色后,400x光学显微镜下观察,与对照组相比,BALB/C小鼠EAO组的睾丸损伤严重,曲细精管损坏严重,生殖细胞大量脱落,甚至出现曲细精管里只有支持细胞的现象,并且睾丸间质大量浸润的炎性细胞,表现出严重的EAO(图2A、2D);ICR小鼠EAO组的睾丸损伤不太明显,曲细精管损坏不太明显,细胞排列有些紊乱,并可观察到部分曲细精管生精上皮脱落(图2B、2E);C57小鼠EAO组的睾丸损伤也不太明显,曲细精管损坏不太明显,曲细精管里可以观察到生殖细胞排列紊乱松散,伴有少量的细胞脱落,并且可以观察到一些凋亡的细胞(图2C、2F)。
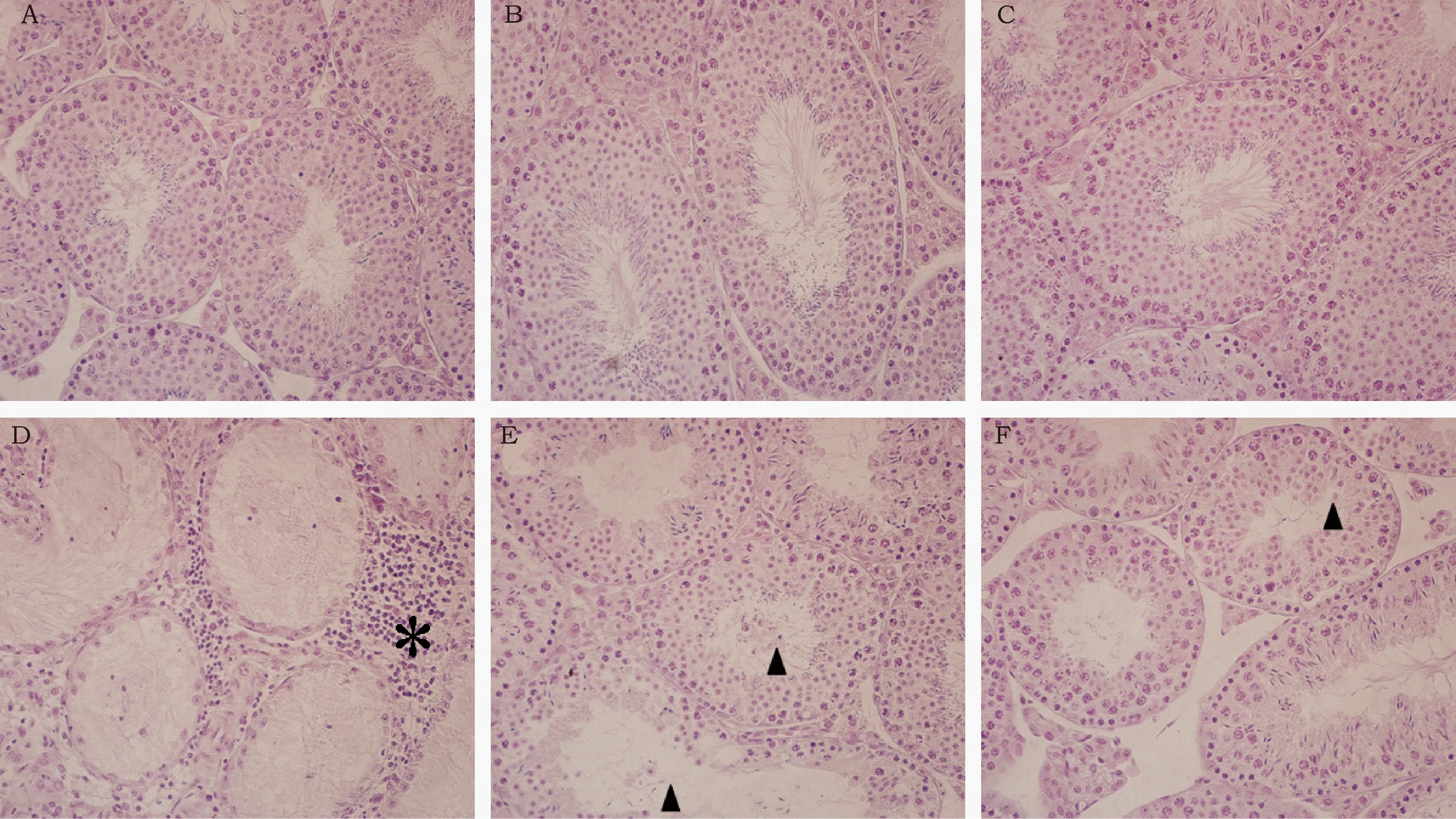
图2 小鼠睾丸HE染色结果(HE,400x)Fig.2 Results of HE staining of testis in mice 注:图A、B、C依次为BALB/C、ICR、C57小鼠的对照组,图D、E、F依次为BALB/C、ICR、C57小鼠的EAO组。星号表示炎性细胞浸润,箭头表示生殖细胞脱落。Note: A, B and C represented the control groups of BALB / C, ICR and C57 mice, respectively; D, E and F represented the EAO groups of BALB / C, ICR and C57 mice, respectively. Asterisk indicates invasion of inflammatory cells and arrowhead points to germ cell shedding.
3 讨论
虽然睾丸是一个在生理条件下使雄性生精过程免受免疫反应的屏障,但某些病理刺激可能会引起机体免疫系统对雄性生殖细胞抗原的免疫反应,从而导致自身免疫性睾丸炎,从而导致雄性免疫性不育[5]。EAO模型是一个研究慢性睾丸炎发病机理的重要模型,研究人员经常用生精细胞、全精子、睾丸或附睾提取物和佐剂共同免疫大鼠或小鼠而获得EAO模型[5,12]。精子生成减少,生殖细胞的凋亡,生精上皮脱落,炎性细胞的浸润,这些都是EAO的特征[13]。本试验睾丸组织病理学的观察结果与以上EAO的特征有一定相似之处。
本试验BALB/C小鼠EAO组的精子密度、精子活力和活率都显著降低,睾丸损伤严重,曲细精管损坏严重,生殖细胞大量脱落,甚至出现曲细精管里只有支持细胞的现象,并且睾丸间质大量浸润的炎性细胞,产生严重EAO,这与Silva、Nicolas、Qu等[14~16]用BALB/C小鼠制造EAO模型观察到的精液品质以及组织学病理变化是相一致的。Tokunaga等[17]用同系睾丸生殖细胞免疫多种小鼠建立EAO模型,发现C57小鼠建模率低,睾丸炎症轻微,这与本实验的结果C57小鼠EAO组的睾丸损伤不太明显是相一致的。Terayama等[4]在A/J、C3H/He、ICR三种小鼠腹部皮下放置TEV来建立EAO模型,发现ICR小鼠不以建立EAO模型,这与本文的结果是相似的。
对于纯系小鼠,无论是否添加免疫佐剂,单次或两次将同种系的睾丸匀浆注入皮下,与自体移植类似,仅可以在某些易感品系的小鼠上建立EAO模型,不易感品系的小鼠都不发生或极少发生免疫排斥反应,这可能就是BALB/C品系的小鼠比其他两种小鼠容易建造EAO模型的原因之一[18]。
4 结论
从试验结果可以看出,在BALB/C、ICR与C57小鼠上诱导EAO,3种品系小鼠在精液质量与睾丸病理学方面都表现出一定的变化。而且相比于其他品系小鼠,BALB/C小鼠的EAO组表现出严重的EAO。由此表明,BALB/C品系的小鼠比ICR与C57小鼠更易诱导EAO。
参 考 文 献
[1]冯雪莹, 韩代书. 睾丸炎[J]. 中国组织化学与细胞化学杂志, 2010, 19(5): 503-507.
[2]Jacobo P, Guazzone V A, Theas M S, et al. Testicular autoimmunity[J]. Autoimmunity Reviews, 2011, 10(4): 201-204.
[3]Tung K S K, Harakal J, Qiao H, et al. Egress of sperm autoantigen from seminiferous tubules maintains systemic tolerance[J]. Journal of Clinical Investigation, 2017, 127(3): 1046-1060.
[4]Terayama H, Itoh M, Naito M, et al. Experimental model of autoimmune orchitis with abdominal placement of donor's testes, epididymides, and vasa deferentia in recipient mice[J]. Journal of Reproductive Immunology, 2011, 90(2): 195-201.
[5]Liu Z, Zhao S, Chen Q, et al. Roles of Toll-like receptors 2 and 4 in mediating experimental autoimmune orchitis induction in mice[J]. Biology of Reproduction, 2015, 92(3): 63.
[6]Itoh M, Hiramine C, Hojo K. A new murine model of autoimmune orchids induced by immunization with viable syngeneic testicular germ cells alone. I. Immunological and histological studies[J]. Clinical and Experimental Immunology, 1991, 83(1): 137-142.
[7]Itoh M, De-Rooij D, Takeuchi Y. Mode of inflammatory cell infiltration in testes of mice injected with syngeneic testicular germ cells without adjuvant[J]. Journal of Anatomy, 1995, 187(Pt 3): 671-679.
[8]Kuerban M, Naito M, Hirai S, et al. Involvement of Fas/Fas‐L and Bax/Bcl‐2 systems in germ cell death following immunization with syngeneic testicular germ cells in mice[J]. Journal of Andrology, 2012, 33(5): 824-831.
[9]Musha M, Hirai S, Naito M, et al. The effects of adjuvants on autoimmune responses against testicular antigens in mice[J]. Journal of Reproduction and Development, 2013, 59(2): 139-144.
[10]王文军, 陈系古, 杨冬梓, 等. BALB/c 鼠自身免疫性睾丸炎动物模型的制作[J]. 中山大学学报(医学科学版), 2006, 27(2): 148-152.
[11]世界卫生组织. WHO人类精液及精子—宫颈粘液相互作用实验室检验手册[M].北京:人民卫生出版社. 2001:21-55.
[12]Naito M, Terayama H, Hirai S, et al. Experimental autoimmune orchitis as a model of immunological male infertility[J]. Medical Molecular Morphology, 2012, 45(4): 185-189.
[13]Parker G A. Immunopathology in Toxicology and Drug Development[M]. Humana Press, Springer International Publishing, 2017:515-518.
[14]Silva C A, Cocuzza M, Carvalho J F, et al. Diagnosis and classification of autoimmune orchitis[J]. Autoimmunity Reviews, 2014, 13(4-5): 431-434.
[15]Nicolas N, Michel V, Bhushan S, et al. Testicular activin and follistatin levels are elevated during the course of experimental autoimmune epididymo-orchitis in mice[J]. Scientific Reports, 2017(7): 42391.
[16]Qu N, Terayama H, Hirayanagi Y, et al. Induction of experimental autoimmune orchitis by immunization with xenogenic testicular germ cells in mice[J]. Journal of Reproductive Immunology, 2017(121):11-16.
[17]Tokunaga Y, Hiramine C, Itoh M, et al. Genetic susceptibility to the induction of murine experimental autoimmune orchitis (EAO) without adjuvant. I. Comparison of pathology, delayed type hypersensitivity, and antibody[J]. Clinical Immunology and Immunopathology, 1993, 66(3): 239-247.
[18]Li N, Liu Z, Zhang Y, et al. Mice lacking Axl and Mer tyrosine kinase receptors are susceptible to experimental autoimmune orchitis induction[J]. Immunology and Cell Biology, 2015, 93(3): 311-320.

