糜子Ty1-copia型反转录转座子基因的序列特征及表达分析
何杰丽,薛延桃,王瑞云,*,陈国荣,陈凌,王海岗,杨美红*,乔治军*
(1.山西农业大学 文理学院,山西 太谷 030801;2.山西农业大学 农学院,山西 太谷 030801;3.山西省农业科学院 农作物品种资源研究所/农业部黄土高原作物基因资源与种质创制重点实验室/杂粮种质资源发掘与遗传改良山西省重点实验室,山西 太原 030031)
糜子(PanicummiliaceumL.),属禾本科黍属,抗逆性强,是干旱半干旱地区主粮作物[1、2]。反转录转座子是植物基因组中普遍存在的一类遗传因子,以DNA-RNA-DNA的转座机制在植物基因组中移动,从而影响基因组变化和基因表达[3]。根据功能不同植物中反转录转座子包括两大类,长末端重复序列(LTRs,long terminal repeats)和非长末端重复序列(non-LTRs,no-long terminal repeats)[4]。Non-LTR包括PLE类型(PLE)、DIRS类型(DIRS)、短散布重复序列(SINE,short interspersed repetitive element)以及长散布重复序列(LINE,long interspersed repetitive element)[5];LTR包括Ty1-copia和Ty3-gypsy两种类型[6],含3个基因,分别为聚合酶基因(pol)、特异抗原基因(gag)、整合酶基因(int)。Ty1-copia和Ty3-gypsy两类反转录转座子结构和功能相似,主要区别为pol基因区域中INT基因插入的位置不同。一般情况下反转录转座子由于缺失、移框和终止子等原因,不能形成反转录转座子蛋白,不具生物学活性,呈静止状态。病毒、细菌、真菌病原接种[7~9]以及水杨酸、茉莉酸甲酯[10]等生物和非生物胁迫后,不活跃的LTR在植物受到转录激活。在生物和非生物胁迫下,植物反转录转座子被激活以参与调节抗逆相关基因表达,反转录转座的发生可能与植物自我防卫反应有关,是植物保护自我的反应机制[11]。
糜子中参与干旱胁迫应答的相关基因有很多[12~14],但关于糜子Ty1-copia基因是否参与干旱胁迫应答、其表达特性如何尚未见报道。本研究利用生物信息学软件预测了Ty1-copia编码蛋白的生化特性,用qRT-PCR对其在植株叶片不同胁迫时间处理后目标基因的表达水平做了分析。旨在为利用Ty1-copia基因改良作物抗旱性及分子育种提供理论依据。
1 材料与方法
1.1 试验材料
试验材料为黄糜子(00005272),由山西省农业科学院农作物品种资源研究所提供。前期转录组测序发现糜子cDNA文库中的一段DNA序列,根据Swissprot、nr、nt三个数据库注释可知该序列所编码的蛋白是反转录转座子蛋白。该基因表达分析的材料培养方法同王瑞云[12],利用20% PEG-6000蒸馏水溶液进行干旱胁迫处理,分别于处理后0、3、6和8 h取样。
1.2 Ty1-copia型反转录转座子基因编码蛋白的生物信息学分析
在NCBI中,用ORF Finder在线软件(http://www.ncbi.nlm.nih.gov/ projects/gorf/)预测开放阅读框并翻译蛋白质序列;用ProtParam(http://web.expasy.org/protparam/)在线分析软件预测蛋白质的理化性质;用SignalP2.0(http://www.cbs.dtu.dk/services/SignalP/)在线分析软件对蛋白进行信号肽预测;用YinOYang 1.2(http://www.cbs.dtu.dk/services/)在线软件预测蛋白的葡萄糖-O糖基化位点;用NetNES(http://www.cbs.dtu.dk)在线软件分析该蛋白有无核输出信号;用TargetP(http://www. cbs.dtu.dk /services/TargetP)、ChloroP(http:// www.cbs.dtu.dk/services/ChloroP)在线软件对该蛋白进行亚细胞定位预测;用Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html)在线程序对反转录转座子蛋白进行二级结构和三级结构的预测;用TMHMM-2.0(http://www.cbs.dtu.dk/services/TMHMM/)在线软件对该蛋白的跨膜螺旋结构进行预测;用DNAMAN(version 8.0) 和MEGA(version 7.0.21进行序列多重比较并构建系统进化树;用MEME在线软件(http://meme-suite.org/)预测反转录转座子蛋白的保守结构。
1.3 Ty1-copia型反转录转座子基因的实时荧光定量表达分析
采用TRIzon总RNA提取试剂盒(CW0580S)提取叶片总黄糜子叶片RNA,并通过1%琼脂糖凝胶电泳检测RNA质量。采用PrimeScript© RT Master Mix试剂盒(TaKaRa,大连)反转录合成第一链cDNA,保存于-20 ℃ 冰箱。用Primer5软件设计特异引物(F:5'- CTCAGTCAGCGAGGTTAT -3',R:5'-ACGAGAACAGACCATAGC-3')与内参引物ACT(F:ACCGAAGCCCCTCTTAACCC,R:5'-GTATGGCTGACACCATCACC-3')[15]并由上海生工生物工程技术服务有限公司合成。
以 cDNA为模板进行实时荧光定量PCR 扩增,反应体系为10 μL,包括模板(糜子cDNA)1 μL,SYBR Premix EX Taq II (Tli RnaseH Plus)(2×) 5 μL,50×ROX 0.2 μL,前后引物(10 μmol·L-1)各0.4 μL,ddH2O 3 μL。PCR反应程序:95 ℃预变性5 min;94 ℃变性10 s,58 ℃退火20 s,72 ℃延伸1 min,39个循环;反应结束后确认实时定量PCR的扩增曲线和熔解曲线,利用2-△△CT法[16]计算基因在不同样品中的相对表达量。不同样品间差异显著性用DPS软件中的one-way ANOVA中的Duncan多重比较进行统计分析每个样品3次生物学重复,3次技术重复。
2 结果与分析
2.1 序列分析
Ty1-copia型反转录转座子蛋白的cDNA序列包含285 bp的完整开放阅读框,编码94个氨基酸,5’端有一个起始密码子ATG,编码甲硫氨酸(M),3’端有一个终止密码子ATT,不编码氨基酸(图1)。该蛋白的理化性质(表1),是由19种氨基酸组成(色氨酸含量为0),其中亮氨酸(L)和丝氨酸(S)含量较高,分别为10.6%和11.7%;谷氨酰胺(Q)、组氨酸(H)和苏氨酸(T)3种氨基酸含量较少,均为1.1%;带8个负电荷氨基酸,带12个正电荷氨基酸,说明该蛋白总体呈弱碱性;不稳定系数、总平均亲水性、脂肪系数说明该蛋白是不稳定的疏水蛋白。

表1 Ty1-copia蛋白的理化性质Table 1 Physicochemical properties of Ty1-copia protein

图1 Ty1-copia型反转录转座子蛋白的核苷酸和预测的氨基酸序列Fig.1 Nucleotide and predicted amino acid sequences of Ty1-copia type retrotransposon protein
2.2 信号肽预测
SignalP2.0在线软件(http://www.cbs.dtu.dk/services/SignalP/)预测Ty1-copia型反转录转座子蛋白信号肽序列,结果显示信号肽可能性为0.00,信号锚序列可能性为0.049,最大切割位点可能性为0.00(图2),说明该蛋白无信号肽,可能是非分泌型蛋白,在细胞膜内表达。

图2 Ty1-copia型反转录转座子蛋白的信号肽预测Fig.2 Signal peptide prediction of Ty1-copia type retrotransposon protein
2.3 葡萄糖-O糖基化位点的预测
YinOYang 1.2在线软件(http://www.cbs.dtu.dk/services/)预测Ty1-copia型反转录转座子蛋白的葡萄糖-O糖基化位点,结果显示该蛋白有四个葡萄糖-O-糖基化位点,分别为48位的丝氨酸(S)、78位的丝氨酸(S)、93位的丝氨酸(S)和94位的丝氨酸(S),其中48位和78位的丝氨酸是葡萄糖-O糖基化位点的可能性较大(图3)。糖基化位点与细胞的信号通路有着密切联系,所以进一步说明该蛋白在细胞内表达。
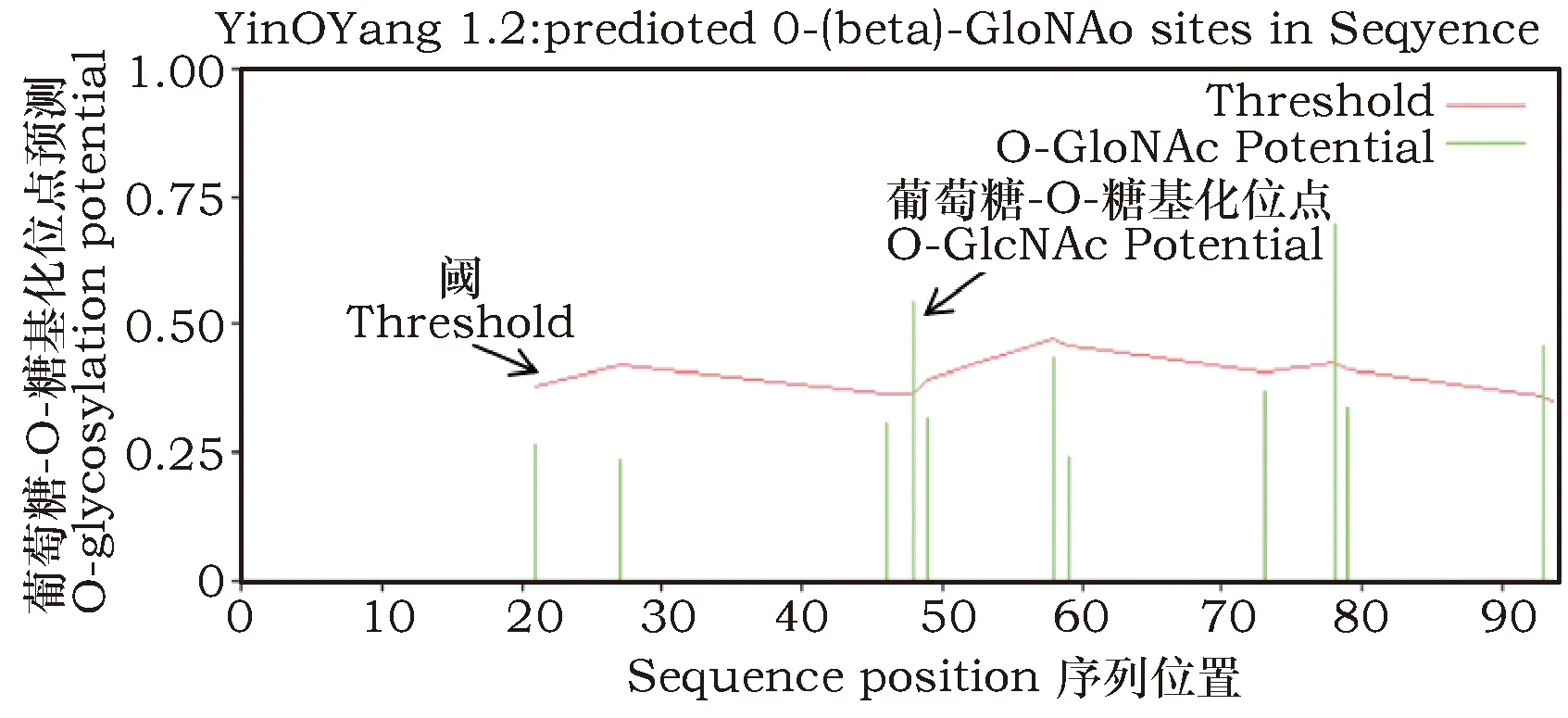
图3 Ty1-copia型反转录转座子蛋白的葡萄糖-O-糖基化位点预测Fig.3 Glucose-O-glycosylation site prediction of Ty1-copia type retrotransposon protein
2.4 核输出信号分析
NetNES(http://www.cbs.dtu.dk)在线软件分析Ty1-copia型反转录转座子蛋白有无核输出信号,结果显示该蛋白质的第13位的缬氨酸(V)和第15位的异亮氨酸(I)的NES-Score均超过阈值(图4),该氨基酸即为反转录转座子蛋白的核输出信号,表明该蛋白质定位于细胞质。

图4 Ty1-copia型反转录转座子蛋白的核定位信号预测Fig.4 Nuclear localization signal prediction of Ty1-copia type retrotransposon protein
2.5 亚细胞定位
ChloroP(http:// www.cbs.dtu.dk/services/ChloroP)和TargetP(http://www. cbs.dtu.dk /services/TargetP)在线软件对Ty1-copia型反转录转座子蛋白进行亚细胞定位,结果显示该蛋白叶绿体靶向肽(cTP)值为0.439,mTP(线粒体靶向肽)值为0.185(图5),cTP和mTP值均太低,说明该蛋白质不能定位于叶绿体和线粒体上。

图5 Ty1-copia型反转录转座子蛋白的亚细胞定位Fig.5 Subcellular localization of Ty1-copia type retrotransposon protein
2.6 跨膜螺旋预测
TMHMM-2.0(http://www.cbs.dtu.dk/services/TMHMM/)在线软件对Ty1-copia型反转录转座子蛋白的跨膜螺旋结构预测结果显示,该蛋白无跨膜螺旋结构(图6);有一段跨膜肽链(46位氨基酸到63位氨基酸的肽链),且N-末端在膜外,C-末端在膜内(图7)。
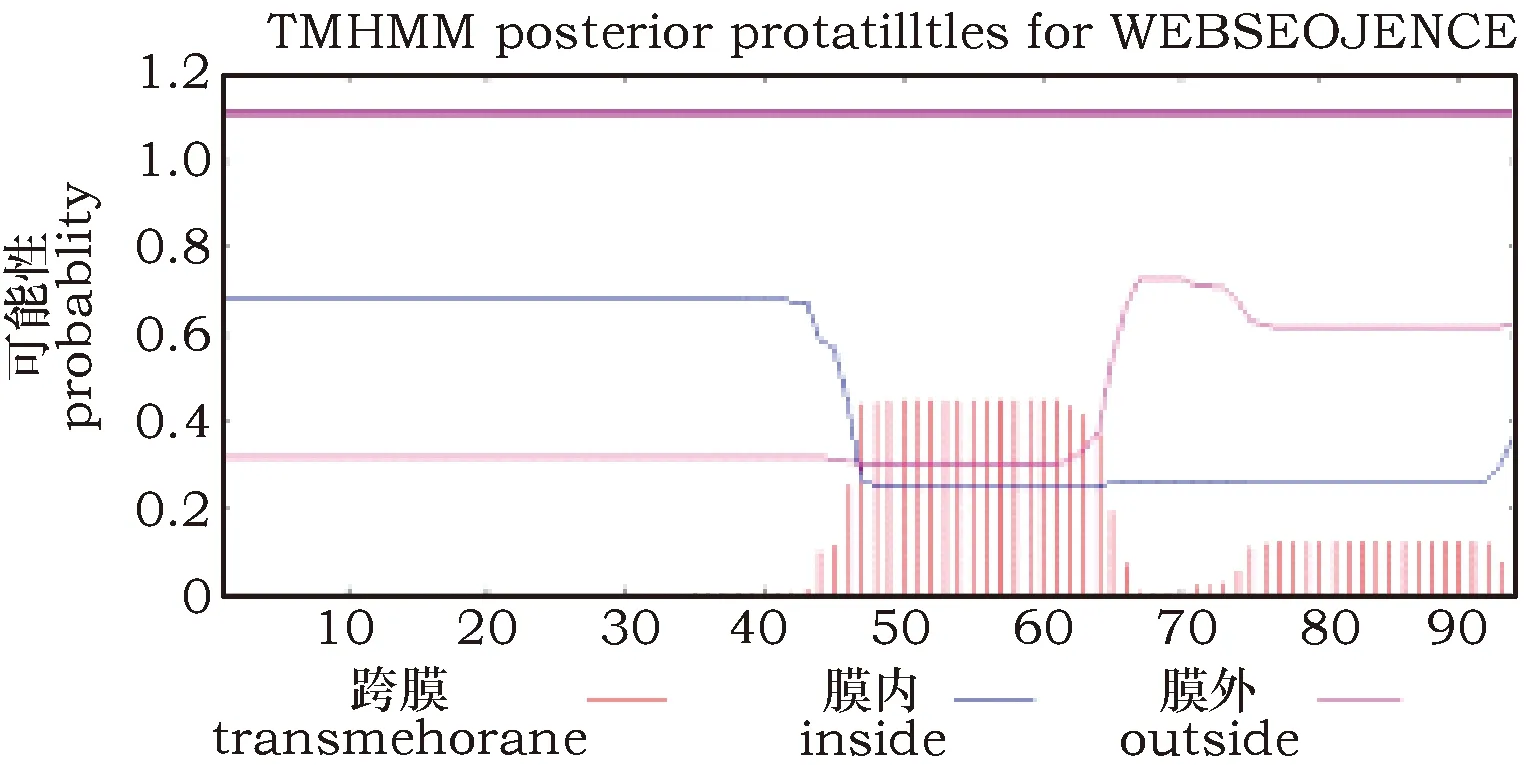
图6 Ty1-copia型反转录转座子蛋白的跨膜螺旋结构预测Fig.6 Transmembrane helix structure prediction of Ty1-copia type retrotransposon protein
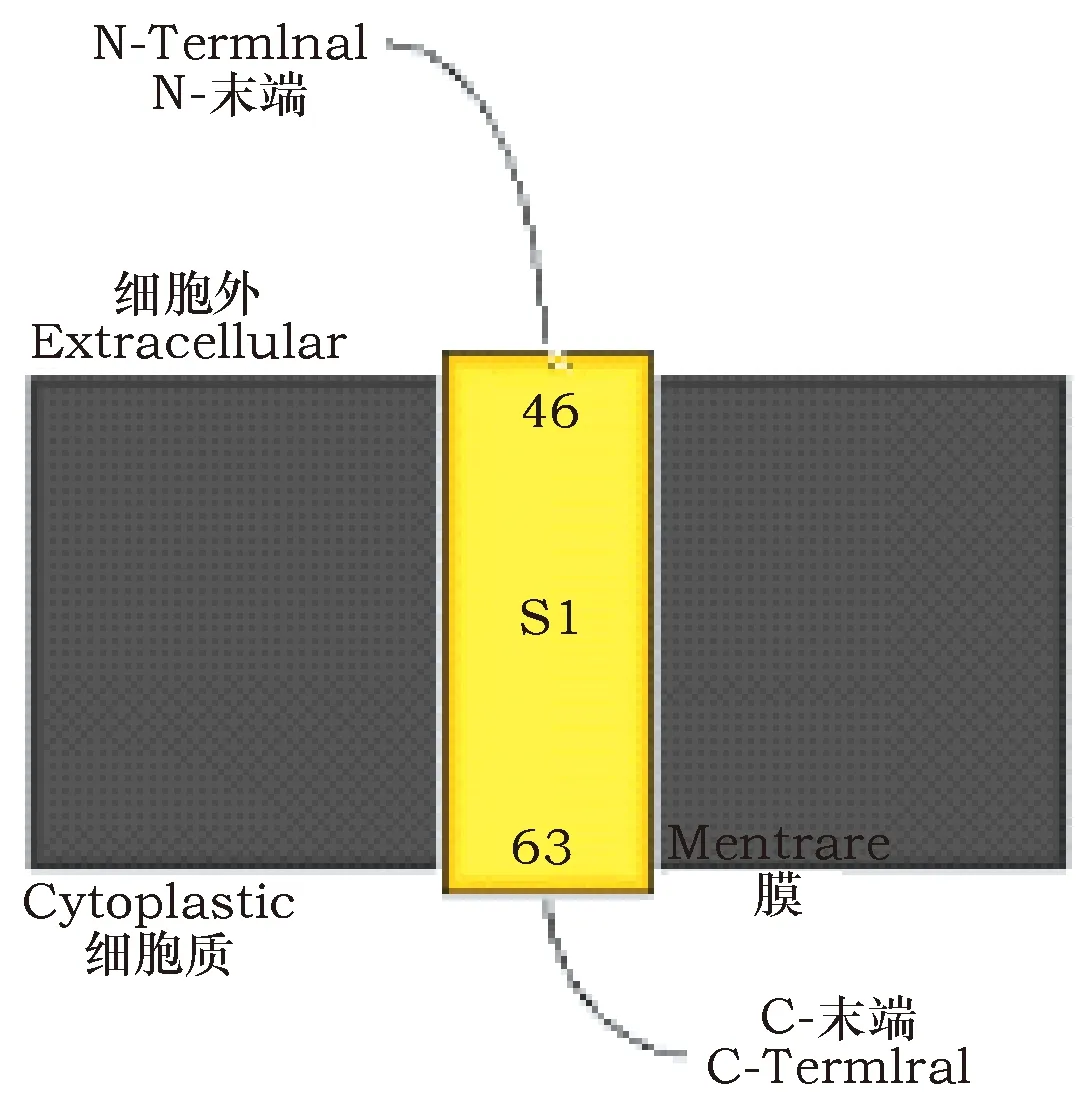
图7 Ty1-copia型反转录转座子蛋白的跨膜肽链Fig.7 Transmembrane peptide chain of Ty1-copia type retrotransposon
2.7 蛋白结构预测
Phyre2在线程序(http://www.sbg.bio.ic.ac.uk/phyre2/html)预测Ty1-copia型反转录转座子蛋白的二级结构和三级结构,结果显示该蛋白包含4个α螺旋和4个β折叠,α螺旋占38%,β 折叠占31%(图8),α螺旋的区域明显大于β折叠的区域,说明α螺旋是该蛋白的大量结构元件;三维结构中红色表示N端,蓝色表示C端,其中有一个明显的螺旋结构和两个明显的折叠结构(图9)。
2.8 保守结构域的预测
MEME(http://meme-suite.org/)在线软件预测Ty1-copia型反转录转座子蛋白的保守结构域,结果显示该蛋白有4个保守结构域,分别是3至8位的5’-NLGAAK-3’、28至33位的5’-QRGYIE-3’、40至45位的5’-NMHDAK-3‘以及81至86位的5’-VDCLMY-3’(图10)。在与水稻、毛竹、辣椒等其他8种作物的多重序列比对中也找到了相关的保守结构(图11)。

图8 Ty1-copia型反转录转座子蛋白的二级结构Fig.8 Secondary structure of Ty1-copia type retrotransposon protein
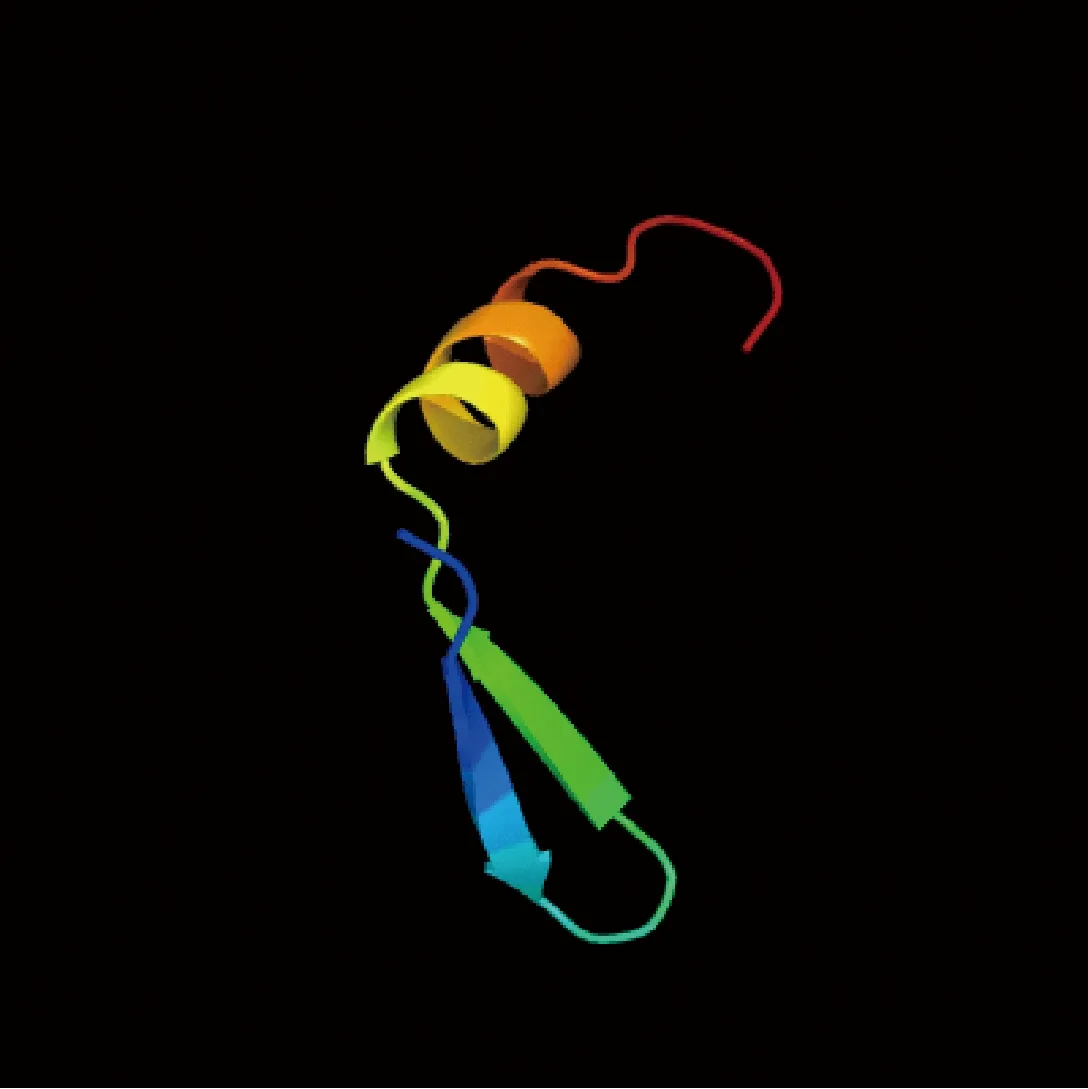
图9 Ty1-copia型反转录转座子蛋白的三级结构Fig.9 Tertiary structure of Ty1-copia type retrotransposon protein

图10 Ty1-copia型反转录转座子蛋白的保守结构域预测Fig.10 Conservative domain prediction of Ty1-copia type retrotransposon protein
2.9 多重序列比对以及系统进化树构建
用DNAMAN(version 8.0) 软件对该蛋白的同源序列进行多重序列比对并构建系统进化树(图11、12)。多重序列比对结果显示各个物种Ty1-copia型反转录转座子蛋白的氨基酸差异较大,相似性只有24.9%,说明该蛋白的保守性不强,在进化过程中发生突变的可能性较大。进化树结果显示糜子的Ty1-copia型反转录转座子蛋白与稻属(粳稻、野生稻、药用稻)和毛竹序列一致性为64%。

图11 9种植物Ty1-copia型反转录转座子蛋白的氨基酸多重序列比对Fig.11 Amino acid multiple sequence comparison of Ty1 - copia type retroviruses of nine plants注:* 表示保守结构。Note: * represents a conservative structure.

图12 9种植物Ty1-copia型反转录转座子蛋白的进化树Fig.12 Evolutionary tree of Ty1-copia type retrotransposon protein of 9 species
2.10 糜子Ty1-copia型反转录转座子基因的表达特性分析
qRT-PCR 分析表明,Ty1-copia表达水平在干旱胁迫处理不同时间点存在显著差异(表2)。3 h时表达量最高,为对照的2.02倍;8 h时该基因呈下调表达,表达量低于对照,说明该基因可以响应干旱胁迫诱导。
3 讨论与结论
植物抗逆反应是植物的一种自我保护,该过程是比较复杂的调控网络,Ty1-copia基因编码转录转座子蛋白在该网络中发挥着至关重要的作用。Ty1-copia基因编码蛋白在某些生物和非生物胁迫下表达,从而激活植物抗逆相关基因表达,提高植物的抗逆性[17]。根据Tnt1[7]和Tto1[18]以及OARE-1[11]通过物理(紫外照射和伤害)以及化学(尤其是水杨酸)胁迫被激活,发现Ty1-copia基因的表达和植物的抗逆性密切相关。我们用PEG模拟干旱胁迫,发现处理3 h时基因表达量是对照的2.02倍,8 h时则呈下调表达,说明Ty1-copia基因可能参与糜子的抗旱性响应。
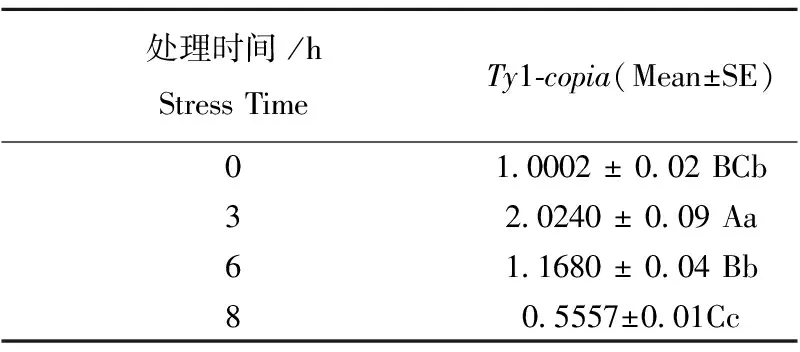
表2 Ty1-copia 基因表达水平Table 2 Expression level of Ty1-copiagene
注:不同大小写字母分别表示差异极显著(P<0.01)和显著(P<0.05)。
Note: Different captial and lowercase letters indicate extremely remarkable and significant difference at 0.01 and 0.05 level, respectively.
江树业等[19]以籽粒苋为材料,克隆并研究了Ty1-copia反转录转座子在籽粒苋中的作用,结果表明在28条克隆序列中存在高度的异质性。周鹏等[20]以梨为材料研究结果类似,克隆的32条序列中也存在异质性,并且发现碱基的替换、缺失、易位导致的突变是其具有异质性的重要原因之一,说明了反转录转座子在进化过程中保守性不高。本研究也对Ty1-copia型反转录转座子蛋白进行了系统的序列特征分析,通过同源性比对,该基因属于RVT-2超家族成员,糜子Ty1-copia型反转录转座子蛋白与大部分单子叶植物聚为一类,相反,与双子叶植物的氨基酸的一致性较低,可见双子叶植物和单子叶植物在Ty1-copia型反转录转座子的遗传进化上存在较大差异,进化过程中保守性不高。
目前本实验室已对糜子种质资源的遗传多样性进行了初步评估[21~23],后续研究将侧重于挖掘和克隆糜子抗旱相关基因,以期为抗旱性遗传改良提供靶标基因。
参 考 文 献
[1]Wang R Y, Hunt H V, Qiao Z J, et al. Diversity and cultivation of broomcorn millet (PanicummiliaceumL.) in China: A Review[J]. Economic Botany, 2016, 70(3): 332-342.
[2]连帅, 王瑞云, 马跃敏, 等. 不同生态区糜子种质资源的遗传多样性分析[J]. 山西农业大学学报(自然科学版), 2015, 35(3):225-231.
[3]虞洪杰. 植物LTR反转录转座子的预测和注释及邻聚法构建系统进化树研究[D]. 杭州:浙江大学, 2011.
[4]Beauregard A, Curcio M J, Belfort M. The take and give between retrotransposable elements and their hosts[J]. Annual Review of Genetics, 2008 (42): 587-617.
[5]蒋爽, 滕元文, 宗宇, 等. 植物LTR反转录转座子的研究进展[J]. 西北植物学报, 2013, 33(11): 2354-2360.
[6]何予卿, 孙梅, 朱英国, 等.Copia类型反转录转座子在籽粒苋中的表现[J]. 遗传学报, 2002, 29(5): 461-466.
[7]Grandbastien M A, Lucas H, Morel J B, et al. The expression of the tobacco Tntl retrotransposon is linked to plant defense responses[J]. Genetica, 1997, 100(1-3): 241-252.
[8]Mhiri C, De Wit P J G M, Grandbastien M A. Activation of the promoter of the Tnt1 retrotransposon in tomato after inoculation with the fungi pathogenCladosporiumfulvum[J]. Molecular Plant Microbe Interations, 1999, 12(7): 592-603.
[9]Beguiristain T, Grandbastien M A, Puigdomènech P, et al. Three Tnt1 subfamilies show different stress-associated patterns of expression in tobacco: consequences for retrotransposon control and evolution in plants[J]. Plant Physiology, 2001, 127(1): 212-221.
[10]Niggeweg R, Thurow C, Kegler C, et al. Tobacco transcription factor TGA2.2 is the main component ofas-1-binding factor ASF-1 and is involved in salicylic acid- and auxin-inducible expression ofas-1-containing target promoters[J]. Journal of Biological Chemistry, 2000, 275: 19897-19905.
[11]Kimura Y, Tosa Y, Shimada S, et al.OARE-1, aTy1-copiaretrotransposon in oat activated by abiotic and biotic stresses[J]. Plant and Cell Physiology, 2001, 42(12): 1345-1354.
[12]王瑞云, 杨阳, 王海岗, 等. 糜子PmNCED1的克隆及其对PEG胁迫的响应[J]. 核农学报, 2018, 32(2): 244-256.
[13]Wang R Y, Wang H G, Liu X Y, et al. Drought-induced transcription of resistant and sensitive common millet varieties[J]. The Journal of Animal and Plant Sciences, 2017, 27(4): 1303-1314.
[14]王瑞云, 杨阳, 李润植, 等. 抗旱相关基因及其遗传工程[J]. 山西农业大学学报(自然科学版), 2014, 34(4): 289-295.
[15]Van den Berg N, Crampton B G, Hein I, et al. High-throughput screening of suppression subtractive hybridization cDNA libraries using DNA microarray analysis[J]. Biotechniques, 2004, 37(5): 818-824.
[16]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001, 25(4): 402-408.
[17]Grandbastien M A. Activation of plant retrotransposons under stress conditions[J]. Trends in Plant Science, 1998, 3(5): 181-187.
[18]Takeda S, Sugimoto K, Otsuki H,et al. Transcriptional activation of the tobacco retrotransposonTto1 by wounding and methy1 jasmonate[J]. Plant Molecular Biology, 1998, 36(3): 365-376.
[19]江树业, 孙梅, 何予卿, 等. 籽粒苋copia类反转录转座子的初步研究[J]. 福建农林大学学报(自然科学版), 2002, 31(2): 218-222.
[20]周鹏, 张士伟, 翟锐, 等. 梨Ty1-copia反转录转座子的克隆及IRAP分子标记体系的建立[J]. 西北农林科技大学学报(自然科学版), 2016, 44(2):97-104.
[21]王瑞云, 季煦, 陆平, 等. 利用荧光SSR分析中国糜子遗传多样性[J]. 作物学报, 2017, 43(4): 530-548.
[22]王瑞云, 刘笑瑜, 王海岗, 等. 用高基元微卫星标记分析中国糜子遗传多样性[J]. 中国农业科学, 2017, 50(20): 3848-3859.
[23]连帅, 陆平, 乔治军, 等. 利用SSR分子标记研究国内外黍稷地方品种和野生资源的遗传多样性[J]. 中国农业科学, 2016, 49(17): 3264-3275.

