分段调控pH值对阴沟肠杆菌WL1318发酵棉秆水解糖液产氢的影响
屈晓伟,李艳宾,2,张 琴,2*
(1.塔里木大学 生命科学学院,新疆 阿拉尔 843300;2.塔里木大学 塔里木盆地生物资源保护利用兵团重点实验室,新疆 阿拉尔 843300)
氢能是地球上最清洁的终极能源,目前已成为世界各国竞相开发的可再生能源。近年来,通过产氢微生物发酵木质纤维素水解液生产生物氢已引起了广泛地关注[1-5]。其中,产氢微生物在发酵产氢过程中起到了主导作用,自然界的发酵产氢微生物主要包括专性厌氧发酵产氢菌、兼性厌氧发酵产氢菌和需氧发酵产氢菌[6-11]。兼性厌氧发酵产氢菌中的肠杆菌属(Enterobacter)是目前研究最多的产氢细菌,能够通过分解甲酸的代谢途径产氢,即通过混合酸发酵途径产氢[12-13]。该属细菌在发酵产氢过程中会伴随多种有机酸(如乳酸、乙酸等)的产生,使发酵液pH值降低。
pH值是影响发酵产氢过程的重要因素,能影响产氢菌的活力和发酵产氢代谢过程[14]。发酵过程的pH调控直接影响产氢菌一些有机酸类代谢物(如乳酸、乙酸等)的浓度,有利于生物氢的合成[15]。QIU C S等[16]研究了pH和基质浓度对极端嗜热菌群发酵产氢的影响,发现菌群最适的发酵产氢起始pH在中性范围(pH6.0~7.0),在起始pH7.0、木糖质量浓度7.5g/L时获得最高的生物氢产量(1.29 mol H2/mol消耗的木糖)。KHANNA N等[13]调控Enterobacter cloacaeIIT-BT 08发酵葡萄糖产氢过程中pH值恒定为6.5,获得了较高的生物氢产量(3.1 mol H2/mol葡萄糖)、特异产氢潜力
收稿日期:2018-01-26 修回日期:2018-04-26
基金项目:国家自然科学基金资助项目(21406150)
作者简介:屈晓伟(1992-),男,硕士研究生,研究方向为产氢微生物发酵产氢及代谢调控。
*通讯作者:张 琴(1980-),女,副教授,博士,研究方向为产氢微生物及其代谢工程改造。798.1 mL/g)和特异产氢速率(72.1 mL(/L·h·g))。
棉秆是新疆分布最广泛的生物质原料,用棉秆水解糖液发酵产氢已成为棉秆高值化利用的重要方式之一,然而,目前棉秆水解糖液发酵产氢仅限于产氢动力学等基本特性的研究[17],尚未实现对其发酵过程的有效调控。本研究通过研究分段调控pH值对Enterobacter cloacaeWL1318发酵棉秆水解糖液产氢过程中发酵液pH值、生物氢合成、棉秆水解糖液中葡萄糖和木糖利用、菌株生长的影响,以期为有效调控该菌株发酵棉秆水解糖液产氢的过程提供理论指导和技术参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
阴沟肠杆菌(Enterobacter cloacae)WL1318:由塔里木盆地生物资源保护利用兵团重点实验室保藏;棉秆原料:采自新疆阿拉尔棉田,风干、粉碎、过筛后经水解获得水解糖液用于发酵产氢实验。
1.1.2 主要试剂
葡萄糖、木糖、牛肉膏、蛋白胨、3,5-二羟基甲苯(地衣酚)、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、酒石酸钾钠、琼脂粉、重蒸酚:生工生物工程(上海)股份有限公司;NaCl、KH2PO4、MgSO4·7H2O、NaCl、FeCl3、浓盐酸、浓硫酸、NaOH(均为分析纯):国药集团化学试剂有限公司;大孔吸附树脂LS808:陕西蓝深特种树脂有限公司。
1.1.3 培养基
斜面活化培养基:D-木糖10 g,葡萄糖10 g,牛肉膏5 g,蛋白胨10 g,NaCl 5 g,KH2PO40.5 g,MgSO·47H2O 1 g,琼脂22 g,pH7.0,水1 000 mL,110 ℃灭菌30 min。
种子培养基:D-木糖10 g,葡萄糖10 g,牛肉膏5 g,蛋白胨10 g,NaCl 5 g,KH2PO40.5 g,MgSO4·7H2O 1 g,pH 7.0,水1 000 mL,110℃灭菌30 min。
发酵培养基:棉秆酸解糖液1 000 mL,牛肉膏5 g,蛋白胨10 g,NaCl 5 g,KH2PO40.5 g,MgSO·47H2O 0.5 g,pH 7.5,110℃灭菌30min。棉杆水解糖液初始糖浓度调节为40g/L。
1.2 仪器与设备
LDZX-50KB立式电热压力蒸汽灭菌器:上海申安医疗器械厂;SW-CJ-2F超净工作台、HPX-9272MBE数显电热培养箱、GZX-9140MBE数显鼓风干燥箱、SHZ-D(Ⅲ)循环水式真空泵:巩义市予华仪器有限责任公司;UV754N紫外-可见分光光度计:上海精密科学仪器有限公司;RE-52CS旋转蒸发仪:上海亚荣生化仪器公司;PHS-3C精密酸度计:上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1 棉秆水解糖液制备方法
棉秆水解糖液制备参照ZHANG Q等[18]报道的棉秆酸解优化工艺进行制备:过筛的棉秆(20目)采用4%(V/V)稀硫酸溶液按照固液比1∶5(g∶mL)于121 ℃水解30 min,抽滤得到棉秆的酸水解液。酸水解液经NaOH和Ca(OH)2(1∶3,物质的量比)沉淀、4%H2SO4回调脱毒,大孔吸附树脂脱色,得到一定浓度脱毒、脱色的棉秆水解糖液,再经旋转蒸发仪浓缩至所需糖浓度备用。
1.3.2 菌种的活化与接种
挑取2~3环活化的斜面菌种接种至种子培养基,250mL三角瓶装液量为100 mL,于37℃、120 r/min振荡培养15~16 h。调节种子液OD600nm为0.8~1.0,按10%(V/V)接种量接种于发酵培养基中,密封好发酵装置并连接好各导气管(500 mL自制产氢发酵装置装液量为350 mL,每个处理3个重复),置于37℃恒温培养箱中培养。
1.3.3 生物氢收集和检测方法
采用排氢氧化钠溶液法[20]收集并检测氢气体积,每24h收集并检测3次氢气体积,累加计为日均产氢量。每24 h取8 mL发酵液,2 mL用于测定菌体OD600nm,1 mL通过稀释平皿计数法检测活菌数,剩余5 mL置于离心管中,4 000 r/min离心20 min,取上清液,检测葡萄糖和木糖的质量浓度。
1.3.4 分析检测方法
棉秆水解糖液及发酵液中葡萄糖和木糖质量浓度分别采用DNS比色法[19]和地衣酚比色法[21]测定。培养基和发酵液的pH值采用精密酸度计测定。葡萄糖和木糖利用率:采用发酵过程中消耗的葡萄糖(或木糖)质量浓度占初始葡萄糖(或木糖)质量浓度的百分比来表示。
1.3.5 计算公式和分析软件
采用Gompertz模型对不同处理下的累积产氢量进行拟合[22],方程如下所示:
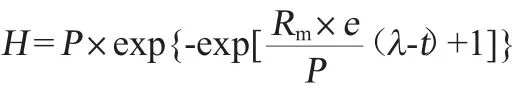
式中:H为累积产氢量,mL/L;P表示产氢潜力,mL/L,Rm为最大产氢速率,mL(/L·h),λ为延滞期时间,h,e为自然常数,2.718 28;式中P、Rm和λ值通过Sigmaplot 12.0软件进行计算和分析。
各处理数据通过Origin 8.0软件计算、分析并作图。
2 结果与分析
2.1 分段调控pH值对E.cloacaeWL1318发酵棉秆水解糖液产氢过程中发酵液pH值的影响
检测了不同pH值分段调控处理下,E.cloacaeWL1318发酵棉秆水解糖液产氢过程中的发酵液pH值变化,结果如图1所示。
由图1可知,未进行pH调控的处理组,尽管发酵液初始pH值调节为7.5,但其pH值在发酵产氢过程中却急剧下降,发酵48 h,发酵液pH值<5.0,至发酵结束(120 h),发酵液pH值<4.0。在分段调控pH值的处理中,自调控时间点起,发酵pH值调为初始pH值(7.5),之后发酵液pH值也随发酵时间降低,但降低的幅度仍然小于未调控处理的,并且48 h调控组的pH值降低幅度小于28 h调控组的,这两个pH值调控组至发酵结束(120 h)时,发酵液pH值均能维持在5.0左右。由此可见,E.cloacaeWL1318发酵棉秆水解糖液产氢过程中,适当进行pH值调控,可控制发酵液pH值不会急剧降低。

图1 分段调控pH值对E.cloacaeWL1318发酵棉秆水解糖液产氢过程中发酵液pH值的影响Fig.1 Effect of subsection control of pH value on pH value of fermentative broth in the hydrogen production process of cotton stalk hydrolysate fermentation byE.cloacae WL1318
2.2 分段调控pH值对E.cloacaeWL1318发酵棉秆水解糖液产氢过程中生物氢合成的影响
对E.cloacaeWL1318发酵棉秆水解糖液产氢过程中的日均产氢量进行了监测,结果如图2所示。
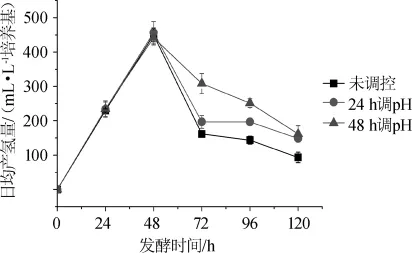
图2 分段调控pH值对E.cloacaeWL1318发酵棉秆水解糖液产氢过程中日均产氢量的影响Fig.2 Effect of subsection control of pH value on daily average hydrogen yield in the hydrogen production process of cotton stalk hydrolysate fermentation byE.cloacae WL1318
由图2可知,发酵前48 h,分段调控pH值处理和未调控处理的日均产氢量没有显著差异(P>0.05)。发酵48 h后,分段调控pH值处理的日均产氢量显著提高(P<0.05),尤其48 h调控pH值的处理提高幅度较大,发酵72 h的日均产氢量相较未调控处理的提高约1.5倍。至发酵结束(120 h),24 h调控pH值和48 h调控pH值处理的日均产氢量接近,均高于未调控处理的。可见,调控pH值处理有效提高了发酵液pH值和菌株的日均产氢量,说明E.cloacaeWL1318发酵棉秆水解糖液产氢过程中进行pH调控可有效促进菌株生物氢的合成。
日均产氢量按发酵时间累加,统计了E.cloacaeWL1318发酵棉秆水解糖液120 h的累积产氢量,统计结果见图3。由图3可知,发酵48 h后,分段调控pH值处理显著提高了菌株的累积产氢量(P<0.05)。至发酵结束(120 h),24 h调控pH值和48 h调控pH值处理的累积产氢量相较未调控处理的分别提高了约15%和30%,表明调控pH值处理有利于菌株累积合成氢气,对菌株生物氢的合成起到了正调控作用。
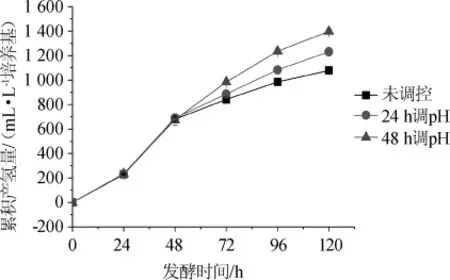
图3 分段调控pH值对E.cloacaeWL1318发酵棉秆水解糖液产氢过程中累积产氢量的影响Fig.3 Effect of subsection control of pH value on cumulative hydrogen yield in the hydrogen production process of cotton stalk hydrolysate fermentation byE.cloacae WL1318
采用Gompertz模型对不同处理下的累积产氢量进行拟合,并对其中的参数P、Rm和λ值进行计算,并计算模型的相关系数R2,结果见表1。由表1可知,在各处理条件下,相关系数R2均>0.99,说明各处理组的累积产氢量可充分通过Gompertz模型进行拟合。24 h调控pH值和48 h调控pH值处理的产氢潜力P均高于未调控处理的,说明在发酵的一定阶段调控发酵液pH值可提高菌株的产氢潜力,有利于生物氢的合成。最大产氢速率Rm以24 h调控pH值的处理最高,说明在发酵24h调控pH值能促进生物氢的快速合成。24h调控pH值和48 h调控pH值处理的延滞期λ均较未调控处理的长,说明菌株在一定pH值调控处理下,通过延长延滞期、推迟生长峰期来适应厌氧发酵产氢过程,从而提高自身产氢潜力,以提高生物氢的合成量。

表1 不同pH值调控方式下Gompertz模型拟合累积产氢量的参数和相关系数Table 1 Parameters and correlation coefficients of Gompertz model fitted cumulative hydrogen yield in different pH value control methods
2.3 分段调控pH值对E.cloacaeWL1318发酵棉秆水解糖液产氢过程中棉秆水解糖液中葡萄糖和木糖利用的影响
检测了不同pH值分段调控处理下,E.cloacaeWL1318发酵棉秆水解糖液产氢过程中的葡萄糖和木糖质量浓度变化,并换算了全发酵过程中的葡萄糖和木糖利用率,结果如图4所示。
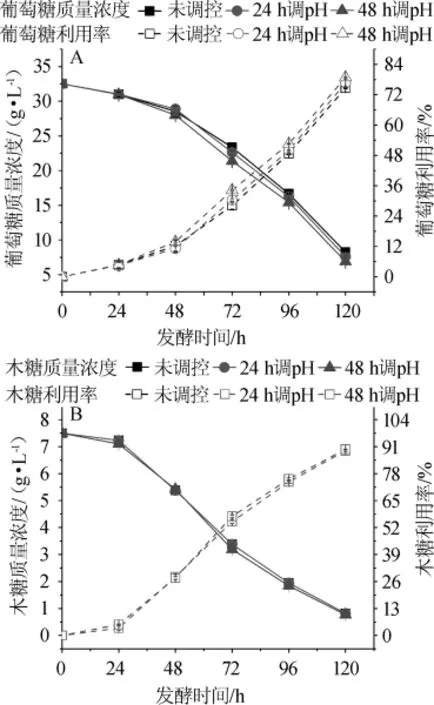
图4 分段调控pH值对E.cloacaeWL1318发酵棉秆水解糖液产氢过程中葡萄糖(A)和木糖(B)利用的影响Fig.4 Effect of subsection control of pH value on glucose(A)and xylose(B)utilization in the hydrogen production process of cotton stalk hydrolysate fermentation byE.cloacaeWL1318
由图4可知,在发酵过程中,24 h和48 h调控pH值处理的葡萄糖质量浓度略低于未调控处理的,葡萄糖利用率略高于未调控处理的。由此可见,E.cloacaeWL1318发酵棉秆水解糖液产氢过程中调控发酵液pH值对棉秆水解糖液中葡萄糖利用的影响并不显著(P>0.05),仅引起了葡萄糖质量浓度及其利用率的略微变化(见图4A)。发酵液24 h和48 h调控pH值对棉秆水解糖液中木糖利用的影响均不显著(P>0.05),说明在发酵24 h和48 h调控pH值并不影响棉秆水解糖液中木糖的利用(见图4B)。
2.4 分段调控pH值对E.cloacaeWL1318发酵棉秆水解糖液产氢过程中菌株生长的影响
检测了E.cloacaeWL1318发酵棉秆水解糖液产氢过程中的活菌数和菌体生长OD600nm的变化,结果如图5所示。

图5 分段调控pH值对E.cloacaeWL1318发酵棉秆水解糖液产氢过程中活菌数和OD600 nm的影响Fig.5 Effect of alternative pH regulation on viable count and OD600 nm in the hydrogen production process of cotton stalk hydrolysate fermentation byE.cloacaeWL1318
由图5可知,分段调控pH值对E.cloacaeWL1318发酵棉秆水解糖液产氢过程中的活菌数变化影响较大,发酵24h调控pH值,其活菌数在发酵48 h达到峰值;48 h调控pH值的处理,其活菌数在发酵72 h达到另一个峰值;未调控处理,其活菌数在发酵24 h达到峰值后,数量急剧下降,至发酵结束(120 h),其活菌数已接近初始接种的活菌数量水平。相应地,从OD600nm的变化曲线来看,分段调控pH值的处理,其OD600nm在调控时间点后均显著高于未调控处理的(P<0.05)。可见,在一定的发酵阶段进行pH值调控,有利于细菌菌体的生长,而细菌菌体的生长对于菌株发酵产氢是十分必要的。
E.cloacaeWL1318是一类典型的兼性厌氧细菌,这类细菌发酵产氢主要通过混合酸发酵途径进行[12-13],因此,这类细菌发酵产氢的过程会伴随大量有机酸的产生,造成发酵液pH值的降低。发酵液pH值过低势必引起细菌生长和生物氢合成受阻,为此,在菌株发酵产氢的一定阶段进行pH值调控,可以促进细菌有效生长,从而有利于生物氢的合成。
3 结论
本研究采用分段调控pH值对E.cloacaeWL1318发酵棉秆水解糖液产氢过程进行了调控。研究发现,pH调控处理首先使得发酵液中的pH值不会急剧下降,从而不会产生过低的pH培养环境,并且能维持发酵结束的pH值维持在5.0左右。
分段调控pH值对E.cloacaeWL1318发酵棉秆水解糖液产氢过程中生物氢合成和菌体生长有显著影响(P<0.05)。发酵48 h后,分段调控pH值处理均能显著提高日均产氢量和累积产氢量(P<0.05),尤以48 h调控pH值的处理提高幅度较大。采用Gompertz模型对不同处理下的累积产氢量拟合,其相关系数R2均高于0.99,阐明了动力学模型的可行性。分段调控pH值处理的产氢潜力P均高于未调控处理的,说明在发酵的一定阶段调控发酵液pH值可提高菌株的产氢潜力,有利于生物氢的合成。分段调控pH值处理使E.cloacaeWL1318在调控时间点后达到活菌数峰值,且菌体生长OD600nm在调控时间点后均高于未调控处理的,表明其对菌株的生长有正调控作用。
总的来看,E.cloacaeWL1318发酵棉秆水解糖液产氢过程中发酵液pH值会急剧降低。在其一定的发酵产氢阶段进行pH值调控,可以促进细菌有效生长,从而有利于生物氢的合成,调控pH处理方式为有效调控该菌株的发酵产氢过程、提高生物氢产量提供了技术参考和理论指导,具有重要的意义。
[1]ASADI N,ZILOUEI H.Optimization of organosolv pretreatment of rice straw for enhanced biohydrogen production usingEnterobacter aerogenes[J].Bioresource Technol,2017,227:335-344.
[2]LOPEZ-HIDALGO A M,SÁNCHEZ A,LEÓN-RODRÍGUEZ A D.Simultaneous production of bioethanol and biohydrogen byEscherichia coliWDHL using wheat straw hydrolysate as substrate[J].Fuel,2017,188:19-27.
[3]ÖZGÜR E,PEKSEL B.Biohydrogen production from barley straw hydrolysate through sequential dark and photofermentation[J].J Clean Prod,2013,52:14-20.
[4]ZHANG K,REN N Q,WANG A J.Fermentative hydrogen production from corn stover hydrolyzate by two typical seed sludges:Effect of temperature[J].Int J Hydrogen Energ,2015,40(10):3838-3848.
[5]KUMAR K,ROY S,DAS D.Continuous mode of carbon dioxide sequestration byC.sorokinianaand subsequent use of its biomass for hydrogen production byE.cloacaeIIT-BT 08[J].Bioresource Technol,2013,145(19):116-122.
[6]MEI N,ZERGANE N,POSTEC A,et al.Fermentative hydrogen production by a new alkaliphilicClostridiumsp.(strain PROH2)isolated from a shallow submarine hydrothermal chimney in Prony Bay,New Caledonia[J].Int J Hydrogen Energ,2014,39(34):19465-19473.
[7]AN D,LI Q,WANG X Q,et al.Characterization on hydrogen production performance of a newly isolatedClostridium beijerinckiiYA001 using xylose[J].Int J Hydrogen Energ,2014,39(35):19928-19936.
[8]LIU H Y,CHEN G C,WANG G C.Characteristics for production of hydrogen and bioflocculant byBacillussp.XF-56 from marine intertidal sludge[J].Int J Hydrogen Energ,2015,40(3):1414-1419.
[9]SONG Z X,LI W W,LI X H,et al.Isolation and characterization of a new hydrogen producing strainBacillussp.FS2011[J].Int J Hydrogen Energ,2013,38(8):3206-3212.
[10]MANGAYIL R,SANTALA V,KARP M.Fermentative hydrogen production from different sugars byCitrobactersp.CMC-1 in batch culture[J].Int J Hydrogen Energ,2011,36(23):15187-15194.
[11]SHIN J H,YOON J H,AHN E K,et al.Fermentative hydrogen production by the newly isolatedEnterobacter asburiaeSNU-1[J].Int J Hydrogen Energ,2007,32(2):192-199.
[12]MARKOV S A,AVERITT J,WALDRON B.Bioreactor for glycerol conversion into H2by bacteriumEnterobacter aerogenes[J].Int J Hydrogen Energ,2011,36(1):262-266.
[13]KHANNA N,KOTAY S M,GILBERT J J,et al.Improvement of biohydrogen production byEnterobacter cloacaeIIT-BT 08 under regulated pH[J].J Biotechnol,2011,152(1-2):9-15.
[14]WANG J,WAN W.Factors influencing fermentative hydrogen production:A review[J].Int J Hydrogen Energ,2009,34(2):799-811.
[15]OH Y K,SEOL E H,KIM J R,et al.Fermentative biohydrogen production by a new chemoheterotrophic bacteriumCitrobactersp.Y19[J].Int J Hydrogen Energ,2003,28(12):1353-1359.
[16]QIU C S,SHI P Y,XIAO S M,et al.Effects of pH and substrate concentrations on dark fermentative biohydrogen production from xylose by extreme thermophilic mixed culture[J].World J Microbiol Biotechnol,2017,33(1):7-15.
[17]朱晓鹏,侯梦云,杨姣春,等.Klebsiellasp.分批发酵棉秆水解糖液产氢动力学研究[J].食品工业,2017,38(9):201-204.
[18]ZHANG Q,LI Y B,XIA L M,et al.Enhanced xylitol production from statistically optimized fermentation of cotton stalk hydrolysate by immobilizedCandidatropicalis[J].Chem Biochem Eng Quart,2014,28(1):13-19.[19]YOKOI H,TOKUSHIGE T,HIROSE J,et al.Hydrogen production by immobilized cells of aciduricEnterobacter aerogenesstrain HO-39[J].J Ferment Bioeng,1997,83(5):481-484.
[20]VAN S P J,ROBERTSON J B,LEWIS B A.Methods for dietary fiber,neutral detergent fiber,and non starch polysaccharides in relation to animal nutrition[J].J Dairy Sci,1991,74(10):3583-3597.
[21]DOUGLAS S G.A rapid method for the determination of pentosans in wheat flour[J].Food Chem,1981,7(2):139-145.
[22]ZHANG K,REN N Q,CAO G L,et al.Biohydrogen production behavior of moderately thermophileThermoanaerobacterium thermosaccharolyticumW16 under different gas-phase conditions[J].Int J Hydrogen Energ,2011,36(21):14041-14048.

