山西老陈醋源优良芽孢杆菌菌株的鉴定及筛选
史改玲,许 女*,贾瑞娟,李雅茹,张 浩
(山西农业大学 食品科学与工程学院,山西 晋中 030801)
山西老陈醋以优质高梁为主要原料,大曲为发酵剂,采用传统自然固体发酵并结合独特熏、淋、晒等工艺,形成老陈醋独特的酸、绵、香、甜风味与口感[1]。老陈醋的独特风味得益于其天然发酵过程中微生物菌群的生长代谢及复杂的协同作用,这些微生物代谢产生丰富的酶类、风味、滋味及其生理功能(抗氧化、抗高血压等)物质[2]。如霉菌产生丰富的酶类分解原料,为微生物提供碳源和氮源;酵母菌不仅代谢积累大量醇类物质,还产生各种醛类和酯类等风味物质;细菌代谢产生大量有机酸,是老陈醋酸味主要来源[3]。
芽孢菌作为食醋酿造过程中的重要菌群,对老陈醋风味和功能成分的形成起到重要作用。大曲制作过程中,芽孢菌不仅代谢产生多种酶类,分解原料提供微生物的碳源和氮源,而且其代谢过程中产生多种抗菌物质,抑制大曲制作过程中病原菌的繁殖[4]。酒精发酵阶段,芽孢菌与乙酸乙酯、庚酸乙酯、十二酸乙酯等多种酒醪特有风味物质的形成密切相关[5-6]。醋酸发酵阶段,芽孢菌代谢产生的乳酸、苹果酸、酒石酸、丙酮酸等有机酸,一方面能缓冲乙酸带来的强烈刺激性酸味[4],另一方面可以与醇类物质酯化生成酯类物质,丰富老陈醋味感与口感。还有研究表明芽孢菌通过特定代谢途径参与多酚、黄酮、乙偶姻等功能活性物质的生成[7-10]。
近年来,对食醋中芽孢杆菌的特性研究有了一定进展。黄思敏等[9]从传统麸醋醋醅中分离得到一株芽孢杆菌,其产酚和产黄酮能力较好,总酚和总黄酮产量分别为49.7μg/mL和218.1 μg/mL。陈志远[10]考察了一株分离至传统麸醋醋醅的芽孢杆菌,结果表明在最适发酵条件下,总黄酮、总酚含量分别可达241.9 μg/mL和229.8 μg/mL。于华等[11]从四川麸醋醋醅筛选出产酸能力较强的产酸芽孢杆菌(Bacillus acidiproducens)和凝结芽孢杆菌(Bacillus coagulans)[12],在最适产酸条件下,其产酸能力分别达到6.105 g/L和7.764 g/L。王进龙[4]从山西老陈醋大曲中分离筛选出产淀粉酶的芽孢杆菌BA7、BA8及BA10和产蛋白酶的芽孢杆菌BP4、BP8,并将这些芽孢杆菌应用到山西老陈醋发酵生产,提高了山西老陈醋总酯含量及香气成分。
本研究主要对分离自山西老陈醋醋醅中的9株芽孢菌进行分子生物学鉴定,并对其产酶、产酸、产酯、产多酚及产乙偶姻等发酵特性进行综合考察,以期对优良菌剂的开发,强化老陈醋生产进而提质增效具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 芽孢菌菌株
芽孢菌菌株(CP-18、CP-1853、CP-1671、CP-803、CP-2430、CP-6、CP-1576、CP-15、CP-2436):均分离自山西老陈醋成熟醋醅中,保存于山西农业大学食品学院生物工程实验室。
1.1.2 试剂与材料
细菌DNA提取试剂盒:北京博迈德基因技术有限公司;PCR引物:由深圳华大基因公司合成;Maker D、MIX:上海生工生物工程股份有限公司;3-羟基-2-丁酮(色谱纯):美国Sigma Aldrich公司;3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)、干酪素、福林酚、肌酸(均为分析纯):北京索莱宝科技有限公司。
1.1.3 培养基
营养琼脂、营养肉汤培养基(用于芽孢菌的活化及产酚芽孢菌的筛选)、淀粉培养基、羧甲基纤维素钠和酪蛋白培养基[9](用于产淀粉酶、产纤维素酶和产蛋白酶芽孢菌的筛选)、产酸发酵培养基[11](用于产酸芽孢菌的筛选)、高粱汁培养基[13](用于产酯芽孢菌的筛选)、Voges-Proskauer(V-P)培养基[14](用于产乙偶姻芽孢菌的筛选):青岛海博生物技术有限公司。
1.2 仪器与设备
T100型PCR仪、Universial HoodⅡ型凝胶成像系统:美国Bio-Rad公司;DYY-6C型琼脂糖凝胶电泳仪:北京六一仪器厂;5417R型高速冷冻离心机:德国Eppendorf公司;ZWY-1102C型恒温振荡培养箱:上海智城分析仪器制造有限公司;BJ-CD型超净工作台:上海跃进医疗器械厂;722型可见分光光度计:上海精密科学仪器有限公司;PB-21型酸度计:北京赛多利斯科学仪器有限公司。
1.3 试验方法
1.3.1 山西老陈醋源芽孢菌菌株的形态学观察
芽孢菌菌落形态观察:将菌株划线涂布于平板上,于37℃静置培养24 h后,观察菌落特征。如大小、透明度、形状、边缘、颜色、隆起形状等。
芽孢菌细胞形态观察:对培养24 h的芽孢菌菌体进行革兰氏染色,在油镜下观察染色结果及细胞形态。
1.3.2 山西老陈醋源芽孢菌菌株的鉴定及进化树构建
芽孢菌分子生物学鉴定:依据细菌DNA提取试剂盒的方法提取9株芽孢菌基因组DNA,以此DNA为模板,利用细菌16SrDNA通用引物27F(AGAGTTTGATCCTGGCTCAG)和1 492R(ACGGCTACCTTGTTACGACTT)对芽孢菌16S rDNA进行扩增。扩增产物进行琼脂糖凝胶电泳检测,回收目的条带,将回收产物送至武汉华大基因测序。
芽孢菌进化树构建:在美国国立生物技术信息中心(national center for biotechnology information,NCBI)采用基本局部比对搜索工具(basic local alignment search tool,BLAST)搜索与目的菌株序列同源性高的序列,经MEGA 6.0软件构建系统发育树。
1.3.3 山西老陈醋源芽孢菌产酶能力测定
-80℃保藏的芽孢菌菌株活化后挑取单菌落接至营养肉汤培养基中,37℃、160 r/min振荡培养24 h后得到芽孢菌种子液。芽孢菌种子液以5%(V/V)比例分别接种至淀粉培养基、羧甲基纤维素钠培养基和酪蛋白培养基中,37℃、160 r/min振荡培养48 h后,5 000 r/min离心15 min得到待测粗酶液。分别采用DNS比色法[9]测其纤维素酶活和淀粉酶活,福林-酚比色法[9]测其蛋白酶活。
1.3.4 山西老陈醋源芽孢菌产酸能力测定
芽孢菌种子液以5%(V/V)比例接种于产酸发酵培养基中,37℃、160 r/min振荡培养48 h后,用NaOH滴定法[15]测定发酵液中总酸含量。
1.3.5 山西老陈醋源芽孢菌产酯能力测定
芽孢菌种子液以5%(V/V)比例接种于高粱汁培养基中,37℃、160 r/min振荡培养7 d后,采用回流皂化法[16]测定发酵液中总酯含量。
1.3.6 山西老陈醋源芽孢菌产多酚能力测定
芽孢菌种子液以5%(V/V)比例接种于营养肉汤培养基中,37℃、160 r/min振荡培养48 h后,用Folin-Ciocalteu比色法[17]测定发酵液中多酚产量。
1.3.7 山西老陈醋源芽孢菌产乙偶姻能力测定[16]
芽孢菌种子液以5%(V/V)比例接种于V-P培养基中,37℃、160 r/min振荡培养48 h后,采用肌酸比色法[14]测定发酵液中乙偶姻产量。
2 结果与分析
2.1 山西老陈醋源芽孢菌的形态学观察
9株山西老陈醋醋醅来源的芽孢菌菌落形态及细胞形态学观察结果分别见图1和图2。具体形态学描述见表1。

图1 9株芽孢菌菌落形态Fig.1 Colony morphology of 9 strains ofBacillus
图2 9株芽孢菌细胞形态Fig.2 Cell morphology of 9 strains ofBacillus
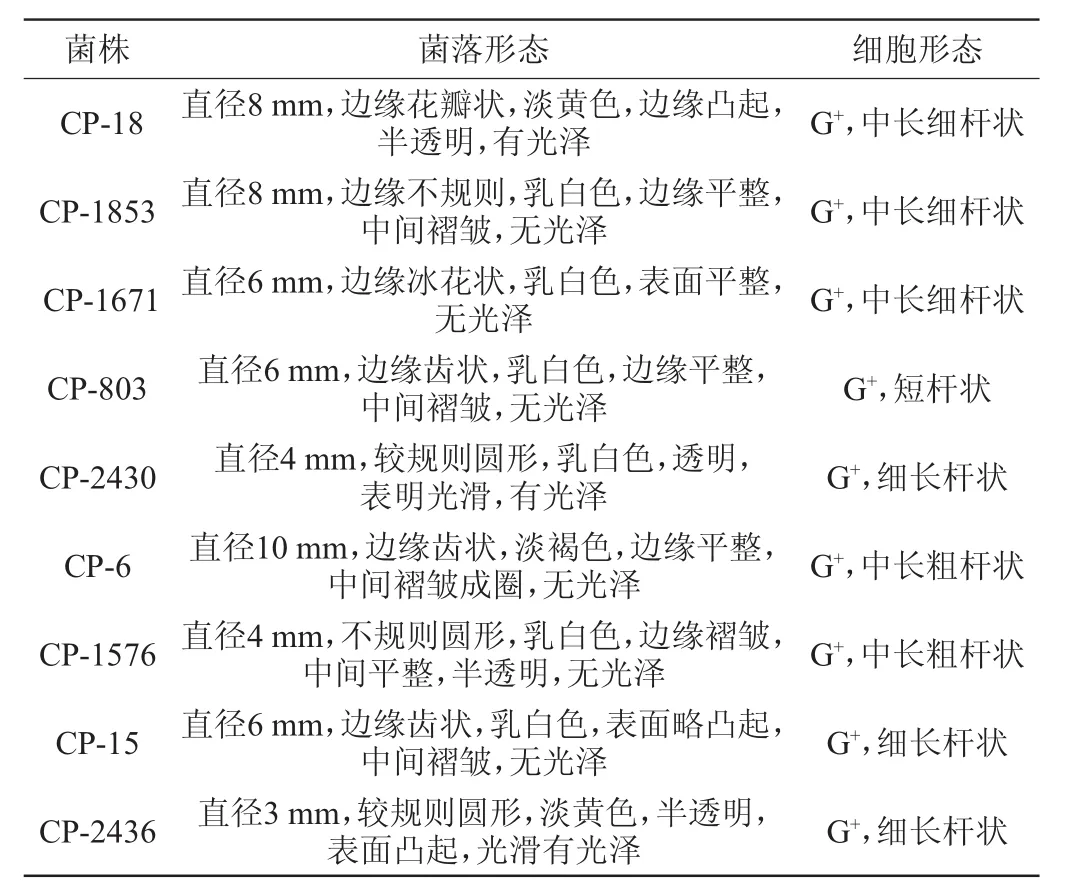
表1 9株芽孢菌菌落及细胞形态描述Table 1 Colony and cell morphology description of 9 strains ofBacillus
2.2 山西老陈醋源芽孢菌的鉴定结果
参照菌株的形态学观察结果,使用NCBIGenBank数据库对测序结果进行进行BLAST分析,将测得的基因序列与数据库中的所有序列进行同源性比较,并构建系统进化树,结果见图3。

图3 9株芽孢菌基于16S rDNA基因序列构建的系统发育树Fig.3 Phylogenetic tree of strains ofBacillusbased on 16S rDNA gene sequences
由图3可知,菌株CP-18、CP-1853和CP-1671在系统发育树上与地衣芽孢杆菌同属于一个分支,通过BLAST比对,这些菌株序列与已知的多株地衣芽孢杆菌16S rDNA的同源性最高可达93%,因此,菌株CP-18、CP-1853、CP-1671被鉴定为地衣芽孢杆菌(B.licheniformis)。同理,菌株CP-2430被鉴定为解淀粉芽孢杆菌(B.amyloliquefaciens);菌株CP-6、CP-1576被鉴定为甲基营养型芽孢杆菌(B.methylotrophicus);菌株CP-15被鉴定为海威芽孢杆菌(B.mojavensis);CP-2436被鉴定为球形赖氨酸芽孢杆菌(Lysinibacillus sphaericus)。
2.3 山西老陈醋源芽孢菌产酶特性研究
山西老陈醋酿造过程中的酶主要来源于大曲。大曲是整个发酵过程中的糖化剂和发酵剂,其含有多种微生物,包括霉菌、细菌、酵母菌等,这些微生物代谢产生丰富的酶类,促进淀粉、纤维素和蛋白质的充分利用,提高原料利用率。研究表明,酿醋大曲中的芽孢杆菌代谢可产生多种酶,不仅为微生物代谢提供丰富底物,还可将酿醋原料中的蛋白质水解成各种氨基酸,提高食醋的鲜味[4]。
对9株芽孢菌发酵液中的淀粉酶、纤维素酶和蛋白酶酶活分别进行测定,其结果见图4。由图4可知,9株芽孢菌的淀粉酶、纤维素酶和蛋白酶活分别在9.77~61.40 U/mL、7.98~54.99 U/mL、4.16~22.80 U/mL范围内。其中,甲基营养型芽孢杆菌(B.methylotrophicus)CP-1576发酵液淀粉酶活力最高(61.40 U/mL),球形赖氨酸芽孢杆菌(Ly.sphaericus)CP-2436发酵液中纤维素酶活力最高(54.99U/mL),地衣芽孢杆菌(B.licheniformis)CP-1853的发酵液蛋白酶活力达到最高为22.80 U/mL,且其淀粉酶和纤维素酶酶活也相对较高,分别为43.22 U/mL、38.97 U/mL。相较于王进龙[4]从山西老陈醋大曲中分离筛选的高产淀粉酶和蛋白酶的芽孢杆菌BA8和BP4,地衣芽孢杆菌(B.licheniformis)CP-1853淀粉酶酶活(43.22U/mL)高于BA8粗酶液酶活(41.01U/mL),但是其蛋白酶酶活(38.97 U/mL)低于BP4(700.19 U/mL)。

图4 芽孢杆菌粗酶液淀粉酶、纤维素酶及蛋白酶酶活测定结果Fig.4 Determination results of amylase,cellulase and protease activity ofBacilluscrude enzyme
2.4 山西老陈醋源芽孢菌产酸特性研究
山西老陈醋酿造过程中产生的有机酸是醋体主要酸味来源,这些有机酸主要是由发酵过程中存在的酵母菌、醋酸菌、芽孢杆菌、乳酸菌等多种微生物代谢产成。有研究表明,芽孢菌通过三羧酸或丙酮酸循环代谢产生的乳酸、丙酮酸、酒石酸、苹果酸等有机酸[18],一方面能够缓冲乙酸带来的强烈刺激性酸味,赋予老陈醋酸味柔和、口感绵长的特点[4],另一方面有机酸与醇类物质酯化生成酯类物质,提高香气物质含量、使得老陈醋味感醇厚丰富。
9株芽孢菌培养48 h后,发酵液中总酸含量测定结果见图5。由图5可知,发酵液中总酸含量在0.07~0.25 g/L范围内,其中地衣芽孢杆菌(B.licheniformis)CP-18产酸能力最强,为0.25 g/L,但其产酸能力远低于于华等[11]从四川麸醋醋醅筛选出的产酸芽孢杆菌(B.acidiproducens)(6.105g/L)和凝结芽孢杆菌(B.coagulans)[12](7.764 g/L)。

图5 芽孢杆菌的总酸产量测定结果Fig.5 Determination results of total acids produced byBacillusstrains
2.5 山西老陈醋源芽孢菌产酯特性研究
研究表明,芽孢菌与酯类物质的形成密切相关,牟穰[5]对清爽型黄酒酿造微生物群落与风味物质相关性研究发现,庚酸乙酯、十二酸乙酯、十四酸乙酯等风味物质的产生与芽孢菌有极强的关联性;而且赵长青等[6]从浓香型白酒大曲及酒醅中筛得一株高产己酸乙酯的蜡质芽孢杆菌(B.cereus)YB-16。

图6 芽孢杆菌的总酯产量测定结果Fig.6 Determination results of total esters produced byBacillusstrains
9株芽孢菌在高粱汁培养基中发酵7 d后,其发酵液中总酯含量测定结果见图6。由图6可知,芽孢菌发酵液总酯含量在7.08~10.67 g/100 mL,其中地衣芽孢杆菌(B.licheniormis)CP-1853产酯含量最高,为10.67 g/100 mL。
2.6 山西老陈醋源芽孢菌产多酚特性研究
山西老陈醋中含有许多对人体有益的活性物质,其中多酚是主要的抗氧化活性成分[18]。高粱皮细胞壁基质中含有多种天然多酚类物质,包括单宁、源阿魏酸、儿茶素、花色苷、香豆酸、白藜芦醇等,在酒精发酵和醋酸发酵阶段,微生物分泌的各种功能性酶分解植物细胞壁从而释放这些酚类物质[2]。也有报道表明,食醋酿造过程中微生物的代谢活动也会产生酚类物质[9-10]。多酚类物质除了其抗氧化功能外,还具有强化血管壁、促进肠胃消化、降低血脂肪、抑制细菌与癌细胞生长等多种生理活性功能[19-20]。
9株芽孢菌总酚含量测定结果见图7。由图7可知,9株芽孢菌总酚含量在144.95~596.38μg/mL范围内,其中,枯草芽孢杆菌(B.subtilis)CP-803的总酚含量高达596.38 μg/mL,高于黄思敏等[9]从四川麸醋醋醅中分离的一株芽孢菌总酚含量(49.70 mg/mL)和于华等[11]从四川麸醋醋醅中分离的一株芽孢菌总酚含量(263.60 μg/mL)。

图7 芽孢杆菌的多酚产量测定结果Fig.7 Determination results of total polyphenols produced by Bacillusstrains
2.7 山西老陈醋源芽孢菌产乙偶姻特性研究
山西老陈醋醋酸发酵阶段,微生物利用乙醇和葡萄糖为底物,通过双乙酰/乙偶姻的代谢途径合成乙偶姻(acetoin,ACT)。乙偶姻不仅是老陈醋重要的风味物质,而且是老陈醋重要呈味及功能物质川芎嗪生物合成的前体。有报道称川芎嗪具有抗氧化、抗肿瘤、降血压、降血脂等生理活性功能[21]。目前关于芽孢菌产乙偶姻的研究在酒曲和白酒中较多。王霜等[22]从兼香型白酒酒醅中筛选到两株产乙偶姻的地衣芽孢杆菌LS9和枯草芽孢杆菌S10,其在小麦固体培养基中乙偶姻产量分别为6.52 mg/mL和4.13 mg/mL。郝飞等[7]筛得一株茅台中温度大曲源枯草芽孢杆菌CCTCCM 208157,进行pH条件优化后,其发酵罐水平上乙偶姻产量为32.7 mg/mL。
关于醋源产乙偶姻的菌株多为醋酸菌和乳酸菌,赵洪源等[14]从四川凉州熏醋醋醅中筛得一株高产乙偶姻的巴氏醋杆菌C92并优化其发酵条件,最终在最适条件下,该菌株乙偶姻高达19.04 g/L。吴林寰[23]通过元基因组学从镇江香醋醋醅中筛选得到3株高产乙偶姻的醋酸菌和2株乙偶姻的乳酸菌,并将这些醋酸菌与乳酸菌互作研究其产乙偶姻特性,结果表明,两种微生物共培养后乙偶姻的产量明显高于乳酸杆菌纯培养后的乙偶姻产量。LU Z M等[21]进一步阐明了镇江香醋醋醅源乳酸菌通过双乙酰/乙偶姻的代谢途径产乙偶姻的代谢机制。
对9株芽孢菌发酵液乙偶姻含量测定结果见图8。由图8可知,9株芽孢菌发酵液乙偶姻含量在0.13~1.15 mg/mL之间,其中甲基营养型芽孢杆菌(B.methylotrophicus)CP-1576的乙偶姻产量最高,为1.15 mg/mL。
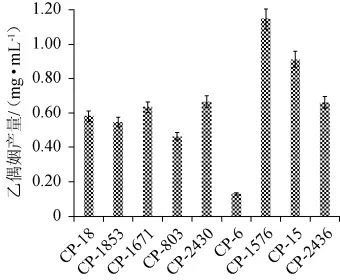
图8 芽孢杆菌的乙偶姻产量测定结果Fig.8 Determination results of acetoin produced byBacillusstrains
3 结论
山西老陈醋酿造过程是多种微生物协同作用的复杂微生态体系,对其中的微生物生产特性进行研究,有助于了解菌株特性,定向指导生产。本课题对山西老陈醋来源的9株芽孢菌进行分子生物学鉴定,并对其产酶、产酸、产酯、产多酚及产乙偶姻特性初步研究,结果表明,9株芽孢菌中CP-18、CP-1853、CP-1671被鉴定为地衣芽孢杆菌(Bacillus licheniformis),CP-803为枯草芽孢杆菌(Bacillus subtilis),CP-2430为解淀粉芽孢杆菌(Bacillus amyloliquefaciens),CP-6、CP-1576为甲基营养型芽孢杆菌(Bacillus methylotrophicus),CP-15为漠海威芽孢杆菌(Bacillus mojavensis),CP-2436为球形赖氨酸芽孢杆菌(Lysinibacillussphaericus)。特性研究结果表明,地衣芽孢杆菌CP-1853的蛋白酶活最高(22.80U/mL),且具有较高的产淀粉酶(43.22U/mL)和纤维素酶(38.97U/mL)能力;地衣芽孢杆菌CP-18具有较强的产酸能力(0.25 g/L);地衣芽孢杆菌CP-1853具有较强的产酯能力(10.67g/100mL);产多酚能力和产乙偶姻能力最强的菌株分别为枯草芽孢杆菌CP-803(596.38μg/mL)和甲基营养型芽孢杆菌CP-1576(1.15mg/mL)。这些芽孢菌作为潜在的生产菌株,为山西老陈醋源优良生产菌剂的开发和产品提质增效提供一定的资料。
[1]WU J J,MA Y K,ZHANG F F,et al.Biodiversity of yeasts,lactic acid bacteria and acetic acid bacteria in the fermentation of"Shanxi aged vinegar",atraditionalChinesevinegar[J].Food Microbiol,2012,30:289-297.
[2]XIE X,ZHENG Y,LIU X,et al.Antioxidant activity of Chinese Shanxi aged vinegar and its correlation with polyphenols and flavonoids during the brewing process[J].J Food Sci,2017,82(10):2479-2486.
[3]弓晓艳.老陈醋酿造过程中微生物群落结构与功能研究[D].太原:山西大学,2010.
[4]王进龙.山西老陈醋大曲中芽孢杆菌的分离鉴定及特性研究[D].晋中:山西农业大学,2016.
[5]牟 穰.清爽型黄酒酿造微生物群落结构及其与风味物质相关性研究[D].无锡:江南大学,2015.
[6]赵长青,徐 莎,杨 阳,等.浓香型白酒酿造大曲及糟醅中功能芽孢杆菌的筛选[J].食品工业科技,2017,38(7):151-155.
[7]郝 飞,吴 群,徐 岩.枯草芽孢杆菌(Bacillus subtilis)发酵生产乙偶姻的 pH 调控策略[J].微生物学通报,2013,40(6):921-927.
[8]ZHAO C,ZHAO X,ZHANG J,et al.Screening ofBacillusstrains from Sun vinegar for efficient production of flavonoid and phenol[J].Ind J Microbiol,2016,56(4):498-503.
[9]黄思敏,刘 军,朱文优,等.传统麸醋醋醅中一株芽孢杆菌的筛选和鉴定[J].中国调味品,2013,38(5):18-22.
[10]陈志远.传统固态发酵生产自动化若干关键问题研究[D].杭州:浙江大学,2016.
[11]于 华,黄 丹,欧俊模,等.四川麸醋醋醅中产酸细菌的分离及产酸特性研究[J].中国调味品,2017,42(5):36-41.
[12]于 华,黄 丹,陈 卓,等.四川麸醋醋醅中产酸芽孢杆菌的分离及发酵特性研究[J].中国食品添加剂,2017(1):83-90.
[13]凌 杰.白酒酿造中地衣芽孢杆菌与酿酒酵母的相互作用及应用研究[D].无锡:江南大学,2013.
[14]赵洪源,贠建民,邵晓庆,等.凉州熏醋酿造中高产乙偶姻醋酸菌菌株筛选及其发酵条件优化[J].食品科学,2015,36(15):98-104.
[15]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T5009.41—2003食醋卫生标准的分析方法[S].北京:中国标准出版社,2003.
[16]谭才邓,王文文,朱美娟,等.1株耐高温高盐生香酵母的选育及特性分析[J].食品与发酵工业,2016,42(3):92-96.
[17]牛广财,闫公昕,朱 丹,等.Folin-Ciocalteu比色法测定沙棘酒中总多酚含量的工艺优化[J].食品与机械,2016(4):80-83.
[18]朱其瀚.镇江香醋发酵过程中微生物分离及其产酸特性[D].无锡:江南大学,2008.
[19]陈树俊,冯 斌,刘 诚,等.山西老陈醋多酚提取物抗氧化活性研究[J].食品科学,2012,33(1):31-34.
[20]苏 静.山西老陈醋多酚类物质的提取及抗氧化活性研究[D].太原:山西大学,2010.
[21]LU Z M,LIU N,WANG L J,et al.Elucidating and regulating the acetoinproducing role of microbial functional group in multispecies acetic acid fermentation[J].Appl Environ Microbiol,2016,82(19):5860-5868.
[22]王 霜,缪礼鸿,张明春,等.浓酱兼香型酒醅中产酱香芽孢杆菌的筛选及发酵风味成分分析[J].中国酿造,2017,36(10):61-65.
[23]吴林寰.整合型元基因组序列分析平台构建及其在酿醋微生物群落功能研究中的应用[D].无锡:江南大学,2016.

