黄芩素对BCRP介导的人乳腺癌MCF-7/MX细胞多药耐药的逆转作用
付乃洁,王 畅,朱迪颖,刘临红,张慧丰, 师锐赞,张明升
(山西医科大学基础医学院药理学教研室,山西 太原 030001)
乳腺癌是女性最常见的恶性肿瘤之一,发病率和病死率均很高,化疗在其综合治疗中起着不可取代的作用。但多药耐药 (multidrug resistance, MDR)是乳腺癌化疗成功的主要障碍之一。研究表明,多种机制参与MDR的产生、发展过程,其中乳腺癌耐药蛋白(breast cancer resistance protein, BCRP)的过度表达是乳腺癌MDR形成的重要机制之一[1]。BCRP被证实为肿瘤干细胞的标记物之一[2],是耐药肿瘤复发和转移的重要原因。因此,克服BCRP介导的MDR是当前乳腺癌治疗中的难点和热点问题。
黄芩素是从中药黄芩根部分离得到的有效单体。近年来,多项研究证实黄芩素可通过抑制细胞迁移[3]、增强凋亡[4]等产生明显的抗肿瘤作用。但有关黄芩素与乳腺癌MDR关系的研究较少,尤其对BCRP介导的MDR作用,国内外尚未见文献报道。因此,本实验以人乳腺癌敏感株MCF-7和米托蒽醌(mitoxantrone, MX)诱导的、BCRP高表达的乳腺癌耐药株MCF-7/MX为细胞模型,通过MTT及Western blot等实验,研究黄芩素对BCRP介导的MDR的逆转作用及可能机制,为提高乳腺癌的化疗效果提供理论基础。
1 材料与方法
1.1细胞与试剂人乳腺癌敏感细胞株MCF-7及耐药细胞株MCF-7/MX由美国国家癌症研究所Cowan 博士馈赠。黄芩素(baicalein, 纯度≥98.0%,批号JPJYH-SI)购自东京化成工业株式会社,以少量DMSO溶解,再用生理盐水配成4 mmol·L-1的母液,临用时用RMPI 1640培养液稀释成相应浓度;四甲基偶氮唑盐(MTT)粉末、盐酸米托蒽醌注射液(mitoxantrone hydrochloride, MX, 纯度≥95.0%) 购自美国Sigma公司;5-氟尿嘧啶(5-fluorouracil, 5-FU, 批号FA160305)注射液购自上海旭东海普药业有限公司;顺铂(cisplatin, DDP, 批号161004)注射液购自江苏豪森药业集团有限公司;RMPI 1640培养基购自美国Hyclone公司;优质胎牛血清(fetal bovine serum, FBS)、BCRP、NF-κB p65多克隆抗体、β-actin单克隆抗体购自上海生工生物工程股份有限公司;p38 MAPK和p-p38 MAPK单克隆抗体购自美国Cell Signaling Technology公司。
1.2仪器SMATB全自动酶标仪(美国伯腾仪器有限公司);ChemiDoc XRS凝胶成像系统、Mini-PROTEAN垂直电泳仪(美国Bio-Rad公司)。
1.3细胞培养MCF-7及MCF-7/MX细胞均以含10% FBS的RMPI 1640完全培养基,于37℃条件下在5% CO2细胞培养箱中培养。为维持MCF-7/MX的耐药性,需在上述细胞培养液中加入终浓度为400 μg·L-1的MX,实验前2周撤去MX。
1.4MTT法确定黄芩素对MCF-7/MX细胞逆转耐药的浓度取对数生长期的细胞MCF-7及MCF-7/MX,接种于96孔板(2×103/孔),培养24 h后,加入不同浓度的黄芩素(终浓度为640、320、160、80、40、20、10、5、2.5 μmol·L-1),另设阴性对照组(Control),每组6个复孔。培养68 h后,每孔加入20 μL MTT,继续培养4 h,吸去孔内液体后,每孔加入200 μL DMSO,振摇10 min后,用酶标仪于波长570 nm测吸光度(OD)值,计算各浓度的抑制率(inhibition rate, IR)和相对存活率,并绘制细胞增殖抑制曲线,选取IR≤ 15%的浓度作为耐药逆转浓度。实验重复3次。IR/%=[(对照组OD值-加药组OD值)/对照组OD值]× 100%。
1.5MTT法测定黄芩素对MCF-7/MX细胞的逆转耐药作用按照上述方法接种细胞MCF-7及MCF-7/MX,培养24 h后,将MCF-7/MX分为对照组和实验组。对照组和MCF-7组只加入不同浓度的化疗药物,实验组同时加入黄芩素及不同浓度的化疗药物,其中黄芩素浓度为上述实验确定的逆转浓度;化疗药物包括MX、5-FU、DDP 3种,每组6个复孔,实验重复3次。计算各组细胞对不同化疗药物的IC50值,按照以下公式计算耐药指数(resistance index, RI)以及黄芩素的逆转倍数和相对逆转率:RI=IC50/IC50(MCF-7);逆转倍数=IC50A/IC50B;相对逆转率/%=(IC50A-IC50B)/(IC50A-IC50C)×100%。其中,IC50A和IC50B分别为黄芩素作用前、后MCF-7/MX细胞对不同化疗药物的IC50值,IC50C为MCF-7细胞对不同化疗药物的IC50值。
1.6Westernblot法检测BCRP、NF-κBp65、p-p38蛋白的表达差异取对数生长期的MCF-7及MCF-7/MX细胞,接种于6孔板(1.0×105/孔),培养24 h后,加入逆转浓度的黄芩素,空白组加入等量的生理盐水,继续培养72 h后,每孔加入蛋白裂解液,冰浴裂解1 h,离心收集上清至预冷离心管中,采用BCA法测定蛋白浓度。将蛋白样品加入SDS-PAGE凝胶中电泳1.5 ~ 2 h,用半干法将凝胶上的蛋白转印至硝酸纤维素膜上。将膜在5%脱脂奶粉室温封闭2 ~ 3 h,以一定稀释度的一抗4℃孵育过夜。TBST洗膜后,加入辣根酶标记山羊抗兔IgG(1 ∶5 000),置摇床室温孵育1 h。避光加入ECL发光液,用凝胶成像系统曝光成像。以β-actin或p38为内参,将条带标准化,分析蛋白的相对表达水平。
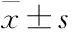
2 结果
2.1MCF-7/MX细胞的MDR表型Fig 1的MTT结果表明,与MCF-7敏感株相比,MCF-7/MX对MX、5-FU、DDP的耐药倍数分别为:70.45、6.68、21.47。Fig 3的Western blot结果表明,相对于敏感株MCF-7细胞,MCF-7/MX细胞的BCRP高表达(P<0.01)。这些结果证实BCRP是介导MCF-7/MX细胞MDR的重要机制。经黄芩素作用72 h后,MCF-7和MCF-7/MX细胞的IC50分别为28.59 μmol·L-1和27.42 μmol·L-1,差异无显著性(P>0.05),证实黄芩素对敏感株MCF-7和耐药株MCF-7/MX均有杀伤作用,提示黄芩素对MCF-7/MX细胞可能有逆转耐药作用。
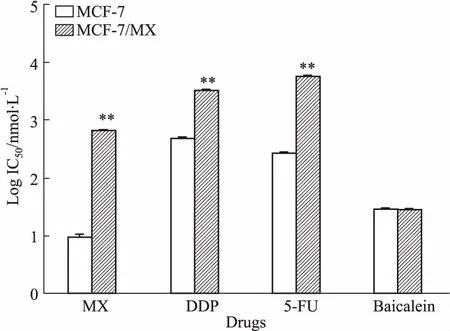
Fig 1 Resistance of MCF-7 and MCF-7/MX cells
**P<0.01vsMCF-7 cells. IC50values represent the mean of three independent experiments.
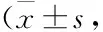
Tab 1 Reversal effect of baicalein on drug resistance of MCF-7/MX cells n=3)
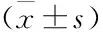
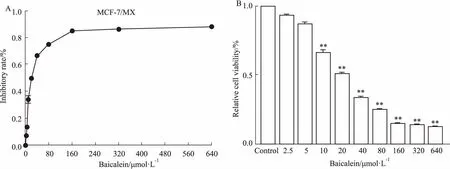
Fig 2 Effects of baicalein on proliferative inhibition (A) andrelative viability (B) in MCF-7/MX cells n=3)
**P<0.01vscontrol
2.2黄芩素逆转耐药浓度的确定黄芩素(2.5 ~ 640 μmol·L-1)浓度依赖性地抑制MCF-7/MX细胞的增殖。2.5、5 μmol·L-1的黄芩素对MCF/MX细胞的IR分别为(7.06±1.23)%和(13.44±1.88)%,均小于15%,被选择为逆转耐药浓度做后续实验(Fig 2)。
2.3黄芩素对MCF-7/MX细胞的逆转耐药作用2.5、5 μmol·L-1黄芩素与MX、DDP、5-FU联合使用,可增强MCF-7/MX细胞对这些化疗药物的敏感性(Tab 1)。2.5、5 μmol·L-1的黄芩素对上述3种化疗药物的逆转倍数分别为(3.57、15.44)、(1.54、2.62)、(1.39、1.93),相对逆转倍数分别为(73.00%、94.87%)、(41.70%、72.71%)、(29.40%、50.63%)。
2.4黄芩素对乳腺癌细胞中BCRP表达的影响如Fig 3所示,2.5、5 μmol·L-1的黄芩素作用于MCF-7/MX细胞72 h后,明显抑制其BCRP的蛋白表达,差异有统计学意义(P<0.01),且5 μmol·L-1黄芩素组BCRP降低较2.5 μmol·L-1组更明显(P<0.05)。
2.5黄芩素对乳腺癌细胞中p-p38、NF-κBp65表达的影响如Fig 4所示,相对于MCF-7细胞,MCF-7/MX细胞 p38磷酸化增强,NF-κB p65蛋白表达水平增高。2.5、5 μmol·L-1的黄芩素可减弱MCF-7/MX细胞 p38磷酸化,减少NF-κB p65蛋白表达,差异有统计学意义(P<0.01),且5 μmol·L-1黄芩素组较2.5 μmol·L-1组作用更明显(P<0.05)。
3 讨论
药物外排系统的改变是肿瘤耐药机制中最常见的一种,其中ABC转运蛋白表达增强会使药物浓度低于作用浓度,引起肿瘤耐药[5]。BCRP是ABC转运蛋白G亚家族成员,在药物的吸收、分布、消除及获得性耐药方面发挥着重要作用[6]。BCRP可特异性地泵出多种化疗药物,如米托蒽醌、拓扑替康、7-乙基-10-羟基喜树碱(SN-38)等,降低其化疗效果。肿瘤干细胞对多种化疗药物高度耐药,是癌症复发和转移的重要因素[7]。BCRP在肿瘤干细胞中高表达,严重阻碍化疗成功[8]。因此,BCRP已成为治疗多药耐药肿瘤以及根除肿瘤干细胞的重要靶点。
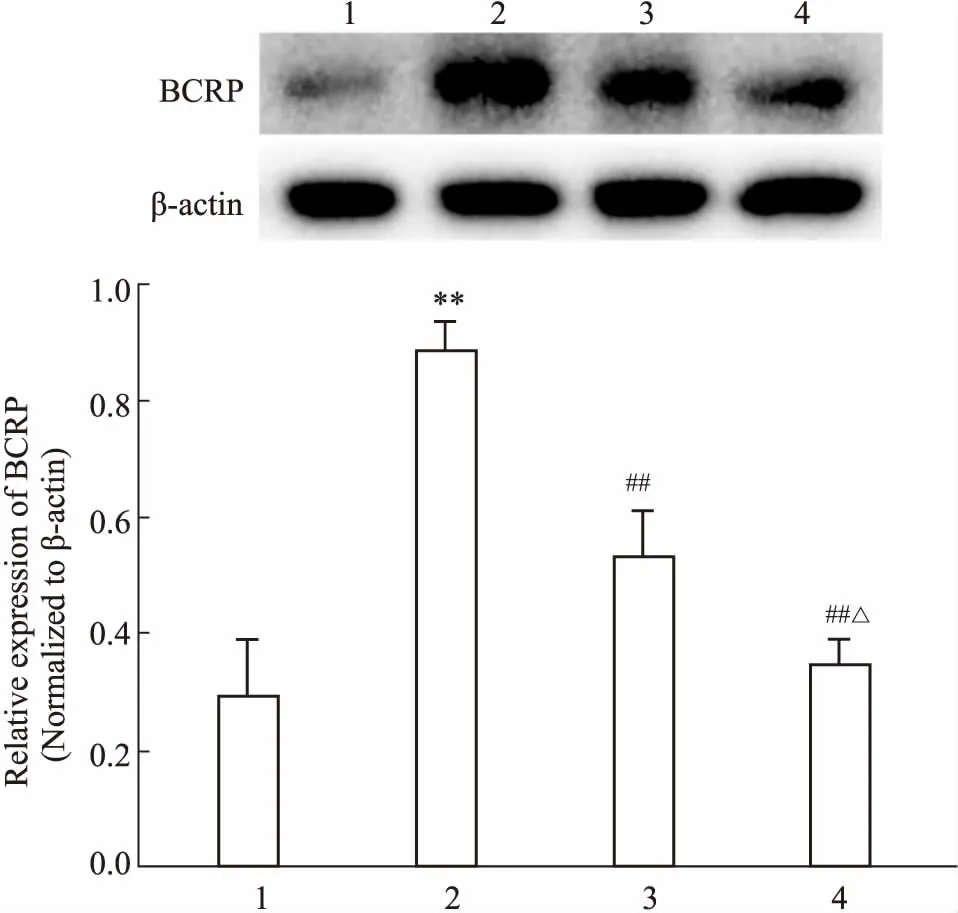
Fig 3 Effect of baicalein on expression ofBCRP by Western blot n=3)
1: MCF-7 group; 2: MCF-7/MX group; 3: MCF-7/MX+baicalein (2.5 μmol·L-1) group; 4: MCF-7/MX+baicalein (5 μmol·L-1) group.**P<0.01vsMCF-7 group;##P<0.01vsMCF-7/MX group;△P<0.05vsMCF-7/MX plus 2.5 μmol·L-1baicalein-treated group.
作为中药黄芩的有效成分之一,黄芩素已被证实可通过降低p-gp药物外排功能、增加细胞内药物浓度,逆转卵巢癌细胞的耐药[9];通过抑制糖酵解和PTEN/Akt/HIF-1α信号通路,逆转胃癌的耐药[10];还可通过增强缝隙连接,增强顺铂细胞毒性,提高化疗效果[11]。本研究结果证明,黄芩素(2.5、5 μmol·L-1)可增强MCF-7/MX细胞对MX、DDP、5-FU的敏感性,下调BCRP表达,逆转BCRP介导的乳腺癌细胞MDR。
丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)是一组重要的丝/苏氨酸蛋白激酶,可以调节多种细胞活动,包括细胞增殖、分化、凋亡或存活、炎症、先天免疫等[12]。研究表明,BCRP的蛋白表达上调与p38 MAPK信号通路的激活有密切关系[13]。本实验也证实,与MCF-7细胞相比,MCF-7/MX细胞的p38磷酸化增强。黄芩素(2.5、5 μmol·L-1)可抑制MCF-7/MX细胞p38的磷酸化。因此,黄芩素下调BCRP表达,可能与其抑制p38 MAPK信号通路有关。
NF-κB在介导肿瘤放、化疗耐受的分子机制中处于核心位置。多种信号分子和信号通路,如GSK-3β、p38、PI3K等可影响NF-κB转录活性或其上游信号转导通路,参与调节免疫、生长、炎症、肿瘤及凋亡等过程[14]。有文献表明,在BCRP高表达的耐药细胞中,NF-κB信号通路被明显激活,抑制NF-κB信号通路可以逆转肿瘤细胞的MDR[15]。本实验结果也证实,与MCF-7细胞相比,MCF-7/MX细胞的NF-κB p65蛋白表达升高,黄芩素能降低NF-κB p65的蛋白表达。因此,黄芩素下调BCRP表达,可能与其抑制NF-κB信号通路也有关。
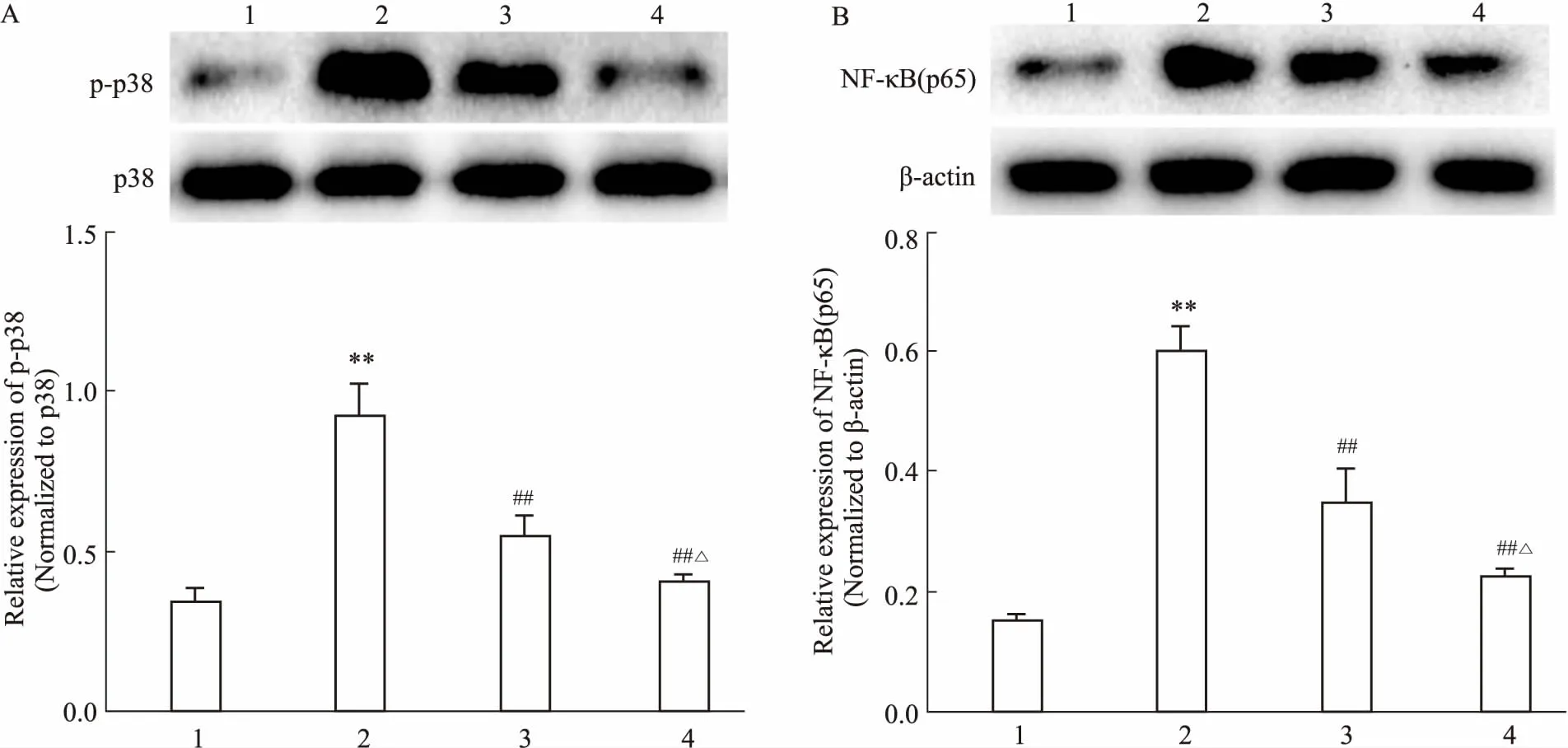
Fig 4 Expressions of p-p38 (A) and NF-κB p65 (B) in different groups by Western blot n=3)
1: MCF-7 group; 2: MCF-7/MX group; 3: MCF-7/MX+baicalein (2.5 μmol·L-1) group; 4: MCF-7/MX+baicalein (5 μmol·L-1) group.**P<0.01vsMCF-7 group;##P<0.01vsMCF-7/MX group;△P<0.05vsMCF-7/MX plus 2.5 μmol·L-1baicalein-treated group.
综上所述,黄芩素可通过抑制p38 MAPK通路和NF-κB信号通路,下调BCRP蛋白表达,有效逆转人乳腺癌耐药株MCF-7/MX细胞的MDR,但其具体作用靶点尚不清楚,还需进一步研究。黄芩素是一种极具开发价值的耐药逆转制剂,本研究为黄芩素在逆转MDR的临床应用提供了理论支撑,为耐药乳腺癌的成功治疗提供了实验依据。
[1] Takeo N, Douglas D R. Breast cancer resistance protein (BCRP/ABCG2): its role in multidrug resistance and regulation of its gene expression. [J].ChinJCancer, 2012,31(2): 73-99.
[2] Wang X K, He J H, Xu J H, et al. Afatinib enhances the efficacy of conventional chemotherapeutic agents by eradicating cancer stem-like cells [J].CancerRes, 2014,74(16): 4431-45.
[3] 王秀峰, 周钱梅, 苏式兵. 黄芩素抑制人乳腺癌细胞侵袭和迁移的实验研究 [J]. 中国药理学通报, 2010,26(6):745-50.
[3] Wang X F, Zhou Q M, Su S B, Experimental study on the baicalein inhibiting the invasion and migration of human breast cancer cells [J].ChinPharnmcolBull, 2010,26(6):745-50.
[4] Peng Y, Guo C, Yang Y, et al. Baicalein induces apoptosis of human cervical cancer HeLa cellsinvitro[J].MolMedRep, 2015,11(3): 2129-34.
[5] 高梦如, 魏小丽, 顾康生. 长链非编码RNA在肿瘤耐药中的作用 [J]. 中国药理学通报, 2017,33(12):1641-5.
[5] Gao M R, Wei X L, Gu K S. Role of long non-coding RNA in drug resistance of tumor. [J].ChinPharnmcolBull, 2017,33(12): 1641-5.
[6] Ni Z, Bikadi Z, Rosenberg M F, et al. Structure and function of the human breast cancer resistance protein (BCRP/ABCG2) [J].CurrDrugMetab, 2010,11(7): 603-17.
[7] 王 蔚, 余苏云, 吴佳伟, 等. 肿瘤血管生成抑制剂的治疗局限和策略[J]. 中国药理学通报, 2017,33(11):1489-92.
[7] Wang W, Yu S Y, Wu J W, et al. Therapeutic limitations and strategies of angiogenesis inhibitors[J].ChinPharnmcolBull, 2017,33(11): 1489-92.
[8] 赵小琴, 符立梧. 肿瘤干细胞耐药机制研究进展 [J]. 中国药理学通报, 2012,28(12):1637-42.
[8] Zhao X Q, Fu L W. Research progress in mechanisms of drug resistance in cancer stem cells [J].ChinPharnmcolBull, 2012,28(12):1637-42.
[9] 黎丹戎, 张 玮, 唐东平, 等. 黄芩素对卵巢癌耐药细胞株A2780/ADM逆转作用实验研究 [J]. 肿瘤, 2004,24(2): 111-3.
[9] Li D R, Zhang W, Tang D P, et al. A study of the reverse effect of scutellarein on multidrug-resistant human ovarian cancer cell line A2780/ADM [J].Cancer, 2004,24(2): 111-3.
[10] Chen F, Zhuang M, Zhong C, et al. Baicalein reverses hypoxia-induced 5-FU resistance in gastric cancer AGS cells through suppression of glycolysis and the PTEN/Akt/HIF-1alpha signaling pathway [J].OncolRep, 2015,33(1): 457-63.
[11] Wang Y, Wang Q, Zhang S, et al. Baicalein increases the cytotoxicity of cisplatin by enhancing gap junction intercellular communication [J].MolMedRep, 2014,10(1): 515-21.
[12] Kim E K, Choi E J. Compromised MAPK signaling in human diseases: an update [J].ArchToxicol, 2015,89(6): 867-82.
[13] 曲文志, 李子豪, 张云微, 等. 生长激素释放肽对乳腺癌耐药蛋白表达的影响及意义 [J]. 医学临床研究, 2016,33(10): 1880-2.
[13] Qu W Z, Li Z H, Zhang Y W, et al. Effect of ghrelin on the expression of breast cancer resistance protein in breast cancer [J].MedClinRes, 2016,33(10): 1880-2.
[14] Hoesel B, Schmid J A. The complexity of NF-kappaB signaling in inflammation and cancer [J].MolCancer, 2013,12: 86.
[15] Wang Q P, Wang Y, Wang X D, et al. Survivin up-regulates the expression of breast cancer resistance protein (BCRP) through attenuating the suppression of p53 on NF-kappaB expression in MCF-7/5-FU cells [J].IntJBiochemCellBiol, 2013,45(9): 2036-44.

