骨骼肌急性钝挫伤修复过程中自噬相关因子的表达变化*
罗 翱,唐成林,黄思琴,赵丹丹,张安宁,郭全虎,高睿琦,曹 净
(重庆医科大学中医药学院,重庆400016)
骨骼肌是人体体量最大的组织,直接参与人体的各项生命活动。近年来,由于交通、体育等行业的发展,骨骼肌损伤的发病率逐年上升。90%的骨骼肌损伤属于钝挫伤或牵拉伤[1],而最常见的运动损伤中就是急性骨骼肌钝挫伤,尤其以股四头肌和腓肠肌损伤最常见[2]。骨骼肌损伤主要表现为肌纤维的断裂和肌细胞的溶解,其损伤修复时间较长,愈后较差,甚至造成骨骼肌功能和结构的不可逆损害,严重影响患者的日常生活。基于此,国内外学者对骨骼肌损伤修复相关机制进行大量的研究,但尚未得到统一观点和意见。
目前,自噬是国内外研究的热点和难点。自噬是指细胞在自噬相关基因的调控下,通过溶酶体途径降解自身衰老、变性及凋亡的细胞器和大分子物质,从而维持细胞内环境的稳定[3]。自噬既可以作为一种适应性机制,清除老化的和折叠错误的蛋白质及受损的线粒体等细胞器,也能在一定程度上促进细胞增殖和迁移[4]。实际上,自噬的过程就是细胞内容物被降解成核苷酸、氨基酸及游离脂肪酸,从而被细胞再次利用,为大分子物质的合成和ATP的产生提供必需的原材料的过程[5],通常也认为该过程是促进细胞存活的过程[6]。本课题组前期对骨骼肌损伤修复机制进行大量的研究,主要集中在炎症水平、肌卫星细胞增殖分化及细胞膜修复等方面[7-9],本实验拟通过建立大鼠骨骼肌急性钝挫伤模型,观察损伤前后不同时间点细胞自噬相关因子表达的变化,以期补充并完善骨骼肌损伤修复的相关机制,为临床治疗骨骼肌钝挫伤提供新思路。
1 材料与方法
1.1 实验动物
健康成年SPF级雄性SD大鼠30只,体重(200±20)g,由重庆医科大学动物实验中心提供(SCXK(渝)2012-0001)。实验动物饲养于重庆医科大学实验动物中心SPF级动物房,室内保持光照、黑暗12 h昼夜节律,室温(22±1)℃,相对湿度50%~60%,自由饮食饮水。
1.2 主要试剂及仪器
主要试剂:4%多聚甲醛(Biosharp生物科技公司);2.5%戊二醛(重庆医科大学电镜室);苏木精-伊红(HE)染液(北京索莱宝科技有限公司);各基因引物、逆转录试剂盒、SYBR Green、Trizol、DEPC水(Takara-宝生物工程(大连)有限公司);氯仿、异丙醇(重庆川东化工(集团)有限公司);各蛋白质一抗、各蛋白质二抗(Cell Signaling Technology(CST));抗体增强液(TOYOBO);ECL发光液(Millipore);脱脂奶粉(伊利集团)。
主要仪器:台式高压蒸汽灭菌锅、恒温孵育箱(上海精宏实验设备有限公司);生物显微镜、图像采集系统(Olympus);Hitachi-7500型透射电镜(重庆医科大学电镜室);匀浆器(IKA);低温离心机(长沙湘仪离心机有限公司);全波长酶标仪(BioTek);金属浴、温控摇床(江苏海门市其林贝尔(Qilinbeier)仪器制造有限公司);Bio-Rad标准电泳装置、实时荧光定量 PCR仪(Bio-Rad);Odyssey Fc发光仪(Gene Company Limited)。
1.3 大鼠骨骼肌急性钝挫伤模型复制
参考Kami K[10]的造模方法。自备打击器,打击器为一打击面平坦的空心铝制圆柱体(直径1 cm,长20 cm,质量20 g),底面与木制圆柱体相接(直径1 cm,长2 cm,质量2 g),木制打击面与打击部位直接接触,自制铁球640 g,从25 cm高处落下,重力6.27 N,产生动能1.57 J。造模前用小动物剃毛器剔除大鼠右小腿内侧皮肤被毛。乙醚麻醉后,将大鼠右小腿外展屈曲90°固定,打击部位为右小腿内侧面(其皮下为腓肠肌中段),抽出铁片使铁球下落导致一次性打击伤并标记。造模后通过大体观察、触诊及病理学检测,证实腓肠肌有一定收缩功能障碍且无骨折,属急性腓肠肌钝挫伤模型。重力锤的投放和大鼠的固定均由一人操作,以保证打击力度、损伤部位及程度的一致性。
1.4 分组及取材
30只SD大鼠适应性喂养一周后,随机选取6只作为对照组,对照组于造模前一天取材。其余24只大鼠制备腓肠肌急性钝挫伤模型,然后随机分为4组(n=6),各组分别在造模后 3 d、5 d、7 d、14 d取材。取材前,大鼠腹腔注射2%戊巴比妥钠(0.5 ml/200 g体重)麻醉,解剖并分离大鼠右侧腓肠肌,迅速将离体的腓肠肌放在干净的滤纸上均分为3份,一份置2.5%戊二醛中固定,待做透射电镜检测;另一份置4%多聚甲醛中固定,以备石蜡包埋、冰冻切片及HE染色;第三份置液氮中速冻2 h,然后转移到-80℃冰箱保存,以备Western blot及RT-PCR检测。
1.5 腓肠肌组织HE染色及病理学评价
将各组大鼠经4%多聚甲醛固定的腓肠肌取出,自来水冲洗,酒精梯度脱水,二甲苯透明,石蜡包埋切片并进行HE染色。光学显微镜下观察各组大鼠腓肠肌组织形态学变化,并用图像采集系统获取所需图片,进行组织学和病理学分析。
1.6 腓肠肌组织透射电镜观察及形态学评价
取经2.5%戊二醛固定的腓肠肌,使用pH 7.2的磷酸缓冲盐溶液漂洗3次,1%锇酸固定2 h,4℃下梯度酒精(50%、70%、90%,100%)脱水;置换(环氧丙烷,环氧丙烷和树脂1∶1混合液,环氧丙烷和树脂1∶4混合液,纯树脂);环氧树脂包埋后制作半薄切片(甲苯胺蓝染色-光镜下定位-定位于横切);超薄切片机切片后铜网捞片,3%醋酸双氧铀-枸橼酸铅双染色法染色。待样品干燥后,透射电镜观察受损肌组织超微结构变化并进行分析。
1.7 Western blot检测自噬相关蛋白质表达水平
自-80℃取出适量腓肠肌组织,加入裂解液匀浆,离心取上清,BCA法测定蛋白质浓度,在一定量上清液中加入缓冲液后金属浴10 min,置于冰上待上样。SDS-PAGE分离蛋白质,电转移至PVDF膜,置摇床上用5%脱脂奶粉封闭1 h。轻轻冲洗PVDF膜,将其置一抗稀释液中4℃摇床上孵育过夜。次日用TBST洗膜10min×3次,加对应的二抗稀释液置摇床上室温孵育1 h,用TBST洗膜10 min×3次。将ECL化学发光液均匀涂于膜上反应2min,置发光机中曝光显影成像,以Image Studio Ver 5.0软件统计灰度值并进行分析。
1.8 RT-PCR检测自噬相关基因mRNA表达水平
自-80℃冰箱取出各组大鼠腓肠肌组织约30 mg,加入1ml Trizol试剂匀浆,依次加氯仿,振荡,离心取上清;加异丙醇,振荡,离心弃上清,75%酒精洗涤2次,晾干;加适量DEPC水溶解RNA并弹匀离心,随后测定RNA浓度。根据逆转录体系调整RNA浓度并计算逆转录所需上样量,而后逆转录合成cDNA,反应条件:37℃、15min、85℃、5 s、4℃、∞。按SYBR®Premix Ex TaqTMII(Tli RNase H Plus)配置反应混合物后,根据反应体系所需量上样并进行RTPCR扩增,上机条件:预变性(95℃、30 s);扩增(95℃、5 s,60℃、30 s);溶解曲线(95℃、5 s,60℃、1 min)。通过CFXmanager 3.1软件读取Ct值。各基因引物序列如表1。
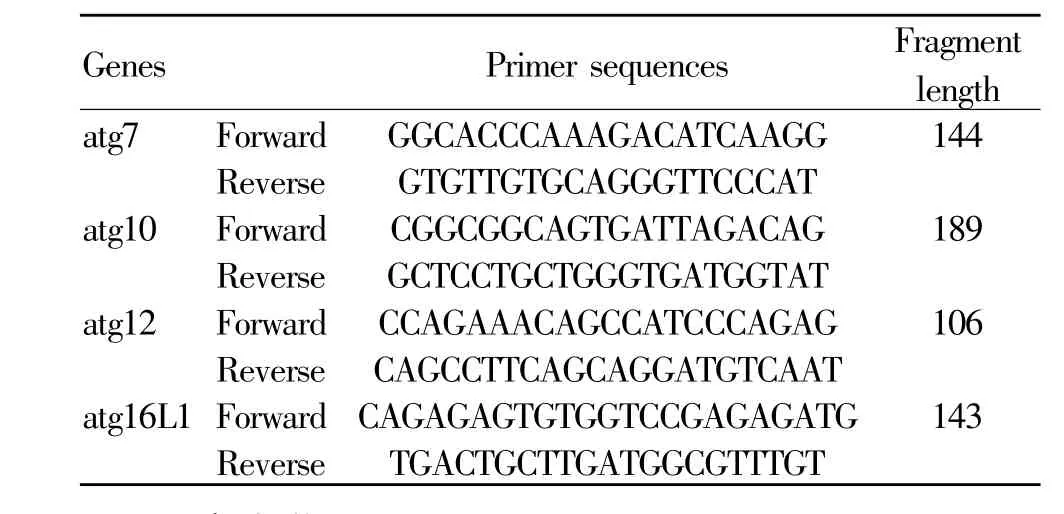
Tab.1Primer sequences of RT-PCR
1.9 统计学处理
实验数据用均数 ±标准差)表示,采用SPSS 19.0统计软件进行单因素方差分析(one-way ANOVA),以LSD法进行组间两两比较。
2 结果
2.1 骨骼肌急性钝挫伤后各组大鼠组织变化情况
HE结果(图1,见彩图页Ⅰ)显示:对照组大鼠骨骼肌肌纤维呈钝角多边形,肌细胞大小结构均一,胞核大多位于细胞边缘,肌节结构完整,肌丝排列整齐(图1A)。与对照组比较,其余各组均可见大量肌纤维溶解及炎细胞浸润(图1A-E)。自然恢复3 d组,同一视野下可见少量的成肌细胞,且肿胀明显,另有大量的炎细胞浸润(图1B)。自然恢复5 d组与3 d组比较差异不大,依然存在大量的炎细胞浸润,肌纤维断裂溶解现象也较明显,肌细胞明显变形,细胞出现崩解和萎缩(图1C)。自然恢复7 d组,可见部分新生肌细胞和小血管,细胞排列相对紧密但较紊乱,其间可见明显的结缔组织填充,炎细胞浸润减轻(图1D)。自然恢复14 d组,可见肌纤维排列整齐且致密,有轻微肿胀,肌纤维大小结构均一,细胞核移至细胞边缘,损伤部位初步愈合(图1E)。
电镜观察结果(图2)显示:对照组肌原纤维无异常,肌节排列整齐,明暗带相间,线粒体横向排列于Z带附近,形态无异常,肌质网无扩张,可见明显的三联体(图2A)。自然恢复3 d组,可见线粒体明显肿胀,且结构异常,嵴变性,空泡化,肌原纤维部分溶解变形,Z线部分消失且排列紊乱,肌质网轻度扩张(图2B)。自然恢复5 d组,可见大面积的线粒体肿胀,排列紊乱,肌原纤维小灶状丢失,Z线大多消失且部分飘移,呈近似水纹状改变,肌质网扩张明显(图2C)。自然恢复7 d组,线粒体肿胀依旧明显,Z线消失或部分增粗,肌质网扩张明显,肌原纤维排列依旧紊乱(图2D)。自然恢复14 d组,可见稍清晰的Z线,形态近似于对照组,线粒体肿胀减轻、嵴疏松变性明显,线粒体排列向Z线两侧移位,肌质网扩张减轻但仍较对照组明显(图2 E)。
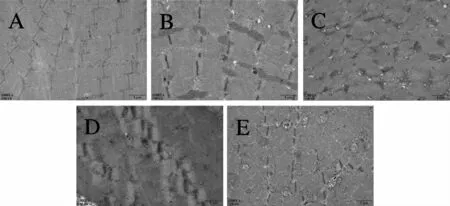
Fig.2 The gastrocnemius electronmicroscopy of the control group and the natural recovery group for 3 d,5 d,7 d,14 d(×20 000,scale=1μm)
2.2 骨骼肌急性钝挫伤后各组大鼠自噬相关蛋白质LC3-II、P62表达的变化
Western blot结果(表2)显示,在骨骼肌钝挫伤自然恢复 3 d、5 d、7 d、14 d过程中,LC3-II与 P62总体呈现先升高后降低的变化趋势。其中,与对照组和自然恢复14 d组比较,自然恢复3 d、5 d、7 d组LC3-II表达水平显著升高(P<0.01),3 d、7 d组也较5 d组明显升高(P<0.01)。同样,与对照组相比,在损伤后第3天 P62达到高峰(P<0.01),损伤后第5天表达开始下降但仍明显高于对照组(P<0.05),14 d组P62表达已恢复至正常水平。
Tab.2 The relative expression levels of LC3-II and P62 in gastrocnemiusmuscle of the control group and the natural recovery groups for 3 d,5 d,7 d,14 d(,n=3)
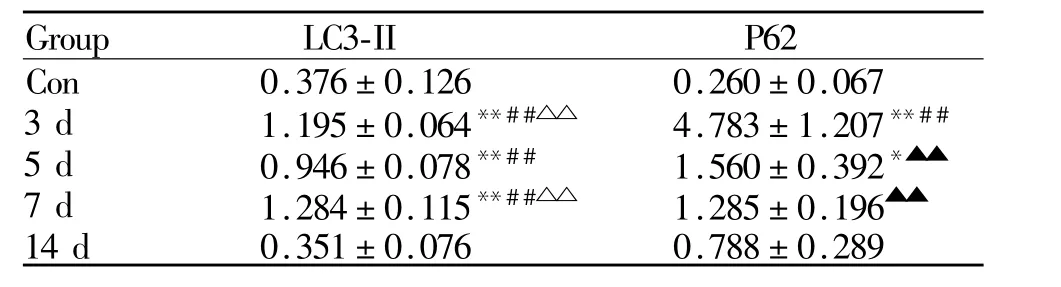
Tab.2 The relative expression levels of LC3-II and P62 in gastrocnemiusmuscle of the control group and the natural recovery groups for 3 d,5 d,7 d,14 d(,n=3)
*P<0.05,**P<0.01 vs controlgroup;##P<0.01 vs14 d;△△P<0.01 vs 5 d;▲▲P<0.01 vs 3 d
Group LC3-II P62 Con 0.376±0.126 0.260±0.067 3 d 1.195±0.064**##△△ 4.783±1.207**##5 d 0.946±0.078**## 1.560±0.392*▲▲7 d 1.284±0.115**##△△ 1.285±0.196▲▲14 d 0.351±0.076 0.788±0.289
2.3 骨骼肌急性钝挫伤后各组大鼠自噬相关基因atg7、atg10、atg12、atg16L1mRNA表达的变化
RT-PCR结果(表3)显示,骨骼肌钝挫伤在自然恢复 3 d、5 d、7 d、14 d这一过程中 atg10mRNA表达呈现先降低后升高的趋势,其中3 d、5 d、7 d组明显低于对照组与 14 d组(P<0.01)。atg7、atg12、atg16L1mRNA表达总体呈现先升高后降低的趋势,3 d、5 d、7 d各组明显高于对照组与14 d组(P<0.01,P<0.05,P<0.01);与 5 d组比较,3 d、7 d组atg7与atg12mRNA表达量明显升高(P<0.05,P<0.01);与对照组比较,自然恢复 14 d组 atg7、atg12、atg16L1mRNA表达呈下降趋势,但无统计学差异。
Tab.3 The relative expression levels of atg7,atg10,atg12 and atg16 L1in the gastrocnemiusmuscle of the control group and the natural recovery group for 3 d,5 d,7 d,14 d(,n=3)
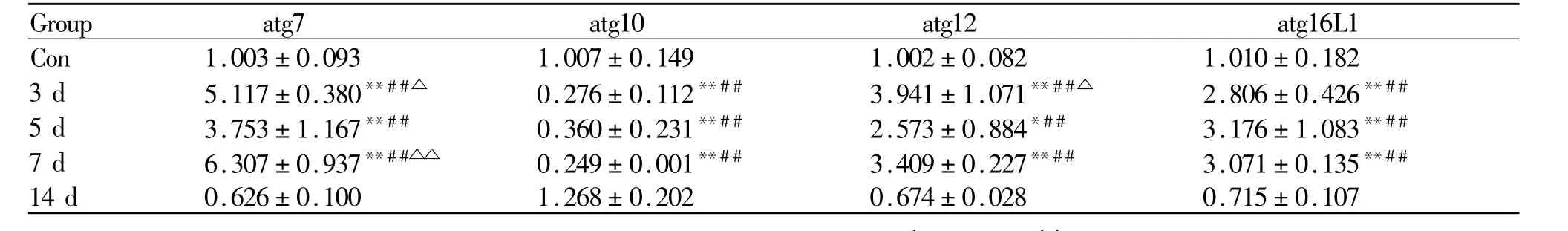
Tab.3 The relative expression levels of atg7,atg10,atg12 and atg16 L1in the gastrocnemiusmuscle of the control group and the natural recovery group for 3 d,5 d,7 d,14 d(,n=3)
*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs 14 d;△P<0.05,△△P<0.01 vs 5 d
Group atg7 atg10 atg12 atg16L1 Con 1.003±0.093 1.007±0.149 1.002±0.082 1.010±0.182 3 d 5.117±0.380**##△ 0.276±0.112**## 3.941±1.071**##△ 2.806±0.426**##5 d 3.753±1.167**## 0.360±0.231**## 2.573±0.884*## 3.176±1.083**##7 d 6.307±0.937**##△△ 0.249±0.001**## 3.409±0.227**## 3.071±0.135**##14 d 0.626±0.100 1.268±0.202 0.674±0.028 0.715±0.107
3 讨论
起“管家机制”作用的自噬一直是国内外研究的热点及难点。目前,哺乳动物自噬的发生机制尚未完全阐明。但在酵母中已鉴定出约30多种与自噬相关的基因,同样在哺乳动物中也已鉴定出一些同源基因而且也具有一定的功能[11,12]。在生理状态下,几乎所有的细胞都存在基础水平的自噬现象,以便清除未折叠或折叠错误的蛋白质,降解大分子物质,为细胞重建、再生和修复提供必需的原材料,实现物质的循环再利用,维持细胞内环境的稳定。但在某些特殊状态下,例如缺血缺氧、氧化应激、DNA损伤,饥饿等条件下,细胞会上调自噬以清除损伤的细胞器,实现能量的再利用,抑制凋亡因子的释放,减少细胞损害[13]。
自噬的核心分子机制主要由atg相关基因及自噬微管相关蛋白1轻链3组成,在自噬级联反应数个连续步骤中起编排功能。本实验通过建立骨骼肌急性钝挫伤动物模型,检测自噬相关蛋白LC3-Ⅱ、P62及自噬相关基因 atg7、atg10、atg12、atg16L1等指标,观察损伤后上述因子的变化情况。研究发现,与正常组比较,损伤后 3 d、5 d、7 d、14 d,atg7,atg12,atg16L1mRNA表达呈现先升高后降低的规律性变化,且变化趋势一致,atg10变化与之正好相反。atg7是具有泛素E1样酶活性的自噬相关基因,已证实Atg7是atg12-atg5泛素样蛋白通路上游的蛋白质分子,在自噬体扩张伸展中具有重要作用[14]。首先水解的Atg7通过自身被激活的507位半胱氨酸残基与Atg12的C末端甘氨酸残基结合形成高能硫酯键,催化Atg12活化,之后转运至具有泛素E2样酶活性的Atg10,再通过与Atg5连接形成异肽键,构成Atg7-Atg5系统,而后再和Atg16L1以共价键结合,组成三元复合物 Atg12-Atg5-Atg16L1[14],该复合物与前自噬泡外膜结合,促进自噬泡的伸展和延伸。因此,当细胞自噬活性增强时,Atg7、Atg12、Atg16L1表达应明显增多,Atg10应明显减少。结合上述实验结果,不难发现骨骼肌急性钝挫伤后自噬相关基因转录水平发生了改变,改变提示自噬活性明显增强,随着机体损伤的自我修复,自噬活性又逐渐降至损伤前的基础状态,提示自噬相关基因 atg7,atg10,atg12,atg16L1参与损伤的修复,推测肌肉损伤修复的速度很可能与该基因的转录水平高低密切相关。同时,研究表明Atg7也参与LC3-I的活化,促进 LC3-I与PE(phosphatidyl ethanolamine,磷脂酰乙醇胺)结合形成自噬标记分子 LC3-II。LC3(microtubule-associated protein 1 light chain 3)是哺乳动物中Atg8的同源物,它以两种形式存在,即 LC3-I和 LC3-II,LC3-I与 PE结合成为 LC3-II,是 LC3-I的活化形式,LC3-II含量与自噬泡数量的多少成正比,当细胞内 LC3-I向LC3-II转化增加时,细胞自噬水平明显升高。因此,检测细胞内LC3-II含量变化,可以判断自噬水平的高低[15,16]。同样,由原癌基因 c-myc编码的 P62蛋白位于细胞质中,当细胞自噬时,P62与经泛素化的蛋白质结合,再与LC3-II结合形成复合物,并最终在溶酶体酶的作用下不断被降解[15]。换言之,细胞自噬水平升高时P62水平理论上应下降,而自噬活性受抑制时,P62理论上则不断累积。因此,P62同样可作为反映细胞自噬活性高低的标记蛋白质。作者采用Western blot检测损伤后不同时间点腓肠肌中LC3-II和P62水平,发现骨骼肌钝挫伤后在自然恢复 3 d、5 d、7 d、14 d过程中,LC3-II与 P62总体呈现先升高后降低的趋势,其中3 d、5 d、7 d组LC3-II水平较正常组与14 d组明显升高,14 d组恢复至正常水平。同样,与正常组对比,P62在损伤后第3天达到高峰,损伤后第5天表达开始下降,第14天恢复至正常水平,该结果也表明骨骼肌损伤修复过程中自噬活性一开始会明显增强,但随着机体自我修复,自噬活性会逐渐降至损伤前的基础状态。值得注意的是,骨骼肌损伤后LC3-II和P62两者表达并未呈现完全相反的变化,只是出现峰值的时间不一,可能系P62不仅参与细胞自噬过程,同时也参与多种生命过程,例如有研究发现P62参与细胞抗氧化应激反应中的重要通路NRF2-Keap1通路[17],同时有研究也表明P62的表达与细胞的分化有关[18]。因此需开展进一步实验,并分析P62在骨骼肌损伤中扮演的角色。
综上所述,本实验建立大鼠骨骼肌急性钝挫伤模型,通过HE染色和透射电镜对损伤后不同时间点的腓肠肌组织进行形态学观察,同时对自噬相关基因 atg7、atg10、atg12、atg16L1 mRNA表达水平及自噬相关蛋白LC3-II、P62表达水平的变化进行分析。结果直接和间接证实,骨骼肌急性钝挫伤后自噬活性显著提高,而随着损伤的修复,自噬活性又恢复至损伤前水平,提示细胞自噬参与骨骼肌损伤的修复过程,推测损伤修复的速度很可能与上述指标的表达水平密切相关,这为研究不同治疗方法对骨骼肌损伤修复的作用机制提供新思路。
[1] Crisco JJ,Jokl P,Heinen GT,etal.Amuscle contusion injury model.Biomechanics physiology histology[J].AM J SportsMed,1994,22(5):702-710.
[2] Järvinen TA,Järvinen TL,Kääriäinen M,et al.Muscle injuries:biology and treatment[J].Am J Sports Med,2005,33(5):745-764.
[3] 寇现娟,陈 宁.自噬在骨骼肌质量维持中的作用与调控[J].武汉体育学院学报,2012,46(11):66-71.
[4] 朱焕勉,陈 然,薛 峰,等.自噬抑制剂氯喹对低氧诱导肺动脉平滑肌细胞增殖的影响[J].中国应用生理学杂志,2014,30(1):8-12.
[5] 胡中慧,马慧萍,樊鹏程,等.PC12细胞在缺氧条件下的自噬现象[J].中国应用生理学杂志,2017,33(1):65-68.
[6] Pfeifer U.Morphologicaland functionalaspects of cellularautophagy[J].Acta Morphol Acad Sci Hung,1972,20(3):247-267.
[7] 田 源,唐成林,黄思琴,等.按摩对大鼠骨骼肌急性钝挫伤后膜修复蛋白dysferlin和annexinA1表达的影响[J].中国康复医学杂志,2016,31(8):841-846.
[8] 杨 辉,常 青,唐成林,等.跑台运动训练与按摩联合作用对大鼠骨骼肌急性损伤修复过程中炎症的发展及肌卫星细胞增殖的影响[J].体育科学,2015,35(3):51-58.
[9] 杨 辉,唐成林,常 青,等.在大鼠骨骼肌急性损伤修复过程中按摩对神经型一氧化氮合成酶、肝细胞生长因子 mRNA表达的影响[J].中国康复医学杂志,2015,30(3):224-230.
[10]Kami K,Masuhara M,Kashiba H,et al.Changes of vinculin and extracellularmatrix components following blunt trauma to rat skeletalmuscle[J].Med Sci Sport Exer,1993,25(7):832-840.
[11]Suzuki K,Ohsumi Y.Molecularmachinery of autophagosome formation in yeast,Saccharomyces cerevisiae[J].FEBS Lett,2007,581(11):2156-2161.
[12]Ferraro E,Cecconi F.Autophagic and apoptotic response to stress signals inmammalian cells[J].Arch Biochem Biophys,2007,462(2):210-219.
[13]Levine B,Yuan J.Autophagy in celldeath:an innocent convict[J]?JClin Invest,2005,115(10):2679-2688.
[14]Ohsumi Y.Molecular dissection of autophagy:two ubiquitinlike systems[J].Nat Rev Mol Cell Biol,2001,2(3):211-216.
[15]Kabeya Y,Mizushima N,Ueno T,etal.LC3,amammalian homologue of yeast Apg8p,is localized in autophagosome membranes after processing[J].EMBO J,2000,19(21):5720-5728.
[16] Mizushima N,Yoshimori T.How to interpret LC3 immunoblotting[J].Autophagy,1900,3(6):542-545.
[17]Hayes JD,Mcmahon M.NRF2 and KEAP1 mutations:permanent activation of an adaptive response in cancer[J].Trends Biochem Sci,2009,34(4):176-188.
[18]Su Y,Qian H,Zhang J,et al.The diversity expression of p62 in digestive system cancers[J].Clin Immunol,2005,116(2):118-123.

