牛磺酸镁抗豚鼠尖端扭转型室速的作用研究*
李 燕,孙 凯,安梦瑶,潘莹莹,孙 涛,尹永强,康 毅,娄建石△
(1.天津医科大学基础医学院药理学系,天津300070;2.天津市武清区人民医院,天津301700)
尖端扭转型室速(torsades de Pointes,TdP)是一类特殊的快速室性心律失常,心电图特点是QRS波群增宽变形且振幅不等地在等电位线上下扭动,通常在原发或继发性LQTS(long QT syndrome)的基础上发生,临床上常表现为晕厥和心源性猝死[1]。目前,一般认为TdP的发生与折返和触发活动有关[2]。心脏心室复极延缓可引起早后除极(early afterdepolarization,EAD),形成触发活动,启动 TdP的发生;而心室复极延缓造成的心室肌异质性进一步增大,易形成折返,从而维持TdP的发生[3]。
迄今为止,治疗TdP的方法主要分为手术和药物两大类。手术治疗方面主要包括颈交感神经切除术、安装起搏器[4]以及埋藏式复律除颤器(implantable cardioverter defibrillator,ICD)等[5]。其中,ICD预防和治疗猝死效果最好,但费用昂贵,存在误放电、反复更换等问题。药物治疗方面可应用的有利多卡因、硫酸镁[6,7]、阿托品等,但药物治疗的效果有限。因此,研究治疗TdP的新药仍然是该领域内的热点与难点。
牛磺酸镁配位化合物(taurine magnesium coordination compound,TMCC)是以牛磺酸为配体,与痕量金属离子镁(Mg2+)配位结合得到的新型化合物,已进行了抗心律失常作用的筛选研究。研究表明,TMCC防治氯化钙、哇巴因、乌头碱、肾上腺素诱导的心律失常效果肯定,且呈明显剂量依赖关系[8]。此外,本室前期在离体心脏水平的研究中发现,TMCC可减慢心率、延长有效不应期。因此,我们设想TMCC可能具有抗TdP的作用。本实验将探索TMCC抗TdP的作用。
1 材料与方法
1.1 实验动物
体重250~350 g的健康成年雄性豚鼠(SPF级,SCXK-2014-0012),购自中国人民解放军军事医学科学院实验动物中心。
1.2 药品与试剂
Chromanol 293B,批号:06798368,sigma;TMCC,由天津医科大学药理学教研室合成。NaCl,分析纯(批号:20141124);KCl,分析纯(批号:20150506);葡萄糖(glucose),分析纯(批号:20141028),均购自天津市风船化学试剂科技有限公司。KH2PO4,分析纯(批号:20110306);CaCl2,分析纯(批号:20140903);NaHCO3,分析纯(批号:20150803),均购自天津市光复精细化工研究所。MgSO4,分析纯(批号:20110811),购自天津市化学试剂批发公司。二甲亚砜(DMSO),Amresco分装,美国。乌拉坦,化学纯(批号:20140923),上海山浦化工有限公司。0.9%生理盐水,百特国际有限公司。
1.3 主要仪器
Langendorff灌流装置(GL-2),超级恒温水浴(HW-1000),成都泰盟软件有限公司;BIOPAC/MP150,美国BioPac;心电图记录电极,实验室自制;FA1104型电子分析天平,上海舜宇恒平科学仪器有限公司;LD动物称量秤,沈阳龙腾电子有限公司;PHS-3C型酸度计,上海精密科学仪器有限公司雷磁仪器厂。
1.4 实验分组
(1)TdP模型组;(2)TdP模型 +1 mmol/L TMCC组;(3)TdP模型 +2 mmol/L TMCC组;(4)TdP模型+4 mmol/L TMCC组。
1.5 液体配制
1.5.1 K-H灌流液(mmol/L) NaCl 118.5,KCl 4.7,MgSO41.2,CaCl21.8,NaHCO324.8,KH2PO41.2,glucose 10。预先通入混合氧气(95%O2+5%CO2),20min后调节pH值至7.4。
1.5.2 低钾 K-H灌流液(mmol/L) 除总钾离子浓度降为 1.8mmol/L(减少的 KCl用等摩尔量的 NaCl代替)外,其余试剂组成同K-H灌流液。预先通入混合氧气(95%O2+5%CO2),20min后调节pH值至7.4。
1.5.3 药物母液 Chromanol 293B(40 mmol/L),用DMSO溶解配制而成;TMCC(200 mmol/L),用纯水溶解配制而成;实验过程中确保DMSO浓度不超过千分之一。
1.6 离体心脏摘取及Langendorff豚鼠离体心脏灌流法
取健康成年雄性豚鼠,称重,腹腔注射25%乌拉坦1.0 g/kg麻醉。将豚鼠仰卧位固定于鼠台上,剪去胸部毛发。快速剪开胸腔暴露心脏,从主动脉根部剪断主动脉后游离出心脏,放入预冷(4℃)的K-H灌流液中,轻轻按压,挤出心脏中残余血液。修剪除去脂肪、结缔组织及心包膜。将灌流装置插管末端逆行插入主动脉,以预处理过的(预处理包括:配制好的液体进行通氧、调PH值,以及在灌流前先将灌流液放在37℃恒温水浴中预热)K-H灌流液在37℃恒温水浴条件下灌流,灌注压 60~70 mmHg。从游离出心脏到实现心脏灌流的过程最好不超过1 min,以免缺血时间过长对心脏造成较大损伤。同时要控制好主动脉插管深度,以免影响心脏正常搏动。固定好心脏,观察心脏逐渐恢复跳动,心脏呈嫩粉色,无梗死区域,无室颤。心脏搏动稳定后,将心电图记录电极的正、负极分别贴附在心尖和主动脉根部,记录心电图。给药前心脏需平衡20 min,以保证能连续记录到稳定的心电图,进行后续实验。
1.7 观测指标
1.7.1 各组离体心脏TdP发生率 观察从造模开始60min内的TdP发生情况。
1.7.2 跨室壁复极离散度(transmural dispersion of repolarization,TDR)一个心动周期中从T波波峰至T波终止的时程段(Tpeak-Tend,Tp-Te),随心率和 QT间期变化而矫正得到 Tp-Te(corrected)=QTc×(Tp-Te)/QT,rTp-Te=(Tp-Te/QT)×100%。对于发生 TdP的离体心脏:在给药前及TdP发生前分别从心电图中连续量取5个心动周期的 RR、QT、Tp-Te,并取平均值;对于未发生TdP的离体心脏:在给药前及给药后60min分别从心电图中连续量取5个心动周期的RR、QT、Tp-Te,并取平均值。
1.7.3 QT间期不稳定性 在给药前及TdP发生前分别连续量取31个心动周期的QT间期进行计算,得到总不稳定性(total instability,TI),并通过重心计算短期不稳定性(short-term instability,STI)和长期不稳定性(long-term instability,LTI),随后分别计算给药前后 TI、STI、LTI变化的差值。
1.8 给药方式

1.9 统计学处理
运用AcqKnowledge 4.1软件分析处理记录的心电图,运用Origin Pro 8.0绘图。计量资料以均数±标准误()表示,运用 SPSS 20.0软件进行统计学分析,各组间比较采用配对 t检验或单因素方差分析,方差齐时,多组间比较采用LSD法、SNK法;方差不齐时,采用Dunnett T3法。
2 结果
2.1 TdP模型的建立
本实验使用 IKs(slowly activated delayed rectifier potassium current)阻滞剂 Chromanol 293B(10μmol/L)合并低钾(1.8 mmol/L)建立豚鼠离体心脏 TdP模型。如图1显示,建立模型过程中可见豚鼠离体心脏离散度增大,增加P-on-T样早后除极。TdP诱发率约 85.7%(图 2),发生时间为 39.83±7.81 min。因此,使用本法TdP发生率高,发生时间较稳定,表明模型制备成功,可用于后续实验。

Fig.1 Recording of the ECG when TdP occurred in isolated guinea pig heartECG:Electrocardiogram;TdP:Torsades de pointes
2.2 TMCC可降低TdP发生率
TdP模型成功建立后,观察TMCC对该模型的影响。待豚鼠离体心脏灌流稳定后,在开始造模的同时给予不同浓度的TMCC。如图2所示,TdP模型组 TdP发生率为 85.7%。1、2mmol/L TMCC可降低TdP发生率,TdP发生率分别为83.3%和16.7%。在TdP模型+4mmol/L TMCC组中,6例豚鼠离体心脏均未发生TdP。
2.3 TMCC可降低TdP模型增大的复极离散度
如表1所示,与给药前相比,TdP模型组Tp-Te、rTp-Te、Tp-Te(corrected)分别增加 68.1%、64.9%和61.4%(P<0.01)。与各自给药前相比:TdP模型 +1mmol/L TMCC组 Tp-Te、rTp-Te、Tp-Te(corrected)分别增加 10.5%、3.1%、2.0%(P>0.05),TdP模型 +2 mmol/L TMCC组 Tp-Te、rTp-Te、Tp-Te(corrected)分别增加 62.1%(P<0.05)、35.8%和 35.2%(P>0.05),TdP模型 +4 mmol/L TMCC组 Tp-Te、rTp-Te、Tp-Te(corrected)分别增加 50.6%(P<0.05)、24.1%、20.0%(P>0.05)。

Fig.2 Incidence of TdP in each group of isolated guinea pig heartsTMCC:Taurine magnesium coordination compound;TdP:Torsades de pointes
2.4 TMCC可降低TdP模型增大的QT间期不稳定性
不稳定性的计算对于预测尖端扭转型室性心动过速(torsades de pointes,TdP)/室颤(ventricular fibrillation,VF)的发生具有重要意义。如图3所示,将各组中每一只离体豚鼠心脏给药前后的不稳定性数据作差值计算后进行统计学分析发现,与TdP模型组QT间期总不稳性(4.53±0.75)比较,TdP模型 +1 mmol/L TMCC组、TdP模型 +2 mmol/L TMCC组和TdP模型+4 mmol/L TMCC组的QT间期总不稳性降低,分别为 3.62±0.88(P>0.05),1.38±0.36(P<0.05)和 2.33±0.26(P<0.05)。
Tab.1 Effects of TMCC on the increased Tp-Te、rTp-Te、Tp-Te(corrected)in TdPmodel of isolated guinea pigheart(,n=6)

Tab.1 Effects of TMCC on the increased Tp-Te、rTp-Te、Tp-Te(corrected)in TdPmodel of isolated guinea pigheart(,n=6)
TMCC:Taurine-magnesium coordination compound;TdP:Torsades de pointes*P<0.05,**P<0.01 vs Pre-drug group
Groups Drug given Tp-Te(ms) rTp-Te(%) Tp-Te(corrected)(ms )TdPmodel Pre- 54.20±4.18 30.51±2.30 58.90±4.71 Post- 91.14±5.97** 50.31±2.03** 95.06±4.50**TdPmodel+1mmol/L TMCC Pre- 52.94±3.06 31.70±2.20 60.33±3.80 Post- 58.49±6.01 32.69±2.81 61.53±5.42 TdPmodel+2 mmol/L TMCC Pre- 50.70±4.08 30.43±2.67 58.61±4.35 Post- 82.17±7.38* 41.32±3.80 79.24±6.83 TdPmodel+4mmol/L TMCC Pre- 55.49±5.23 32.71±2.94 64.12±5.41 Post- 83.57±10.58*40.58±6.43 76.95±8.64
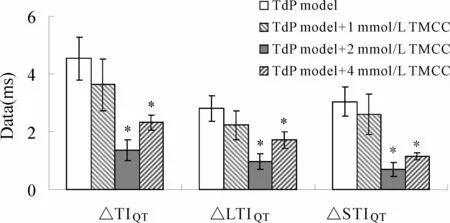
Fig.3 The difference between pre-and post-drug in each group(,n=6)
3 讨论
本实验首先建立豚鼠离体心脏TdP模型。在前期实验中,我们首先使用 IKs通道阻滞剂 Chromanol 293B[9]建立TdP模型,但未见发生心律失常;随后使用IKs通道阻滞剂 Chromanol 293B合并低钾[10]成功导致离体心脏发生TdP。有文献报道,复极离散度(Tp-Te)大于 90 ms易发生心律失常[3,11]。我们单独使用Chromanol 293B虽然可见离散度增大,但其增大程度远远小于90 ms。而使用Chromanol 293B合并低钾建立模型过程中可见离散度大于90ms,有的甚至大于100ms。所以,使用IKs通道阻滞剂Chromanol 293B合并低钾较为成功的导致心脏发生TdP,TdP发生率高。
目前认为,药源性TdP的发生机制主要涉及两方面[12],一是药物引起心室肌细胞 APD(action potential duration)延长,但是由于心肌内、中、外3层心室肌细胞离子通道的种类和数量存在差异,造成不均一延长,使得3层心室肌细胞本身存在的异质性进一步增大,一部分细胞先完成复极,这些心室肌细胞会继续接受来自相邻细胞的兴奋传导,从而形成折返,这是维持TdP发作的机制。本实验结果显示,在建立模型过程中可见离体心脏复极离散度显著增大,表明Chromanol 293B合并低钾使得心脏心室肌的异质性显著增大,易形成折返。而在造模的同时给予一定浓度TMCC,则可减弱TdP模型导致的离散度增大,从而发挥抗TdP作用。
另一方面则涉及TdP的启动机制,动作电位中复极的2相与3相涉及多种离子通道的共同参与,在动作电位跨膜复极电位正常时,本身就存在一个低幅的震荡电位。当某些离子通道功能出现变化,如钾离子外流减少或钙、钠离子内流增多时,可使震荡电位的振幅升高,达到除极的阈电位就将形成一次新的除极活动,即早后除极,在心电图上表现为室性早搏。早后除极形成触发活动,启动TdP的发生[13-16]。我们在实验中发现,在 Chromanol 293B合并低钾建立模型过程中,离体心脏心电图会连续出现P波消失的现象,而TdP模型+TMCC组的离体心脏心电图则始终有独立的 P波(图4)。这表明TMCC可抑制Chromanol 293B合并低钾导致的早后除极,从而发挥抗TdP启动的作用。
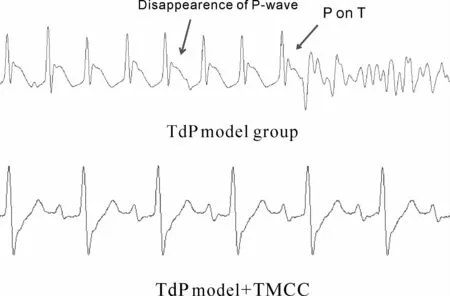
Fig.4 ECG waves of an isolated guinea pig heart
除观测离散度的变化外,近年来有人提出一种新的评价指标——心室复极不稳定性,即QT间期不稳定性。这个指标反映心律失常前连续30个心动周期的QT间期的变化。在计算分析心室复极不稳定性过程中,本文采用的是 van der Linde H[17]等研究报道的计算方法,首先计算30个坐标点的横纵坐标数据的平均值并将其作为重心,继而计算每个坐标点与该重心点的距离并将其作为心室复极总不稳定性TI,然后在此基础上继续利用该重心点并经过推导计算出短期不稳定性STI和长期不稳定性LTI。该方法始终将30个坐标点的共有联系即重心纳入计算公式中,能体现出单个数据与总体数据中心的离散性。实验表明,造模过程中Chromanol 293B合并低钾使心脏QT间期不稳定性显著增大,而在造模的同时给予一定浓度TMCC,离体心脏QT间期不稳定性显著降低。
综上所述,通过探索和实验最终成功建立豚鼠离体心脏TdP模型,继而研究、探索了TMCC的抗TdP作用。TMCC可通过降低TdP模型导致的离体心脏跨室壁复极离散度增加、抑制早后除极的发生以及降低QT间期不稳定性增大而发挥抗TdP作用,降低TdP发生率。根据TdP的发生机制,在TMCC对具体相关离子通道的影响方面,将开展更为深入的研究,为临床治疗TdP提供新的思路。
[1] Cheng HC,Incardona J.Models of torsades de pointes:effects of FPL64176,DPI201106,dofetilide,and chromanol 293B in isolated rabbitand guinea pig hearts[J].JPharmacol ToxicolMethods,2009,60(2):174-184.
[2] Hondeghem LM.Disturbances of cardiac wavelength and repolarization precede torsade de pointes and ventricular fibrillation in langendorff perfused rabbit hearts[J].Prog Biophys Mol Biol,2016,121(1):3-10.
[3] Antzelevitch C.Role of transmural dispersion of repolarization in the genesis of drug-induced torsades de pointes[J].Heart Rhythm,2005,2(2 Suppl):S9-S15.
[4] 吴金春,李文强,常 荣,等.起搏器术后尖端扭转型室速 1例[J].临床心电学杂志,2017,26(1):54-56.
[5] Monnig G,Kobe J,Loher A,etal.Role of implantable cardioverter defibrillator therapy in patients with acquired long QT syndrome:a long-term follow-up[J].Europace,2012,14(3):396-401.
[6] 李 帆.硫酸镁联合床边紧急心脏起搏在尖端扭转型室速中的应用[J].中西医结合心脑血管病杂志,2016,14(7):788-789.
[7] 宋日文枫.硫酸镁治疗尖端扭转型室性心动过速31例疗效分析[J].临床医药文献电子杂志,2015(32):6722-6723.
[8] Zhao L,Lou J,Wu H,et al.Effects of taurine-magnesium coordination compound on ionic channels in rat ventricular myocytes of arrhythmia induced by ouabain[J].Biol Trace Elem Res,2012,147(1-3):275-284.
[9] Lerche C,Bruhova I,Lerche H,et al.Chromanol 293B binding in KCNQ1(Kv7.1)channels involves electrostatic interactionswith a potassium ion in the selectivity filter[J].Mol Pharmacol,2007,71(6):1503-1511.
[10] Faggioni M,Knollmann BC.Arrhythmia protection in hypokalemia:a novel role of Ca2+-activated K+currents in the ventricle[J].Circulation,2015,132(15):1371-1373.
[11]Guo L,Dong Z,Guthrie H.Validation of a guinea pig Langendorff heartmodel for assessing potential cardiovascular liability of drug candidates[J].JPharmacol Toxicol Methods,2009,60(2):130-151.
[12]郭继鸿.短联律间期尖端扭转性室速综合征[J].临床心电学杂志,2005,14(4):289-297.
[13]Weiss JN,Garfinkel A,Karagueuzian HS,et al.Early afterdepolarizations and cardiac arrhythmias[J]. Heart Rhythm,2010,7(12):1891-1899.
[14] Cranefield PF.Action potentials,afterpotentials,and arrhythmias[J].Circ Res,1977,41(4):415-423.
[15]ClusinWT.Calcium and cardiac arrhythmias:DADs,EADs,and alternans[J].CritRev Clin Lab Sci,2003,40(3):337-375.
[16]焦 宏,张 勇,王晓玲.小鼠主动脉狭窄后不同时期心室肌细胞后除极和触发活动的变化[J].中国应用生理学杂志,2014,30(3):243-246.
[17]Van der Linde H,Van deWater A,LootsW,et al.A new method to calculate the beat-to-beat instability of QT duration in drug-induced long QT in anesthetized dogs[J].JPharmacol Toxicol Methods,2005,52(1):168-177.

