培养学生的电极反应式书写技巧
吴 超
(山东省沂南县第一中学 276300)
电化学是高中教学的重点之一,电极反应式的快速、准确书写是解题的切入口.在教学中如何注重知识的积淀与传承,从简单入手、洞察教材内涵,培养书写技巧.
一、注重传承、对接统一中的对立
技能从简单学起、技巧从熟练中感悟.从最常见、最基础也是最重要的电池切入,借助实验现象,寻找电极反应与氧化还原反应间的“对接”.
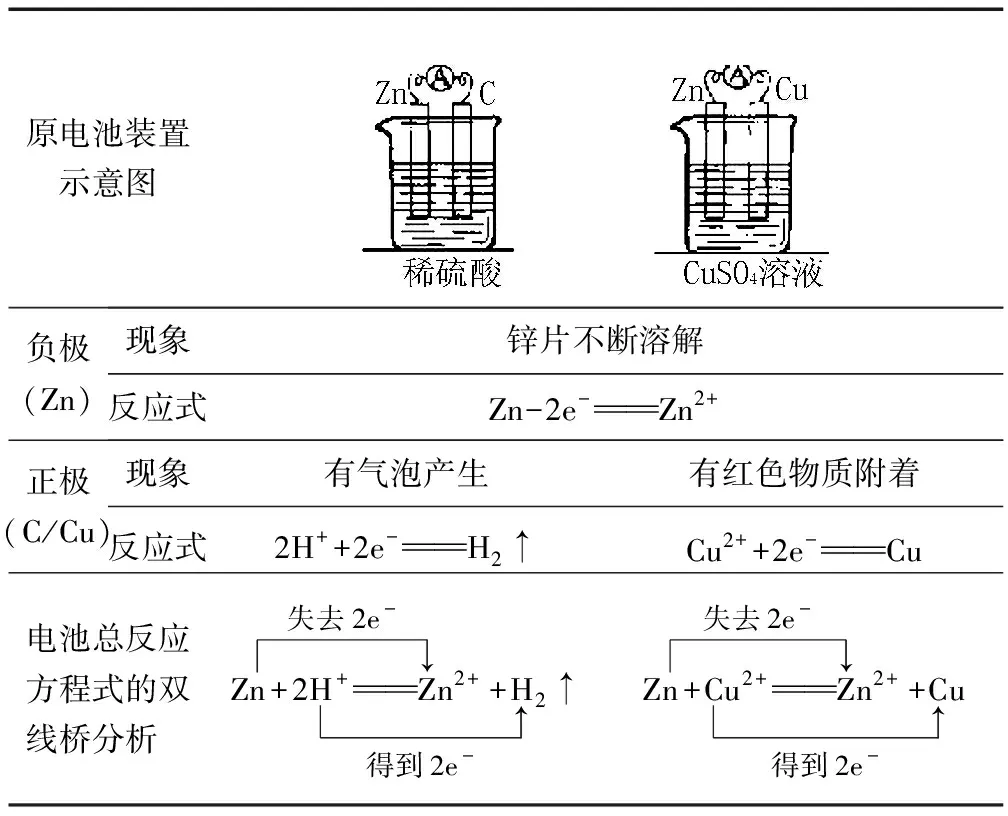
原电池装置示意图负极(Zn)现象锌片不断溶解反应式Zn-2e-Zn2+正极(C/Cu)现象有气泡产生有红色物质附着反应式2H++2e-H2↑Cu2++2e-Cu电池总反应方程式的双线桥分析Zn+2H+Z失去2e-↓n2++H得到2e-↑2↑Zn+Cu2+Z失去2e-↓n2++C得到2e-↑u
分析了金属析氢腐蚀(金属与酸置换)、伏打原电池(金属与盐置换)后,意识到原电池的正、负电极反应就是将统一为一体的氧化反应与还原反应“割裂、对立”起来.作为技能巩固,请学生填写下表中电极反应式,由此要求学生注意:Fe 和Fe3+放电产物都为Fe2+.

电池总反应方程式正极反应式负极反应式Fe+2FeCl33FeCl2Cu+2FeCl3CuCl2+2FeCl22KI+2FeCl32FeCl2+2KCl+I22Fe3++2e-2Fe2+Fe-2e-Fe2+Cu-2e-Cu2+2I--2e-I2
二、洞察契机、耐心剖析教材内涵
根据原电池工作原理,人们开发了许多化学电源.对其电极反应的分析和书写就困难多了,有哪些规则要考虑?书写思路有无“程序”可循?怎样在传授知识的同时,多些方法引导?

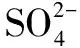
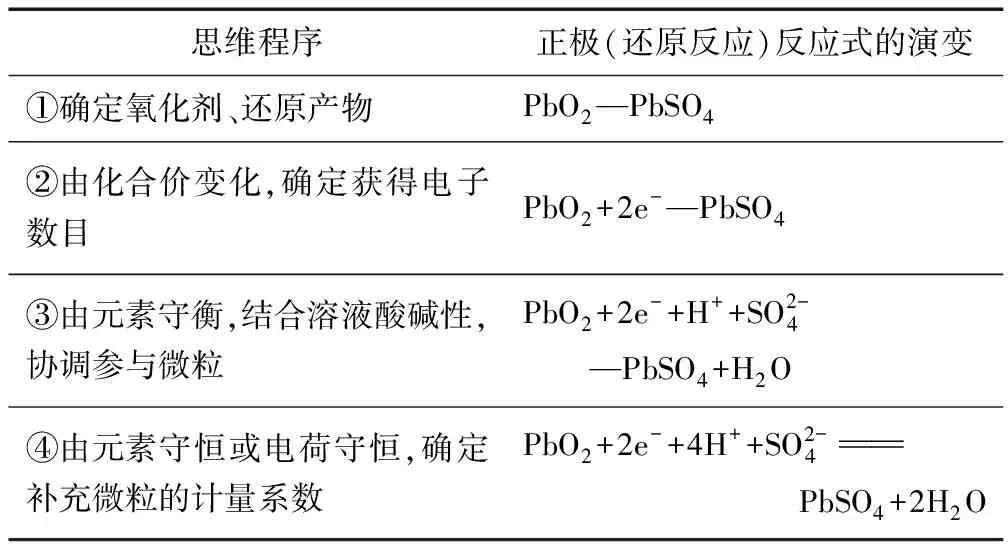
思维程序正极(还原反应)反应式的演变①确定氧化剂、还原产物PbO2—PbSO4②由化合价变化,确定获得电子数目PbO2+2e-—PbSO4③由元素守衡,结合溶液酸碱性,协调参与微粒PbO2+2e-+H++SO2-4—PbSO4+H2O④由元素守恒或电荷守恒,确定补充微粒的计量系数PbO2+2e-+4H++SO2-4PbSO4+2H2O
在思维程序③,参与微粒无外两类情况:H+/H2O(酸性)、OH-/H2O(碱性),谁为反应微粒、谁为生成微粒?只需先假定一种情况,略做分析便可.所以,书写时不仅要考虑元素与电荷守恒,还要考虑电解质溶液酸碱性、后续引发的离子反应等.
练习:请书写(1)直接甲醇燃料电池(DMFC)[由甲醇负极、氧正极和质子交换摸构成;在催化剂作用下甲醇被氧化为水和二氧化碳,甲醇用完后,只需要补充甲醇就可以继续使用.],(2)偏二甲肼[(CH3)2N-NH2]碱性燃料电池,(3)熔融盐燃料电池[用Li2CO3和Na2CO3的熔融盐(约650℃)混合物作电解质,CO为负极燃气,空气与O2的混合气为正极助燃气]工作原理反应式.

电池名称正极反应式负极反应式电池反应式直接甲醇燃料电池3O2+12H++12e-6H2O2CH3OH+2H2O-12e-CO2↑+12H+2CH3OH+3O22CO2↑+4H2O偏二甲肼碱性燃料电池4O2+8H2O+16e-16OH-C2H8N2-16e-+20OH-2CO2-3+N2↑+14H2OC2H8N2+4O2+4OH-2CO2-3+N2↑+6H2O熔融盐燃料电池O2+2CO2+4e-2CO2-32CO+2CO2-3-4e-4CO2O2+2CO2CO2
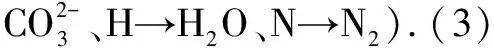
参考文献:
[1]中华人民共和国教育部. 高中化学课程标准[M].北京:人民教育出版社,2007.

