猪丁型冠状病毒的分离鉴定与基因分析
刘怀东,孙 淼,赵 炜,薛青红,魏春霞,才学鹏,陈 瑞,刘 灿*,孙晓林*
(1. 甘肃农业大学,兰州 730070;2. 中国兽医药品监察所,北京100081;3. 陕西诺威利华生物科技有限公司,陕西杨陵 712100)
猪丁型冠状病毒(Porcine deltacoronavirus, PDCoV)是近年来危害养猪业的重要病毒性腹泻病原,与猪流行性腹泻(Porcine epidemic diarrhoea,PED)的发病情况极为类似,临床上较难区分[1]。发病初期仔猪表现为哺乳、吃食后出现呕吐,呕吐物呈黄色或乳白色,并常伴有水样腹泻。发病后期,病猪表现为脱水、行走蹒跚以及精神沉郁等,发病严重者可能死亡[2-4]。
PDCoV属于尼多病毒目内的冠状病毒科,为含有囊膜的单链正义RNA病毒[8]。自2013年以来,在美国、韩国、中国、日本、欧洲等地检测到PDCoV的流行[9-11]。为了进一步探究PDCoV在中国的具体流行情况,对2014-2016年间采集自河北、河南、山东、广东和陕西省的56份粪便和肠组织样本进行了多种腹泻病原检测,对确认为PDCoV阳性的样本进行了病毒分离、全基因序列测定、比对分析与遗传进化分析,以期为该病的防控提供基础支撑。
1 材 料
1.1 样本 腹泻仔猪肠组织与粪便样品来自于2014-2016年间收集的河北、河南、山东、广东与陕西省等地养殖场。
1.2 细胞 ST细胞由陕西诺威利华生物科技有限公司提供。
1.3 主要试剂 病毒DNA/RNA提取试剂盒、反转录酶M-MLV、Ex Taq Premix以及PrimeSTAR Max Premix为宝生物工程(大连)有限公司产品。
2 方 法
2.1 病料前处理与核酸提取 取肠组织与粪便样品少量置于15 mL离心管,添加质量体积比为1∶5的生理盐水,使用匀浆机进行匀浆处理,然后进行3次冻融,之后于4 ℃低温离心机进行12000 r/min离心15 min,取上清液,使用病毒DNA/RNA提取试剂盒,按说明书步骤进行核酸提取。
2.2 RT-PCR检测 参考Linda J. Saif文献[5]合成针对M基因的检测引物PDCoV-M541-F: 5'-CGCGTAATCGTGTGATCTATGT-3',PDCoV-M541-R: 5'-CCGGCCTTTGAAGTGGTTAT-3'。根据M-MLV反转录酶说明书进行反转录操作制备cDNA,然后配制PCR反应液,其中Premix Ex Taq 12.5 μL,上下游引物(10 μmol/L)各1 μL,cDNA 1 μL,补水至25 μL。PCR反应条件为:94 ℃ 5 min预变性;然后35个循环进行94 ℃ 30 s(变性),55 ℃ 30 s(退火)与72 ℃ 30 s(延伸);最后延伸72 ℃ 5 min。取PCR产物于1%琼脂糖凝胶中进行电泳,判定检测结果。同时参考Song D文献[6]合成用于检测猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)与猪A群轮状病毒(PRotaV)的检测引物,用于腹泻病料的检测。
2.3 病毒分离 将PCR检测为PDCoV阳性的腹泻样品匀浆液冻融三次,4 ℃低温离心机中12000 r/min离心15 min后,取上清液经过0.22 μm滤膜过滤后液体[12],接种健康ST细胞,并持续观察细胞状态,接毒后72~96 h收毒,或待细胞病变为80%时收毒。
2.4 全序列测定与比对分析 参考Wang L文献[2]合成用于PDCoV全序列扩增测序的16对引物,分段扩增后送苏州金唯智生物科技有限公司,连接pCR-Blunt载体进行测序,并拼接测序结果,比对分析测序结果与其他GenBank中PDCoV序列。
2.5 遗传进化分析 基于测定的PDCoV SD株全序列与GenBank中另外68株PDCoV全序列,绘制进化树,进行遗传进化分析。
3 结 果
3.1 RT-PCR检测结果 RT-PCR检测结果显示为PDCoV阳性(图1A),同时检测PEDV、TGEV、PRotaV为阴性。PDCoV阳性PCR产物送测序后,比对测序结果确认为PDCoV的M基因序列。同时针对PEDV、TGEV与PRotaV的检测均为阴性(图1B)。
3.2 分离病毒结果 检测为PDCoV阳性的粪便样品,经离心取上清并过滤,接种ST细胞48 h后(48 hpi)出现明显的细胞病变(CPE)(图2),同时该PDCoV毒株可在ST细胞上稳定传代20代以上。
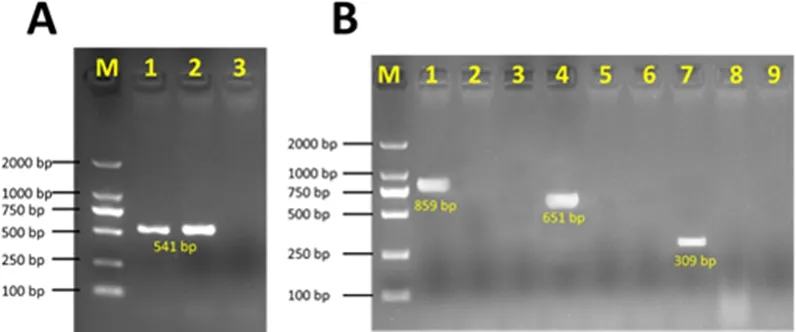
A: M-DL2000 DNA Marker;1-检测为阳性的PDCoV粪便样品;2-阳性对照(根据检测引物合成的阳性质粒);3-阴性对照B: M-DL2000 DNA Marker;1-TGEV阳性对照(根据检测引物合成的阳性质粒);2-TGEV阴性对照;3-粪便样品;4-PEDV阳性对照(根据检测引物合成的阳性质粒);5-PEDV阴性对照;6-粪便样品;7-PRotaV阳性对照(根据检测引物合成的阳性质粒);8-PRotaV阴性对照;9-粪便样品A: M- DL2000 DNA Marker;1-Sample detected as PDCoV positive;2-Positive control;3- Negative control B: M- DL2000 DNA Marker;1- TGEV positive control;2- Sample detected as TGEV negative;3- TGEV negative control;4- PEDV positive control;5- Sample detected as PEDV negative;6- PEDV negative control;7- PRotaV positive control;8- Sample detected as PRotaV negative;9-PRotaV negative control图1 腹泻样本PCR检测PDCoV、TGEV、PEDV与PRotaV电泳图Fig 1 Detection of PDCoV, TGEV, PEDV and PRotaV with diarrheal sample
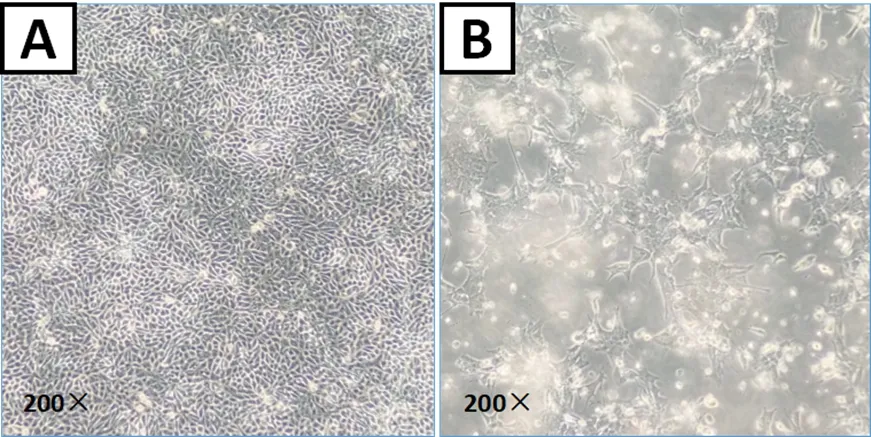
A:健康ST细胞;B:ST细胞在感染PDCoV后48 h出现细胞病变(CPE)A: Healthy ST cell; B: ST cell with CPE after infection with PDCoV(48hpi)图2 健康ST细胞与感染PDCoV的ST细胞Fig 2 Healthy ST cell and ST cell infected with PDCoV
3.3 全序列测定与比对分析结果 PDCoV SD株的完整基因组序列长度为25414个核苷酸(nt),不包括3'polyA尾,将全序列上传至GenBank,登录号为MF431743。SD株与参考株HKU15-155(2012年分离)、CH/Sichuan/S27/2012和CH-HB-2014的核苷酸同源性分别为98.97%、99.06%和99.13%。此外,在nsp2区的1739至1744位(对应于HKU15-44序列)中的6 nt(TTTGAA)缺失和nsp3区的2810至2818位的9 nt(TCGGCAATG)缺失为首次出现。
将PDCoV SD株的S基因核苷酸序列以及对应氨基酸序列与另外一株分离自广东地区的GD株进行比对分析发现,SD株与GD株的S基因上则存在约60个核苷酸点突变而无基因插入或缺失,对应16个氨基酸点突变,分别为R40S、S43T、Y46H、Q106L、D109E、H122Y、Y162D、V171E、A230P、K484E、L488Q、S589A、V629A、K641Q、K800Q、D1085E。
3.4 遗传进化分析结果 基于GenBank上69株PDCoV全基因序列绘制进化树(图3),分析进化树发现,69株PDCoV具有明显的地域特征,可分为3个大的分支,第一分支主要为美国毒株以及少数韩国毒株,第二分支为中国毒株(23株),第三分支为越南与泰国毒株(6株)。其中中国PDCoV毒株呈现出4~5个小分支,充分展现了该病毒的基因多样性特征。
4 讨 论
常见的造成猪腹泻的病毒类病原主要为猪源冠状病毒,其中包括PEDV、TGEV与PDCoV,对于PDCoV最早的报道为2012年香港学者Woo等检测到PDCoV HKU15-44株与HKU15-155株,并完成了两株病毒的全基因序列测定[4]。2014年至今,中国大陆的田间PDCoV流行报道日趋增多,华中农业大学、华南农业大学、浙江大学、哈尔滨兽医研究所与河北农业大学等科研团队开展的PDCoV研究确认了PDCoV在我国各省的广泛流行,病毒分离与返回感染动物试验确认了其为仔猪腹泻的严重威胁[9,12,13]。为了查明PDCoV流行病学历史,2015年Xiao等对2004-2014年间215份腹泻样本进行回溯检测,发现14份(6.51%)为PDCoV核酸阳性,其中包括2份采集自2004年安徽省的腹泻样本,说明PDCoV的存在时间要早于其首次被检测确诊的时间[13]。
PDCoV SD株在基因特征上与众多中国大陆参考株全基因组序列同源性为98.5%~99.3%,其中S基因编码的纤突蛋白被认为具有结合病毒受体与诱导产生中和抗体等作用,比对SD株与其他中国毒株S基因核苷酸序列可见较多基因突变,对应可见至少16个氨基酸位点突变,这些突变位点对于PDCoV病毒的增殖特性或致病性等表型的影响仍待后续研究;对于主要遗传进化分析结果显示包括SD株在内的中国大陆PDCoV与美国或东南亚其他毒株遗传关系相对较远,基于某一株PDCoV研发的弱毒疫苗或灭活疫苗的保护效果以及针对其他毒株的交叉保护效果仍处于未知状态,考虑到PEDV与PDCoV等腹泻病原对我国乃至全球养猪业每年所造成的巨大经济损失,对于该类传染病的持续性监测与防治研发需要有序而快速地推进。
其中对于疫病的监测方面,可以借鉴参考一些先进经验,比如,美国的首例PDCoV临床确诊是在2014年1月的俄亥俄州与伊利诺伊州养殖场,至2014年6月3日时,已确诊12个主要生猪养殖州均出现PDCoV感染,2014年6月5日,美国农业部将PEDV与PDCoV纳入需要上报的疫病类型,并在农业部官网进行每周疫病流行更新报道[14]。该举措对于美国养猪业PEDV流行的局部与整体防控意义重大。此外,对于猪丁型冠状病毒的治疗或预防仍然没有特效药或商品化疫苗,因此尽快研制出一种能够有效防治猪丁型冠状病毒病的疫苗,对于降低哺乳仔猪死亡率、减少养殖场经济损失具有重要的意义。
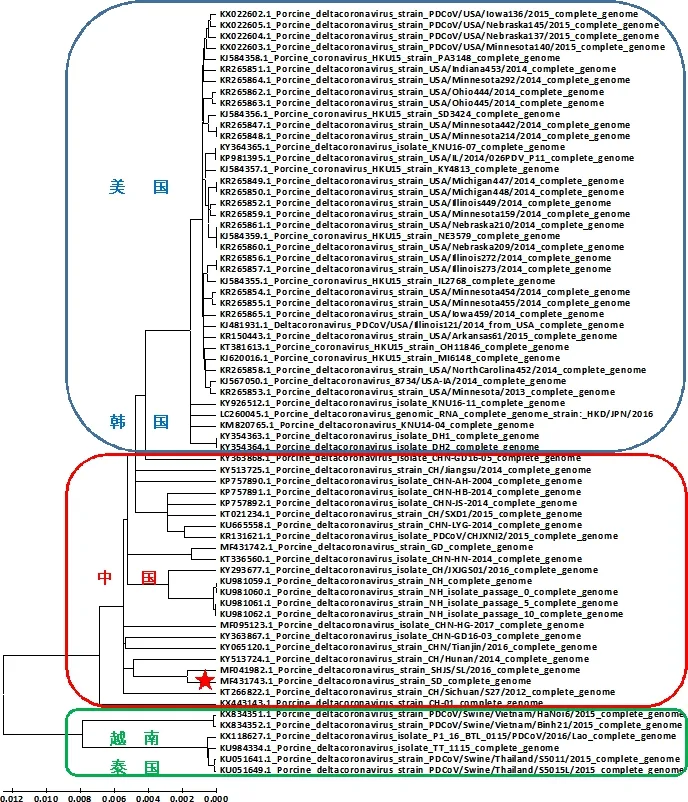
★为PDCoV SD株位置★ for PDCoV SD strain图3 基于69株PDCoV全基因序列绘制的进化树Fig 3 Phylogenic tree based on complete genome of 69 PDCoV strains
参考文献:
[1] Wang L, Byrum B, Zhang Y. Detection and genetic characterization of deltacoronavirus in pigs, Ohio, USA, 2014[J]. Emerging Infectious Diseases, 2014, 20(7):1227.
[2] Marthaler D, Jiang Y, Collins J,etal. Complete genome sequence of strain SDCV/USA/Illinois121/2014, a porcine deltacoronavirus from the United States[J]. Genome Announcements, 2014, 2(2).doi: 10.1128/genomeA.00218-14
[3] 王逸雯,李 龙,黄耀伟. 猪腹泻新丁型冠状病毒中国株的初步检测及N基因序列分析[C]. 中国畜牧兽医学会2014年学术年会论文集. 2014.
Wang Y W, Li L, Huang Y W. Preliminary detection of diarrheal coronavirus strains in pigs and analysis of N gene sequences[C]. Chinese Society of Animal Husbandry and Veterinary Medicine 2014 Annual Conference Proceedings. 2014.
[4] Ma Y, Zhang Y, Liang X,etal. Origin, Evolution, and virulence of porcine deltacoronaviruses in the United States[J]. Mbio, 2015, 6(2):e00064.
[5] Jung K, Hu H, Eyerly B,etal. Pathogenicity of 2 porcine deltacoronavirus strains in gnotobiotic pigs[J]. Emerging Infectious Diseases, 2015, 21(4):650-4.
[6] Song D S, Kang B K, Oh J S,etal. Multiplex reverse trans-cription-PCR for rapid differential detection of porcine epidemic diarrhea virus, transmissible gastroenteritis virus, and porcine group A rotavirus.[J]. Journal of Veterinary Diagnostic Investigation Official Publication of the American Association of Veterinary Laboratory Diagnosticians Inc, 2006, 18(3):278-281.
[7] 贺东生,陈小芬,王 飞,等. 我国集约化猪场新发猪丁型冠状病毒病的诊断[J]. 猪业科学,2015, 32(10): 76-77.
He D S, Chen X F, Wang F,etal. Diagnosis of newly diagnosed porcine deltacoronavirus in intensive farms in China[J]. Swine Industry Science, 2015, 32(10): 76-77.
[8] Homwong N, Jarvis M C, Lam H C,etal. Characterization and evolution of porcine deltacoronavirus in the United States[J]. Preventive Veterinary Medicine, 2016, 123(2):168-174.
[9] 吴美洲,陈芳洲,朱银杏,等. 丁型冠状病毒我国猪源株的遗传变异分析[J]. 中国兽医科学,2016(6): 689-694.
Wu M Z, Chen F Z, Zhu Y X,etal. Genetic variation analysis of porcine deltacoronavirus in China[J], Chinese Veterinary Science, 2016(6): 689-694.
[10] 王逸雯,黄耀伟. 新发现的冠状病毒属——丁型冠状病毒[J]. 生命的化学,2016(4): 514-518.
Wang Y W, Huang Y W. A newly discovered coronavirus genus—deltacoronavirus[J]. Chemistry of Life, 2016(4): 514-518.
[11] 陈小芬. PEDV/TGEV/PDCoV快速检测方法的建立及PEDV COE基因和ORF3基因遗传变异研究[D]. 华南农业大学,2016.
Chen X F. Establishment of PEDV/TGEV/PDCoV rapid detection method and genetic variation of PEDV COE gene and ORF3 gene[D]. Southern China Agricultural University, 2016.
[12] Liu B J, Zuo Y Z, Gu W Y,etal. Isolation and phylogenetic analysis of porcine deltacoronavirus from pigs with diarrhoea in Hebei province, China[J]. Transboundary & Emerging Diseases, 2018 (5): 1-9.
[13] Nan D, Liurong F, Songlin Z,etal. Porcine deltacoronavirus in Mainland China[J]. Emerging Infectious Diseases, 2015, 21(12):2254-2255.
[14] Niederwerder M C, Hesse R A. Swine enteric coronavirus disease: A review of 4 years with porcine epidemic diarrhoea virus and porcine deltacoronavirus in the United States and Canada[J]. Transboundary & Emerging Diseases, 2018:1-16. doi: 10.1111/tbed.12823

