鹅不食草液相色谱指纹图谱及化学成分表征
徐明喆,孔 铭,李松林,张庆文,王国才,刘丽芳1
(1.中国药科大学 天然药物活性组分与药效国家重点实验室,江苏 南京 210009;2. 中药质量研究国家重点实验室(澳门大学),澳门大学中华医药研究院,澳门;3. 南京中医药大学附属中西医结合医院 中药质量研究室,江苏 南京210028;4. 江苏省中医药研究院 中药代谢组研究室,江苏 南京210028;5. 暨南大学 药学院 中药及天然药物研究所,广东 广州510632)
鹅不食草为菊科植物鹅不食草[Centipedaminima(L.) A.Br. Et Aschers.]的干燥全草,收载于中国药典2015版一部,性辛、温,归肺经,具有发散风寒,通鼻窍,止咳的功效[1],用于治疗急慢性鼻炎、过敏性鼻炎、头痛、百日咳、慢性气管炎、结膜炎、风湿关节炎、疟疾、湿疮肿毒、跌打肿痛等[2]。鹅不食草还是许多中成药如中华跌打丸、芩芷鼻炎糖浆、克痢痧胶囊、辛夷通鼻丸、通关散和鼻炎康片的主要原料[1]。建立整体质量评价方法对全面控制鹅不食草质量,保障其饮片和相关制剂的安全有效具有重要意义。
中国药典2015版采用显微鉴别及薄层鉴别对其进行质量控制;也有研究对鹅不食草中的短叶老鹳草素、总黄酮和总有机酸等进行含量测定[3-5],但专属性不强,难以从整体上客观评价其质量。高效液相指纹图谱技术专属性强,信息量大,可以综合反映药材的主要成分及其相对含量,是当前常用的全面评价药材质量的技术方法。但是,中药中含有许多无紫外吸收或紫外吸收较弱的成分,在指纹图谱中难以体现[6];现有指纹图谱技术也不能全面提供指纹所对应化学成分的结构信息。液相色谱-质谱联用技术不但灵敏度高,专属性强,而且多能在线提供色谱峰所对应的成分结构信息,被广泛应用于中药定性、定量研究中[7]。目前尚未见到鹅不食草HPLC指纹图谱相关报道,Chi-on Chan[8]等曾采用液相色谱-质谱联用技术对鹅不食草进行定性,但提供的成分信息相对较少。本研究拟建立鹅不食草药材的HPLC指纹图谱,并采用UPLC-QTOF-MS法对鹅不食草进行系统成分表征,为该药材的整体质量评价提供科学依据。
1 仪器与材料
1.1 仪器
Waters高效液相色谱仪(Alliance2695四元泵及自动进样系统,2996二极管阵列检测器,Empower色谱工作站)(美国Waters公司);Waters SYNAPT G2-S Q-TOF质谱仪(美国Waters公司);Waters ACQUITY UPLCTM液相色谱仪(美国Waters公司);AT201十万分之一(瑞士梅特勒公司);KQ-500D型数控超声波清洗器(昆山市超声仪器有限公司);Milipore纯化水系统(美国Milipore)。
1.2 材料
12批鹅不食草样品购自不同地区,来源见表1,经作者鉴定,江苏省中医药研究院李松林研究员核实为菊科植物鹅不食草[Centipedaminima(L.) A.Br. et Aschers.]的干燥全草;甲醇(色谱纯,江苏汉邦);乙腈(色谱纯,TEDIA);乙腈(德国Merk公司);磷酸(分析纯,国药集团化学试剂有限公司);甲酸(美国ROE Scientific INC公司);水为超纯水;芦丁、绿原酸、齐墩果酸购于中国药品生物制品检定所;槲皮素购于四川维克奇生物科技有限公司。
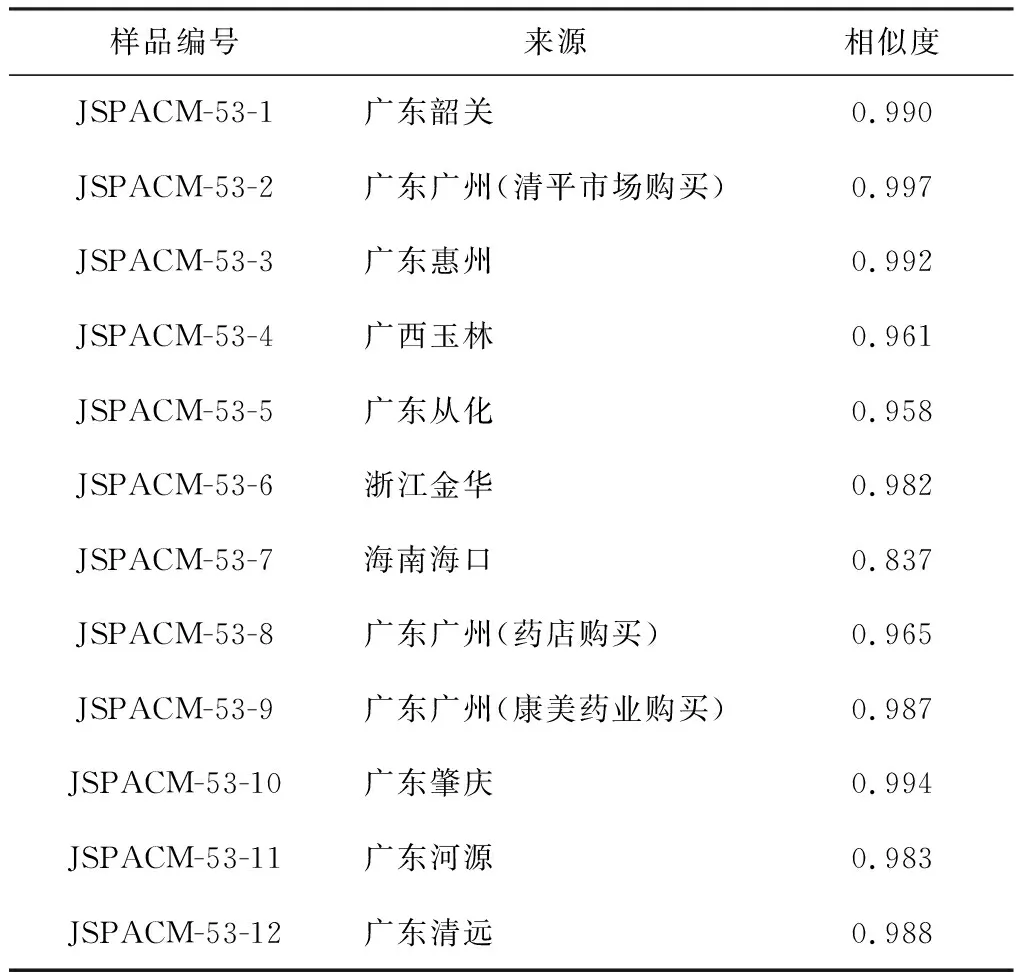
表1 12批鹅不食草样品来源及相似度
2 方法
2.1 指纹图谱色谱条件
AlltimaTMC18色谱柱(250 mm×4.6 mm,5 μm);柱温:35 ℃;流动相:乙腈(A)-0.2%磷酸溶液(B),梯度洗脱(0~20 min,5%~15% A,20~60 min,15%~27% A);流速:1.0 mL/min;进样量:20 μL;检测波长290 nm。
2.2 超高效液相色谱条件
Waters ACQUITY HSS T3(2.1 mm×100 mm,1.8 μm);柱温:35 ℃;流动相:0.1%甲酸乙腈(A)-0.1%甲酸水(B),梯度洗脱(0~2 min,15% A;2~10 min,15%~95% A;10~12 min,95% A);流速:0.4 mL/min;进样量:1 μL。
2.3 质谱条件
电喷雾离子源,正、负离子扫描模式;Q-TOF采集率0.3 s;低电压6 V;高电压30~60 eV;毛细管电压2 500 V,锥孔电压50 V;离子源温度100 ℃;去溶剂化温度450 ℃;流速800 L/h;锥孔气流速50 L/h;质量扫描范围m/z100~1 500 Da。采用亮氨酸-脑啡肽(Leucine-enkephaLin,ESI-:m/z554.261 5,ESI+:m/z556.277 1)溶液为校正液。
2.4 指纹图谱供试品溶液的制备
取鹅不食草粉末约1.0 g,精密称定,置于100 mL具塞锥形瓶中,精密加入50%甲醇20 mL,称定重量,超声1 h,放冷,再次称重,用50%甲醇补充减失的重量,摇匀,过滤,取续滤液,经0.22 μm微孔滤膜过滤,即得。
2.5 液相色谱-质谱联用供试品溶液的制备
取鹅不食草粉末约1.0 g,精密称定,置于100 mL具塞锥形瓶中,精密加入甲醇50 mL,称定重量,超声1 h,放冷,再次称重,用甲醇补充减失的重量,摇匀,过滤,取续滤液,用甲醇稀释,经0.22 μm微孔滤膜过滤,即得。
2.6 对照品溶液的制备
精密称取绿原酸、齐墩果酸、芦丁、槲皮素对照品适量,分别配成2.50 μg/mL的甲醇溶液。
3 结果及讨论
3.1 指纹图谱液相条件考察
为提高鹅不食草中各成分的分离度,本研究考察了甲醇-水、乙腈-水、甲醇-磷酸溶液、乙腈-磷酸溶液等多种流动相系统,结果显示,乙腈-0.2%磷酸溶液作为流动相的色谱图基线较为平稳,分离度较好,峰形尖锐。因此,本实验选择乙腈-0.2%磷酸溶液作为流动相并对梯度洗脱程序进行优化。采用二极管阵列检测器在190~400 nm进行全波长扫描,考察不同吸收波长下的色谱图,结果发现290 nm处各成分均有较高的响应值且基线平稳,因此选择290 nm作为检测波长。
3.2 指纹图谱样品制备条件考察
考察不同提取方法(超声法、回流法)对提取效率的影响,结果表明,回流法虽所得色谱峰数目较多,但其重复性较差(相对峰面积RSD高达96%),推测可能在高温回流过程中发生了成分转化。为提高方法的重复性,本实验采用低温超声的方法,重复性试验中各主要共有峰的相对保留时间RSD均小于0.2%,相对峰面积RSD均小于3.0%,符合指纹图谱要求。同时考察了提取溶剂(50%甲醇、70%甲醇、100%甲醇)、提取时间(30 min、1 h、1.5 h)、提取溶剂量(10 mL、15 mL、20 mL)对提取效率的影响,结果表明,用20 mL 50%甲醇溶液提取1 h,即能提取完全,符合指纹图谱分析要求。
3.3 指纹图谱方法学考察
3.3.1 精密度试验
取鹅不食草样品(JSPACM-53-1),按“2.4”项下方法制备供试品溶液,按“2.1”项下色谱条件连续进样6次,以10号峰为参照峰,各主要共有峰的相对保留时间RSD均小于0.2%,相对峰面积RSD均小于1.5%,表明仪器精密度良好,符合指纹图谱要求。
3.3.2 重复性试验
取同一批鹅不食草样品(JSPACM-53-1)6份,按“2.4”项下方法制备供试品溶液,按“2.1”项下色谱条件连续进样6次,以10号峰为参照峰,各主要共有峰的相对保留时间RSD均小于0.2%,相对峰面积RSD均小于3.0%,表明方法重复性良好,符合指纹图谱要求。
3.3.3 稳定性试验
取鹅不食草样品(JSPACM-53-1),按“2.4”项下方法制备供试品溶液,按“2.1”项下色谱条件,分别于0 h,2 h,4 h,6 h,8 h,10 h,12 h进样,以10号峰为参照峰,各主要共有峰的相对保留时间RSD均小于0.2%,相对峰面积RSD均小于2.0%,表明供试品溶液在12 h内稳定,符合指纹图谱要求。
3.4 指纹图谱建立
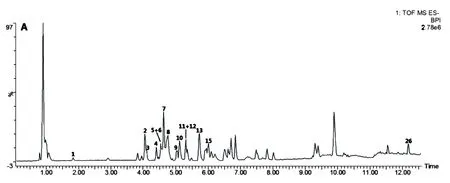
分别取12批鹅不食草样品按“2.4”项下方法制备供试品溶液,按“2.1”项下色谱条件进样,得到12批不同产地的鹅不食草药材的HPLC指纹图谱。将色谱图导入“中药色谱指纹图谱相似度评价系统”(2004 A版),以批号为JSPACM-53-1的鹅不食草药材作为参照图谱,以中位数法作为对照指纹图谱的生成方法,设定时间窗宽度为1.0 min,提取鹅不食草药材的共有模式建立对照指纹图谱,共标定13个共有峰,结果见图1。各共有峰的相对保留时间与相对峰面积见表2、表3。
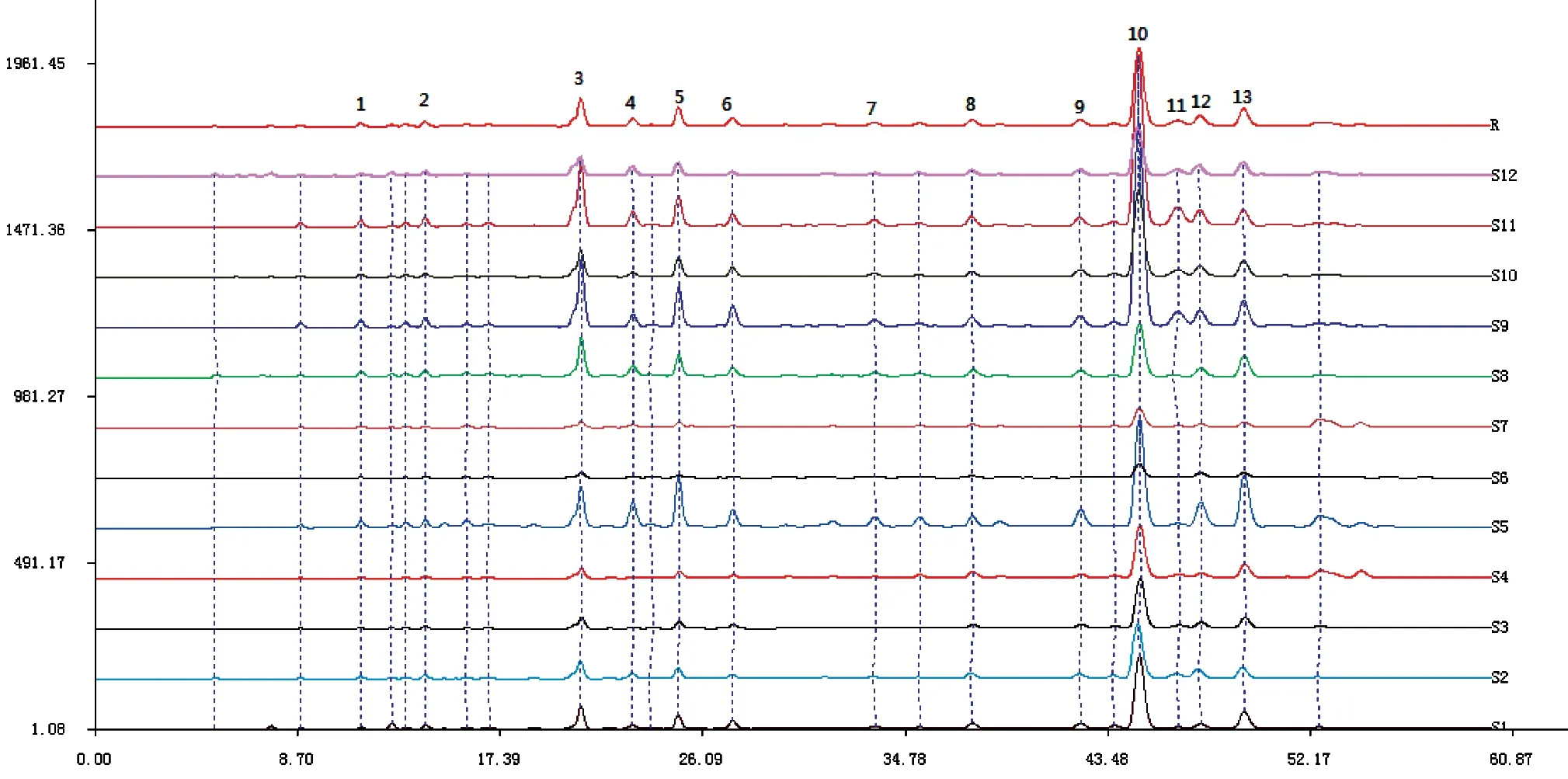
图1 鹅不食草药材指纹图谱
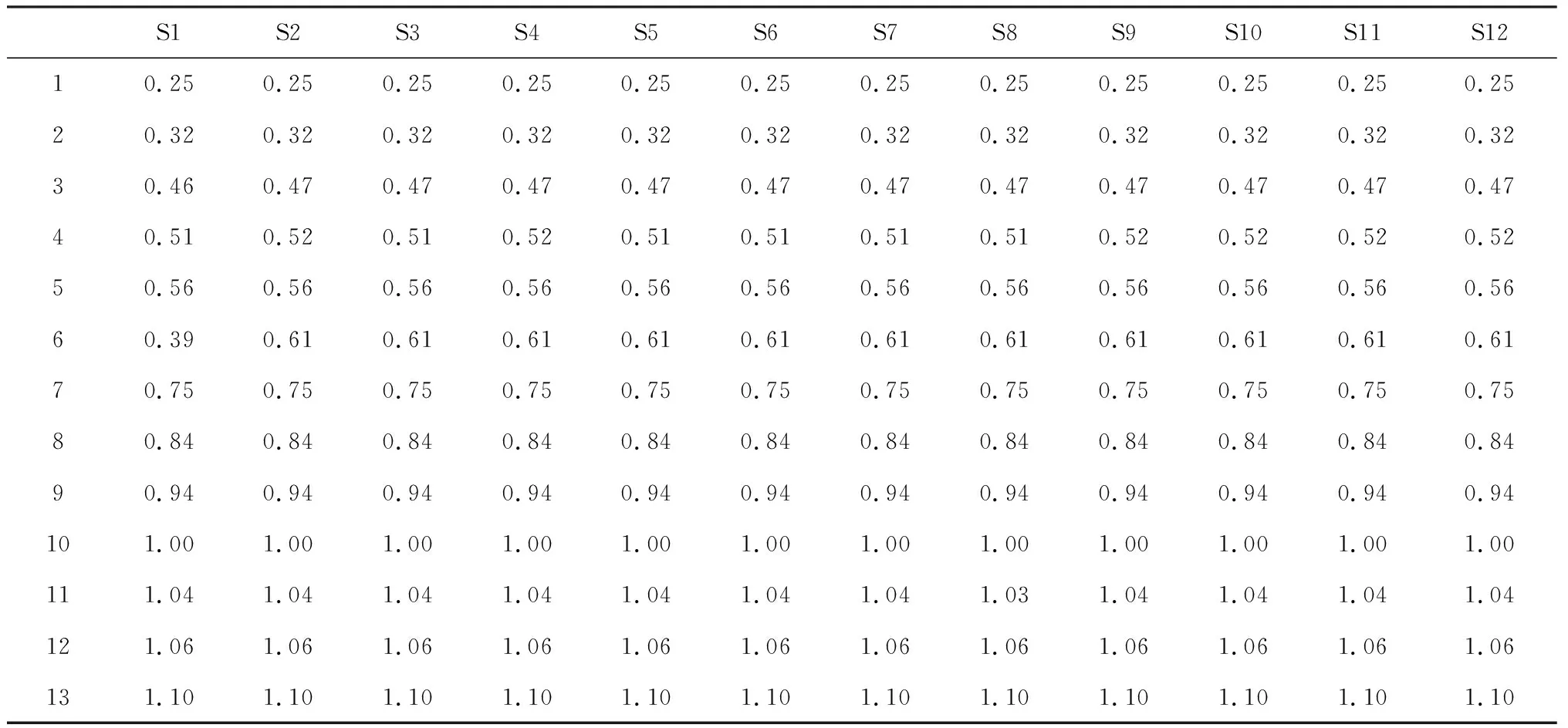
S1S2S3S4S5S6S7S8S9S10S11S1210.250.250.250.250.250.250.250.250.250.250.250.2520.320.320.320.320.320.320.320.320.320.320.320.3230.460.470.470.470.470.470.470.470.470.470.470.4740.510.520.510.520.510.510.510.510.520.520.520.5250.560.560.560.560.560.560.560.560.560.560.560.5660.390.610.610.610.610.610.610.610.610.610.610.6170.750.750.750.750.750.750.750.750.750.750.750.7580.840.840.840.840.840.840.840.840.840.840.840.8490.940.940.940.940.940.940.940.940.940.940.940.94101.001.001.001.001.001.001.001.001.001.001.001.00111.041.041.041.041.041.041.041.031.041.041.041.04121.061.061.061.061.061.061.061.061.061.061.061.06131.101.101.101.101.101.101.101.101.101.101.101.10
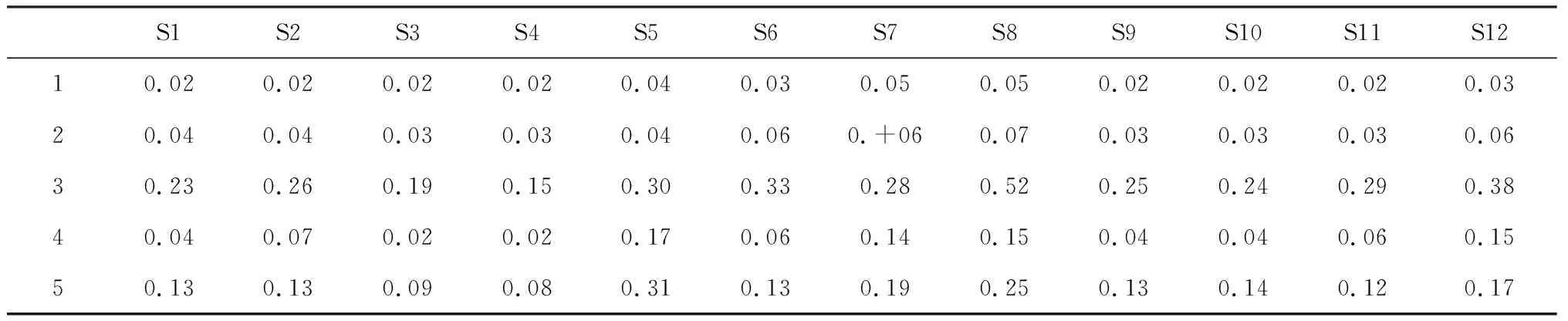
表3 12批鹅不食草共有峰相对峰面积
续表3
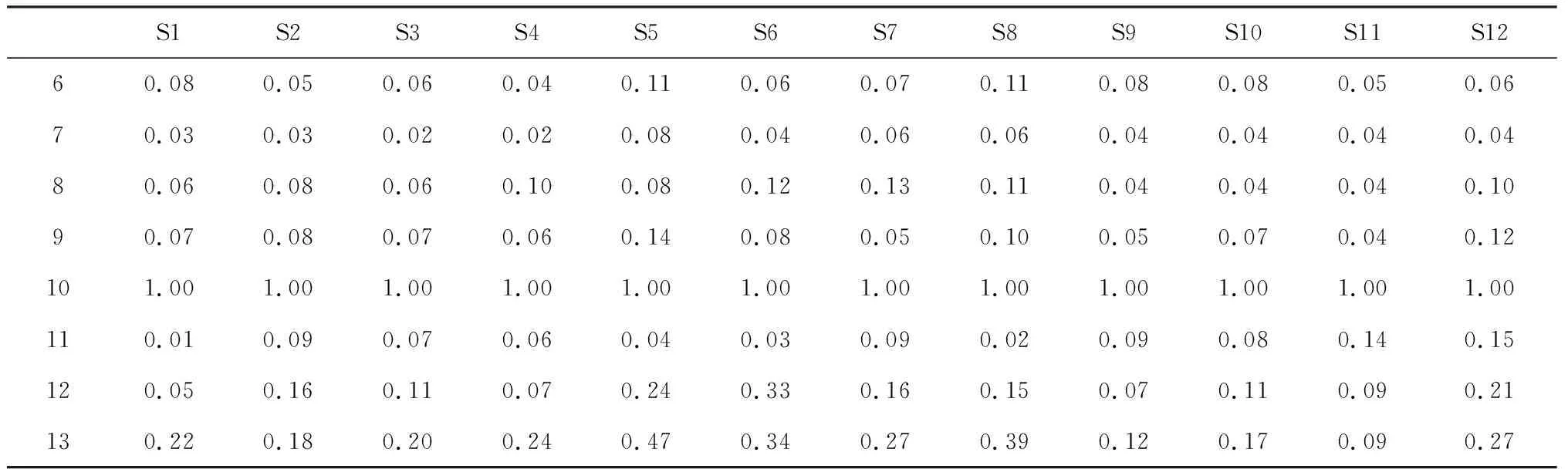
S1S2S3S4S5S6S7S8S9S10S11S1260.080.050.060.040.110.060.070.110.080.080.050.0670.030.030.020.020.080.040.060.060.040.040.040.0480.060.080.060.100.080.120.130.110.040.040.040.1090.070.080.070.060.140.080.050.100.050.070.040.12101.001.001.001.001.001.001.001.001.001.001.001.00110.010.090.070.060.040.030.090.020.090.080.140.15120.050.160.110.070.240.330.160.150.070.110.090.21130.220.180.200.240.470.340.270.390.120.170.090.27
3.5 相似度评价
采用“中药色谱指纹图谱相似度评价系统(2004A版)”对12批鹅不食草药材进行相似度评价,结果见表1。12批样品的相似度在0.837~0.997之间。
实验结果显示,不同批次的鹅不食草样品具有较好的相似性,其共有峰数目及相对保留时间较为一致,而相对峰面积差异较大,表明其所含化学成分种类基本一致而含量各不相同,可能是受生长环境、采收时间、生长年限等因素的影响。
3.6 化学成分表征
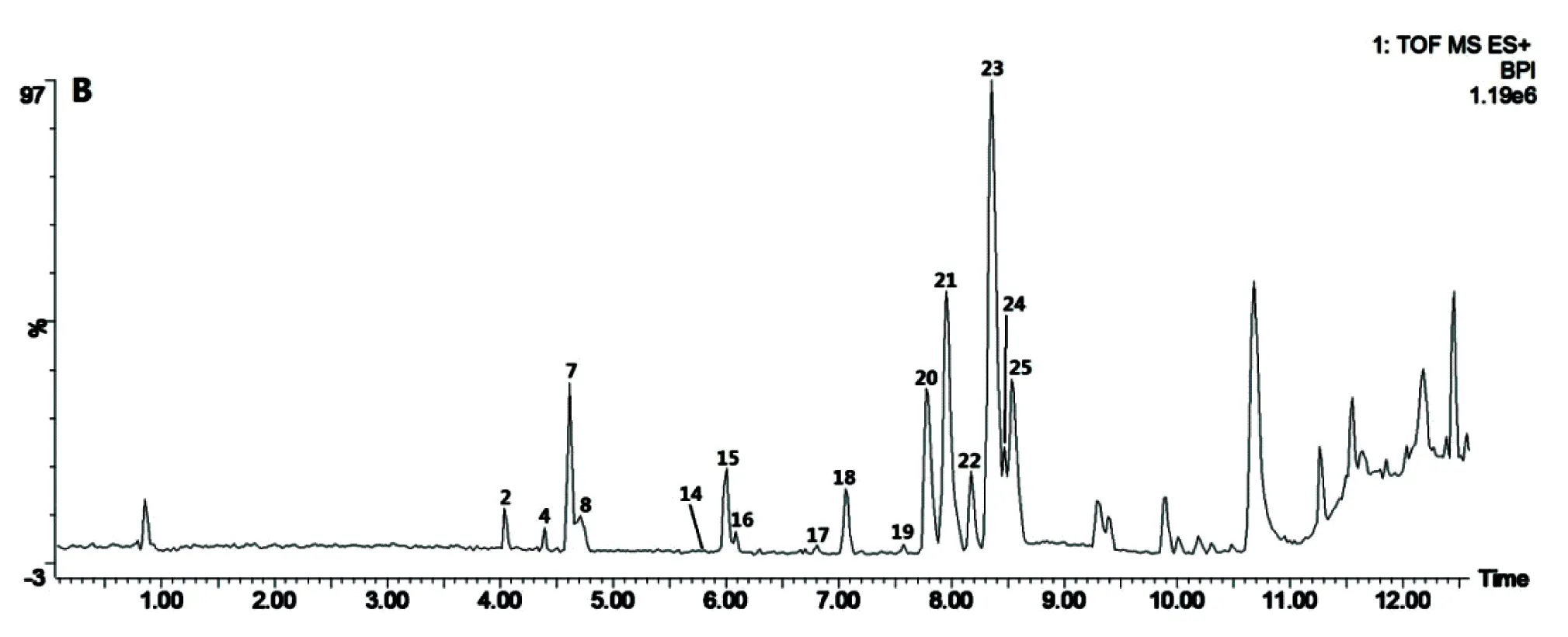
鹅不食草样品及对照品对应基峰强度总离子流图(BPI图)见图2。依据化合物的精确分子量,碎片离子,结合对照品标准图谱及文献报道,共鉴定了26个化学成分,包括倍半萜类9个、有机酸类3个、黄酮及其苷类5个、二萜苷类7个、甾体皂苷类1个、三萜类1个,结果见表4、表5。
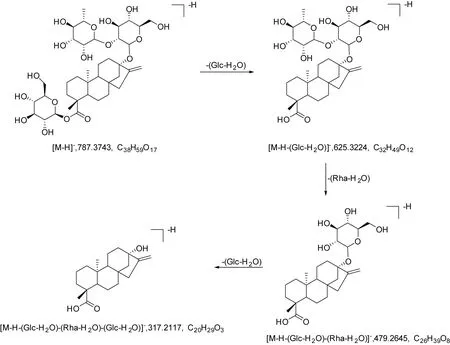
图2 Dulcoside A的质谱裂解特征
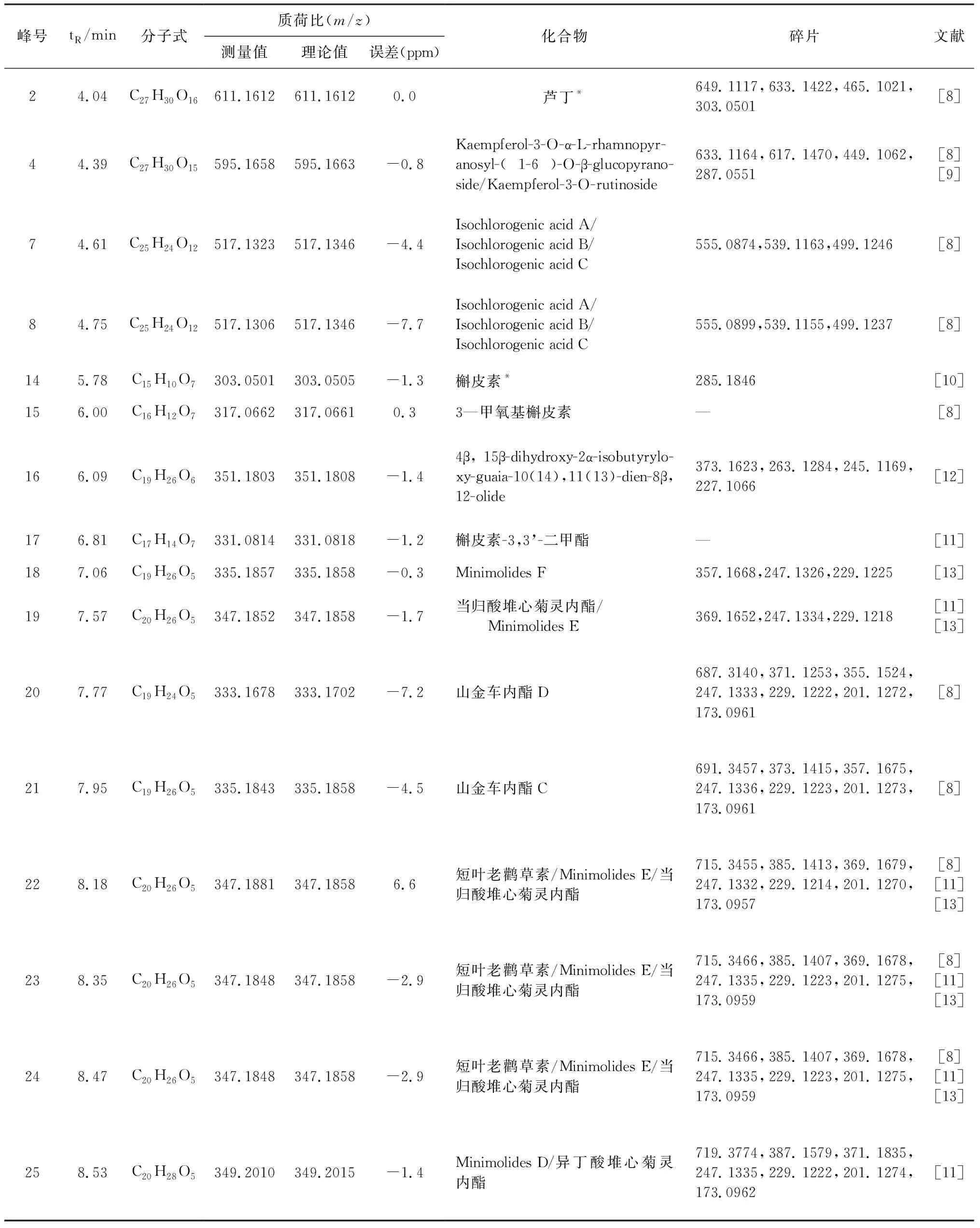
峰号tR/min分子式质荷比(m/z)测量值理论值误差(ppm)化合物碎片文献24.04C27H30O16611.1612611.16120.0芦丁*649.1117,633.1422,465.1021,303.0501[8]44.39C27H30O15595.1658595.1663-0.8Kaempferol-3-O-α-L-rhamnopyr-anosyl-(1-6)-O-β-glucopyrano-side/Kaempferol-3-O-rutinoside633.1164,617.1470,449.1062,287.0551[8][9]74.61C25H24O12517.1323517.1346-4.4Isochlorogenic acid A/Isochlorogenic acid B/Isochlorogenic acid C555.0874,539.1163,499.1246[8]84.75C25H24O12517.1306517.1346-7.7Isochlorogenic acid A/Isochlorogenic acid B/Isochlorogenic acid C555.0899,539.1155,499.1237[8]145.78C15H10O7303.0501303.0505-1.3槲皮素*285.1846[10]156.00C16H12O7317.0662317.06610.33—甲氧基槲皮素—[8]166.09C19H26O6351.1803351.1808-1.44β,15β-dihydroxy-2α-isobutyrylo-xy-guaia-10(14),11(13)-dien-8β,12-olide373.1623,263.1284,245.1169,227.1066[12]176.81C17H14O7331.0814331.0818-1.2槲皮素-3,3’-二甲酯—[11]187.06C19H26O5335.1857335.1858-0.3Minimolides F357.1668,247.1326,229.1225[13]197.57C20H26O5347.1852347.1858-1.7当归酸堆心菊灵内酯/Minimolides E369.1652,247.1334,229.1218[11][13]207.77C19H24O5333.1678333.1702-7.2山金车内酯D687.3140,371.1253,355.1524,247.1333,229.1222,201.1272,173.0961[8]217.95C19H26O5335.1843335.1858-4.5山金车内酯C691.3457,373.1415,357.1675,247.1336,229.1223,201.1273,173.0961[8]228.18C20H26O5347.1881347.18586.6短叶老鹳草素/Minimolides E/当归酸堆心菊灵内酯715.3455,385.1413,369.1679,247.1332,229.1214,201.1270,173.0957[8][11][13]238.35C20H26O5347.1848347.1858-2.9短叶老鹳草素/Minimolides E/当归酸堆心菊灵内酯715.3466,385.1407,369.1678,247.1335,229.1223,201.1275,173.0959[8][11][13]248.47C20H26O5347.1848347.1858-2.9短叶老鹳草素/Minimolides E/当归酸堆心菊灵内酯715.3466,385.1407,369.1678,247.1335,229.1223,201.1275,173.0959[8][11][13]258.53C20H28O5349.2010349.2015-1.4Minimolides D/异丁酸堆心菊灵内酯719.3774,387.1579,371.1835,247.1335,229.1222,201.1274,173.0962[11]
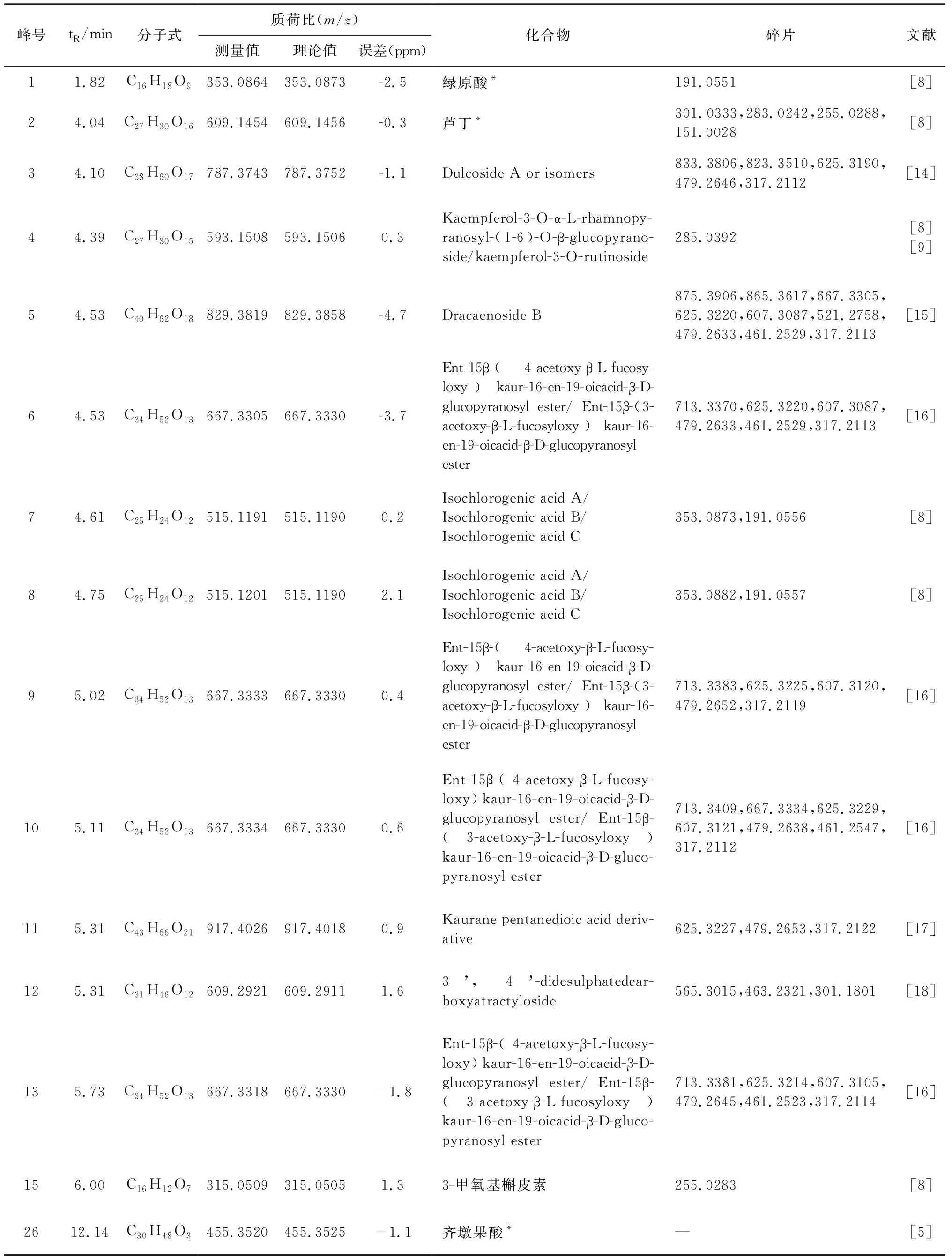
表5 鹅不食草药材负离子模式下化合物归属
3.6.1 二萜苷类化合物
二萜苷类化合物只在负离子模式下有响应,可见[M-H+HCOOH]-、[M+Cl]-、[M-H]-。如3号峰(tR4.10 min)的低能量可见m/z833.3806[M-H+HCOOH]-、m/z823.3510[M+Cl]-和m/z787.3743[M-H]-,确定化合物相对分子量为788。高能量m/z787.3743[M-H]-失去葡萄糖基,产生
m/z625.3190[M-H-(Glc-H2O)]-,进一步失去鼠李糖基,产生m/z479.2646[M-H-(Glc-H2O)-(Rha-H2O)]-,再失去葡萄糖基产生m/z317.2112[M-H-(Glc-H2O)-(Rha-H2O)-(Glc-H2O)]-。将各峰得到的碎片与文献报道比对[14],推测3号峰为Dulcoside A or isomers,其裂解方式见图3。
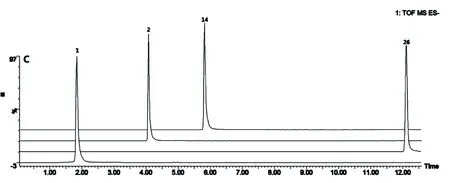
1.绿原酸 2.芦丁 14.槲皮素 26.齐墩果酸
3.6.2 黄酮类化合物
黄酮及黄酮苷类化合物在正、负离子模式下均有响应,正离子模式下可见[M+K]+、[M+Na]+、[M+H]+,负离子模式下可见[M-H]-。如2号峰(tR4.04 min)的低能量分别给出m/z649.1117[M+K]+、m/z633.1422[M+Na]+、m/z611.1612[M+H]+、m/z609.1454[M-H]-,确定化合物相对分子质量为610。高能量正离子模式m/z611.1612[M+H]+失去鼠李糖基,产生m/z465.1021[M+H-(Rha-H2O)]+,进一步失去葡萄糖基,产生m/z303.0501[M+H-(Rha-H2O)-(Glc-H2O)]+;负离子模式m/z609.1454[M-H]-脱去鼠李糖基及葡萄糖基,产生m/z301.0333[M-H-(Rha-H2O)-(Glc-H2O)]-。与对照品比对,确定2号峰为芦丁(Rutin)。
3.6.3 酚酸类化合物
酚酸类化合物在正、负离子模式下均有响应,负离子模式下响应较高,正离子模式下可见[M+K]+、[M+Na]+、[M+H]+,负离子模式下可见[M-H]-。如7号峰(tR4.61 min)的低能量分别给出m/z555.0874[M+K]+、m/z539.1163[M+Na]+、m/z517.1323[M+H]+和m/z515.1191[M-H]-,确定化合物相对分子质量为516。高能量正离子模式m/z517.1323[M+H]+失去一分子H2O,产生m/z499.1246[M+H-H2O]+;负离子模式m/z515.1191[M-H]-脱去一分子咖啡酰基,产生m/z353.0873[M-H-C9H6O3]-,再脱去一分子咖啡酰基,产生m/z191.0556[M-H-2C9H6O3]-。将各峰得到的碎片与文献报道比对[8],推测7号峰为Isochlorogenic acid A或Isochlorogenic acid B或Isochlorogenic acid C。
3.6.4 倍半萜类化合物
倍半萜类化合物只在正离子模式下有响应,可见[2M+Na]+、[M+K]+、[M+Na]+、[M+H]+。如21号峰(tR7.95 min)的低能量给出m/z691.3457[2M+Na]+、m/z373.1415[M+K]+、m/z357.1675[M+Na]+、m/z335.1843[M+H]+,确定化合物相对分子质量为334。高能量m/z335.1843[M+H]+失去C6位的支链,产生m/z247.1336[M+H-C4H8O2]+,再失去一分子H2O,产生m/z229.1223[M+H-C4H8O2-H2O]+。将各峰得到的碎片与文献报道比对[8],推测21号峰为山金车内酯C(Arnicolide C)。
文献曾采用液相色谱-质谱联用技术对鹅不食草进行定性分析,但只分析了其中12个化学成分[8]。本研究共鉴定了26个化学成分,同时Dulcoside A、Kaurane pentanedioic acid derivative及3’,4’-didesulphatedcarboxyatractyloside等二萜苷类化合物系首次报道在鹅不食草药材中发现。
鹅不食草药材正离子模式下化合物归属和负离子模式下化合物归属详见参考文献[8-18]。
4 结 论
本研究建立的HPLC指纹图谱稳定、可靠,化学成分表征信息具有“全息”特征,两种技术和研究结果的整合利用可为鹅不食草药材整体质量评价提供科学依据。
参考文献:
[1] 国家药典委员会. 中华人民共和国药典(一部)[S]. 北京:中国医药科技出版社,2015:347.
[2] 曹俊岭,李国辉. 鹅不食草化学成分研究[J].中国中药杂志,2012,37(15):2301-2303.
[3] 刘宇,杨艳芳,吴和珍,等. RP-HPLC法测定鹅不食草中短叶老鹳草素的含量[J].中药材,2005,28(6):473-474.
[4] 陈惠红,黄婳,项小珍. 鹅不食草总黄酮的含量测定方法研究[J].药物研究,2008,17(21):9-10.
[5] 陈琦,王尚. 鹅不食草总有机酸的提取与分析[J].中国现代药物应用,2010,4(18):10-11.
[6] 梁慧,邓洁薇,杨运云. 高效液相色谱-质谱法对癍痧凉茶的化学成分鉴定及指纹图谱研究[J].分析测试学报,2014,33(2):144-149.
[7] 聂平,肖炳焱,罗晖明,等. 超高效液相色谱-质谱联用技术在中药指纹图谱中的应用[J].中南药学,2013,11(7):524-527.
[8] CHAN C O, JIN D P, DONG N P, et al. Qualitative and quantitative analysis of chemical constituents of Centipeda minima by HPLC-QTOF-MS & HPLC-DAD[J].J Pharm Biomed Anal, 2016, 125: 400-407.
[9] 杨艳芳,张炳武,闫斌,等. 鹅不食草正丁醇部位化学成分研究[J].时珍国医国药,2013,24(10):2358-2359.
[10] 曹俊岭,李国辉. 鹅不食草化学成分研究[J].中国中药杂志,2012,37(15):2301-2303.
[11] 朱艳平. 鹅不食草化学成分及抗肿瘤活性研究[D]. 武汉:湖北中医药大学,2012.
[12] WU P, LI X G, LIANG N, et al. Two new sesquiterpene lactones from the supercritical fluid extract of Centipeda minima[J].J Asian Nat Prod Res, 2012, 14(6): 515-520.
[13] WU P, SU M X, WANG Y, et al. Supercritical fluid extraction assisted isolation of sesquiterpene lactones with antiproliferative effects from Centipeda minima[J].Phytochemistry, 2012, 76: 133-140.
[14] MOLINA-CALLE M , PRIEGO-CAPOTE F , LUQUE DE CASTRO M D. Characterization of Stevia leaves by LC-QTOF MS/MS analysis of polar and non-polar extracts[J].Food chemistry, 2017, 219: 329-338.
[15] ZHENG Q A, ZHANG Y J, LI H Z, et al. Steroidal saponins from fresh stem of Dracaena cochinchinensis[J].Steroids, 2004, 69(2): 111-119.
[16] CELIA B B, MARIANO S C, BALDOMERO E, et al. ent-Kaurene Glycosides from Ageratina cylindrica[J].J Nat Prod, 2015, 78 (11): 2580-2587.
[17] DUBIOS G E, ALTO P, CALIF. Rebaudioside analogs: United States Patent: 4353889[P]. 1982-10-12.
[18] PIACENTE S, PIZZA C, TOMMASIT N D, et al. Sesquiterpene and diterpene glycosides from Xanthium spinosum[J].Phytochemistry, 1996, 41(5):1357-1360.

