OPG和RANKL在创伤后异位骨化模型中的表达及作用
冯祁军 范存义 刘师良 吴可沁 徐龙生
异位骨化是指在正常情况不具有骨化性质的组织中出现骨形成[1]。其严重影响患者肢体功能的恢复,包括继发于肌肉﹑骨骼损伤后的异位骨化,目前尚无理想的预防和治疗方法。护骨素(OPG)和核因子-КB受体活化因子配体(RANKL)是调节破骨细胞分化和活性的重要因子,OPG/RANKL系统是调节骨质代谢最后的共同通路[2]。然后,OPG/RANKL系统在异位骨化中的作用尚未明确。本研究通过Michelsson模型[3]诱导新西兰实验兔形成异位骨化,并采用免疫组化染色对异位骨化标本中OPG和RANKL的蛋白表达水平进行检测,探讨OPG/RANKL系统在创伤后异位骨化形成机制中的表达与作用。
1 临床资料
1.1 异位骨化模型的建立 由嘉兴学院医学实验动物中心提供健康的SPF级雄性新西兰实验兔30只,体重为2.5~3.0kg,新西兰实验兔适应性喂养1周后,第1天实验兔用3%戊巴比妥钠麻醉,首先进行正侧位股骨X线摄片确保实验开始时无异位骨化存在。将30只新西兰实验兔随机分为两组,模型组20只,对照组10只。模型组每只新西兰实验兔每天最大范围活动膝关节5min,活动后用石膏固定右膝和右踝关节(石膏绷带制成13~15cm长,10~12层厚,前窄后宽的3/4管状石膏条带),右髋关节不固定,石膏干固后将实验兔放回笼内,单笼饲养,强力按摩与固定操作6d/周,持续5周。对照组10只新西兰实验兔不干预,作为空白对照。
1.2 异位骨化标本收集及免疫组化染色 在造模后的第8周,摄右股骨正侧位X线片,评价异位骨化的进展及排除骨折等损伤。处死所有实验兔并快速取出异位骨化组织,收集对照组实验兔正常的组织标本作为对照。标本经4%多聚甲醛固定,10% EDTA溶液脱钙7~10d,石蜡整体包埋,做层厚为5μm切片。每个标本取连续的两张切片铺于同一块载玻片上,分别标记为OPG和RANKL,分别用于做OPG 和RANKL免疫组化染色,一抗分别为兔抗兔OPG抗体和兔抗兔RANKL抗体(均购自美国SANTA CRUZ公司)。主要操作步骤:石蜡切片脱蜡水化,高温抗原修复3min,3%过氧化氢封闭10min,分别滴加OPG和RANKL一抗(稀释浓度均为1:150),室温孵育1h,滴加二抗(稀释浓度为1:200),DAB显色,苏木精复染,中性树胶封片,光学显微镜下观察并判定结果。
1.3 结果判定方法 每例标本切片随机选取5个高倍视野下进行结果判定,同一载波片上OPG和RANKL染色选取相同位置的高倍视野,按染色强度及阳性细胞数所占百分比进行综合评分。染色强度:无色计为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞数:<5%时计为0分,5%~25%计为1分,26%~50%计为2分,>50%计为3分;染色强度得分与阳性细胞数得分相乘即得出OPG和RANKL蛋白表达水平的综合评分。取5个高倍视野综合评分的平均分值作为OPG和RANKL最终的表达水平,并计算OPG平均分值和RANKL平均分值的比值,即为OPG/RANKL比值。
1.4 统计学方法 采用SPSS19.0统计软件。计量资料以()表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 异位骨化造模结果 对照组10只新西兰实验兔全部存活至造模后第8周。模型组20只新西兰实验兔中,有2只于造模时因麻醉过量死亡,1只于造模后1周因组织感染死亡,共有18只实验兔存活至造模后8周。造模后第8周,对照组未见异位骨化形成(见图1);模型组存活实验兔中,共有14只(77.8%)形成异位骨化(见图2)。

图1 对照组新西兰实验兔右股骨未见异位骨化形成

图2 模型组新西兰实验兔右股骨可见异位骨化形成
2.2 免疫组化结果 对异位骨化组14只异位骨组织标本和对照组的10只正常组织标本进行免疫组化染色,阳性表达着色,阴性对照不着色。标本中OPG和RANKL阳性表达均定位于胞浆内,呈棕黄色,阳性染色细胞主要为成骨细胞和破骨细胞,呈团状或条带状分布,着色强度不一。分别对异位骨化OPG表达水平﹑RANKL表达水平和OPG/RANKL比值分别进行比较,具体结果见表1。免疫组化图见图3~6。
表1 异位骨组织中的OPG、RANKL 表达水平比较()

表1 异位骨组织中的OPG、RANKL 表达水平比较()
组别 n OPG RANKL OPG/RANKL模型组 14 4.93±0.66 2.89±0.09 1.86±0.27对照组 10 3.49±0.08 3.01±0.16 1.19±0.47 t值 2.268 0.655 2.353 P值 0.012 0.537 0.023

图3 对照组异位骨组织的OPG 表达(IHC,10×40)
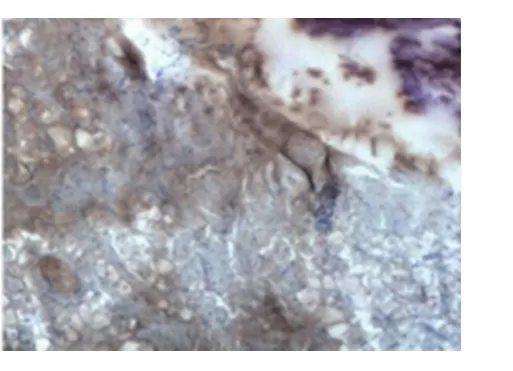
图4 模型组异位骨组织的OPG 表达(IHC,10×40)

图5 对照组异位骨组织的RANKL表达(IHC,10×40)

图6 模型组异位骨组织的RANKL表达(IHC,10×40)
3 讨论
异位骨化初期的组织学特征为成纤维细胞活动增加及纤维组织异常增生,继而出现细胞和血管形成减少,玻璃样变性形成;最终导致广泛的钙质沉积以及新骨形成。骨质重塑的过程主要由破骨细胞与成骨细胞这一成对的﹑相偶联的细胞活动主导,破骨细胞促使钙质释放和骨质吸收,成骨细胞促使钙质沉积和新骨形成,正常情况下两者活动维持在一定的平衡水平[4]。
OPG和RANKL均主要由成骨细胞﹑基质细胞产生,在骨骼﹑骨髓以及淋巴组织中的表达水平较高[5],OPG的主要作用在于抑制破骨细胞的活性及功能,从而下调骨质吸收,促进钙化过程及骨质形成;RANKL的主要作用为刺激破骨细胞的分化和活性,抑制破骨细胞的凋亡,从而促进骨质破坏和吸收[6]。RANKL主要通过与破骨细胞前体及成熟破骨细胞表面的受体核因子-КB受体活化因子(RANK)结合,刺激破骨细胞的分化﹑活性以及抑制破骨细胞的凋亡;而OPG作为诱饵受体可与RANKL发生竞争性结合,阻止RANKL与其受体RANK的相互作用,从而抑制破骨细胞的分化和活性[7]。因此,OPG/RANKL比值是决定骨质重塑方向的关键因素,OPG/RANKL比值降低可促进骨质的破坏和吸收,OPG/RANKL比值升高则可促进钙质沉积和骨质形成。
OPG/RANKL系统在创伤后异位骨化过程中同样扮演着重要角色。OPG主要由新生骨组织间成骨细胞表达并与钙质沉积的部位关系密切,提示OPG可能参与创伤后异位骨化形成过程。本研究对新西兰实验兔异位骨化模型组织标本中OPG和RANKL进行检测,证实了异位骨组织有OPG和RANKL阳性表达,主要位于骨祖细胞﹑成骨细胞﹑成纤维细胞及破骨细胞包浆内。通过对异位骨化组织和正常组织中的OPG和RANKL表达水平进行比较,发现异位骨化组织中的OPG表达水平明显增加,而且OPG/RANKL的比值也显著升高。以上结果表明,OPG/RANKL系统可能在异位骨化形成过程中发挥调节作用;OPG的表达增加以及OPG/RANKL比值增加,对异位骨化的形成和发展可能存在促进作用。在各种炎症细胞和因子的作用下,纤维细胞异常增生,OPG 合成增加及OPG/RANKL比值增加,从而抑制了破骨细胞的分化和活性,使成骨活动得到增强,钙质沉积和新骨形成增加,最终导致异位骨化的形成。
[1] Ko JK,Tompson JD,Sholder DS,et al.Heterotopic ossification of the long head of the triceps after reverse total shoulder arthroplasty.J Shoulder Elbow Surg,2016,25(11):1810-1815.
[2] 仲蕾蕾,杨冰,黄晓斌,等.OPG/RANKL/RANK系统在成骨细胞和破骨细胞相互调节中的作用.中国骨质疏松杂志,2011,17(11):1010-1013.
[3] Michelsson JE,Granroth G,Andersson LC.Myositis ossificans following forcible manipulation of the leg.A rabbit model for the study of heterotopic boneformation.J Bone Joint Surg Am,1980,62(5):811-815.
[4] Papadopouli AE,Klonaris CN,Theocharis SE.Role of OPG/RANKL/ RANK axis on the vasculature.Histol Histopathol, 2008,23(4):497-506.
[5] Boyce BF,Xing L.Functions of RANKL/RANK/OPG in bone model ing and remodeling.Arch Biochem Biophys,2008, 473(2):139-146.
[6] Kan L,Kessler JA.Evaluation of the cellular origins of heterotopic ossification.Ortbopedics,2014,37(5):329-340.
[7] Markus C,Kuhn A,Holger S,et al.Scherbaum a,Sven Schinner a Adipocyte-secreted factors increase osteoblast proliferation and the OPG/RANKL ratio to influence osteoclast formation molecular and cellular.Endocrinology,2012,34:180-188.

