百合单萜类物质释放与LhTPS表达关联性研究
王 婷,樊俊苗,张浩宇,樊玮鑫,杜 方*
(1.山西农业大学 园艺学院,山西 太谷 030801; 2.山西农业大学 实验教学中心,山西 太谷 030801)
自古以来,花香就吸引了人们的注意并且渗入到了生活的很多方面,被广泛应用于食品、化妆品、医疗等众多领域。近年来,有关学者分别对玫瑰[1]、桂花[2]、菊花[3]、兰花[4-5]、梅花[6]和百合[7]等植物的花香进行了研究。百合是世界上知名的切花花卉,品种丰富、香型多样,有墨香、浓香、淡香和无香4种香型[8],是开展花香研究的优良材料。
国内外已经初步开展了百合花香的研究工作。现已探明百合花瓣是主要的释香部位[9-10],其香气成分随着百合花的开放程度以及昼夜节律发生规律性的变化[10-12],单萜类化合物是有香百合花香挥发物的主要成分,其中月桂烯、罗勒烯和芳樟醇含量较高[11,13]。与有香百合相比,无香百合中单萜类化合物的释放量很低或检测不到[10,13]。
单萜类化合物主要通过4-磷酸-2-甲基赤藓糖途径合成,单萜合酶是该生物合成途径最后一步的关键酶[14-16],单萜合酶基因的表达水平是影响单萜化合物含量的主要因素[17-18]。现今,已从仙女扇[19]、拟南芥[20]、姜花[21]、六出花[22]等中克隆得到罗勒烯、芳樟醇、香叶醇等多个单萜类合酶基因,发现这些单萜合酶基因表达与萜烯产物合成有直接关系。目前,已从岷江百合、西伯利亚、罗马广场和Belladonna花瓣中克隆到LreTPS、Li-mTPS2、LiLiS、LiMyS和LhTPS等单萜合酶基因[9,23-25]。同时,对单萜合酶基因的表达规律研究表明,百合单萜合酶基因在花被片中表达量最高,在叶片中也有一定表达,在雄蕊和柱头中微量表达[24]。东方百合西伯利亚芳樟醇合酶基因和月桂烯合酶基因的表达量高于亚洲百合罗马广场,且这2种单萜合成酶基因的表达规律随花朵的开放程度表现出先增加后减少的规律[23]。
虽然百合花香研究已取得了一些进展,但对百合单萜合酶基因的研究仅局限于少数种和品种中,且对于花香挥发性成分的分析和基因的研究是独立进行的,尚不清楚主要致香成分与相关基因的关联性。为此,选取了4种香型百合共13个品种的花瓣作为试验材料,检测每个品种在花朵发育的4个时期单萜挥发物的种类和含量;并从中选取不同杂种系的6种材料,研究LhTPS基因在品种间和花朵发育时期中的表达水平,以确定单萜合酶基因与单萜类挥发物释放的关联性,为进一步开展百合花香育种研究提供指导。
1 材料和方法
1.1 材料
材料选自山西农业大学园艺站露地种植的百合共计13种,包括2种东喇百合(Orienpet hybrids):罗宾娜(墨香)、木门(墨香);2种喇叭百合(Trumpet hybrids):完美(墨香)、橙星(浓香);4种东方百合(Oriental hybrids):新娘(浓香)、蒙娜丽莎(浓香)、索邦(浓香)、西伯利亚(浓香);2种麝亚百合(Longiflorum×Asiatic hybrids):亮钻(淡香)、金石(淡香);1种新铁炮百合(Liliumformolongi‘Julius’):朱丽叶(淡香);2种亚洲百合(Asiatic hybrids):塞西尔(淡香)、小重瓣(无香)。根据花被片张开程度将百合花发育阶段分为4个时期:显色期(花被片已充分显色但未张开)、初开期(花被片略张开,花药未散粉)、盛开期(花被片完全张开,花药已散粉)、衰败期(花被片开始萎蔫,花药停止散粉)。在17:00—19:00时间段采集13个品种、4个时期健康植株的花被片,每朵花取一半用于挥发性成分测定,另一半用液氮速冻后置于-80 ℃冰箱以备RNA提取。
1.2 顶空固相微萃取
称取百合花瓣约1.5 g,置于15 mL固相微萃取专用顶空瓶中,用已老化好的萃取头(Supelco公司,50/30 μm PDMS/DVB/CAR)50 ℃顶空萃取15 min。自动进样,在进样口解析5 min。
1.3 GC-MS分析
利用山西农业大学实验教学中心共享平台的GC-MS分析仪进行分析。
GC(Trace ISQ型号,Thermo公司)工作条件:色谱柱规格为30 m×0.25 mm×0.25 μm(柱长×柱内径×柱膜厚),公司为Thermo,型号为DB-5MS。载气为He,流速为1 mL/min。程序升温过程:起始温度40 ℃,保持2 min,然后以5 ℃/min的速度升至270 ℃,保持6 min。
MS(Trace ISQ型号,Thermo公司)工作条件:电离方式为El;电离电压为70 eV;质谱扫描范围:45~600 amu;离子源温度为280 ℃;接口温度为280 ℃。
采用Xcalibur软件系统,使用NIST谱库检索定性。各化合物成分绝对含量用峰面积表示。
1.4 总RNA提取与反转录
选择木门、橙星、索邦、亮钻、朱丽叶、小重瓣6个品种提取花瓣总RNA。RNA的提取根据GenStar公司的TRIGene 总RNA提取试剂盒说明书进行,用1.5%的琼脂糖凝胶电泳检测其质量,用NanoDrop 2000C光度计检测RNA浓度和纯度,质量合格的RNA保存于-80 ℃超低温冰箱。
按照GenStar公司的StarScript Ⅱ cDNA 第一链合成试剂盒说明书反转录cDNA,将得到的cDNA溶液稀释至100 ng/μL,保存于-20 ℃冰箱备用。
1.5 引物的设计
以GenBank中LhTPS基因( KR998333 )序列为模板,采用primer 3(http://primer3.ut.ee/)在线设计引物(正向引物:5’-AGACTCGCAAGGGTTCAAGG-3’;反向引物:5’-CGTACAAGCTCAGCAGTCCT-3’),交由生工生物工程有限公司合成。
1.6 实时荧光定量PCR
以GAPDH为内参基因(正向引物:5’-TGATAAGTTTGGGATTGTCGAGGG-3’;反向引物:5’-TTTCTGAGTAGCAGTGATGGCGTG-3’),利用TaKaRa公司 qRT-PCR试剂盒配置20 μL反应体系,包括 SYBR Ⅱ 10 μL、双蒸水7 μL、cDNA 1 μL、Primer 1.6 μL、ROX 0.4 μL;在7500 Real Time PCR System运行qRT-PCR试验,每个样本重复3次。反应程序如下:95 ℃ 3 min;94 ℃ 30 s、55 ℃ 30 s、72 ℃ 1 min(荧光),共40个循环;溶解曲线条件为95 ℃ 15 s,54 ℃ 1 min,从54 ℃每30 s上升0.4直到95 ℃,95 ℃ 30 s(荧光),54 ℃ 15 s。
1.7 数据处理与统计分析
利用HemI 1.0软件以单萜化合物检测得到的峰面积绘制百合单萜类化合物含量热图,采用2-ΔΔCt法计算基因相对表达量,采用SAS和LSD法进行统计分析及多重比较,利用Origin 6.0软件绘制断层图并进行相关性分析。
2 结果与分析
2.1 百合单萜类物质的释放规律
13种百合4个时期单萜类物质的组成和释放规律如图1所示。每种百合检测到的单萜化合物种类各不相同,在这13种百合4个时期中,共鉴定出34种单萜化合物,含量大于1%的如图1所示,共18种。萜烯化合物中含量较高的是罗勒烯、芳樟醇和1,8-桉叶素。除无香型小重瓣无罗勒烯释放外,其他百合花香挥发物中均含有较多罗勒烯,平均含量为56.2%,芳樟醇次之,含量为18.7%。值得关注的是,东喇百合和喇叭百合的释放物中,1,8-桉叶素的含量最高,占单萜总释放量的93.93%,超过了罗勒烯的含量,推测这是形成这些百合特殊麝香气味的重要化合物。无香百合小重瓣仅在初开期检测到芳樟醇一种单萜类化合物。由此推测,可以根据单萜化合物的成分对百合的香型进行分类。
在有香百合中,单萜类物质的释放与花的发育时期之间均表现出一定的相关性。同一个品种4个时期的百合所检测到的单萜化合物种类相近,含量不同。罗宾娜、完美、金石、朱丽叶4个品种在初开期单萜化合物种类和含量达到最高,随着发育进程,在盛开期和衰败期依次减少;其余的8个有香百合品种随发育进程释放的单萜化合物种类和含量依次增加,在盛开期达到最高值,随后释放量减少。可以看出,即便是同一个杂种系,不同品种的百合在发育过程中单萜类物质的成分及含量的变化规律也可能不同,但整体上单萜类化合物的成分和含量保持着先增加后减少的变化规律。
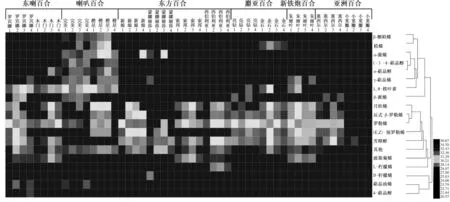
1表示显色期,2表示初开期,3表示盛开期,4表示衰败期;蓝色表示低水平含量,绿色表示中等水平含量,红色表示高水平含量。其他表示相对含量小于1% 的单萜类化合物
2.2 LhTPS基因在花瓣4个发育时期不同品种中的表达特征
在显色期和盛开期,LhTPS基因在墨香型百合木门和浓香型百合橙星、索邦中的表达量皆显著高于清香型百合亮钻、朱丽叶和无香型百合小重瓣中LhTPS基因的表达量(图2)。在初开期,LhTPS基因在墨香型百合木门和浓香型百合橙星中的表达量显著高于其他4种百合中LhTPS基因的表达量。在衰败期,墨香型百合木门中LhTPS基因的表达量显著高于在其他5种百合中的表达量。

同一时期不同小写字母表示差异显著(P<0.05)
LhTPS基因在木门和橙星中,初开期和盛开期的表达量都显著高于显色期和衰败期,其中,在木门的盛开期比初开期显著高表达,在橙星初开期和盛开期的表达差异不显著;在小重瓣的初开期中比其他3个时期显著高表达;在索邦、亮钻和朱丽叶中没有明显的表达规律(图3)。
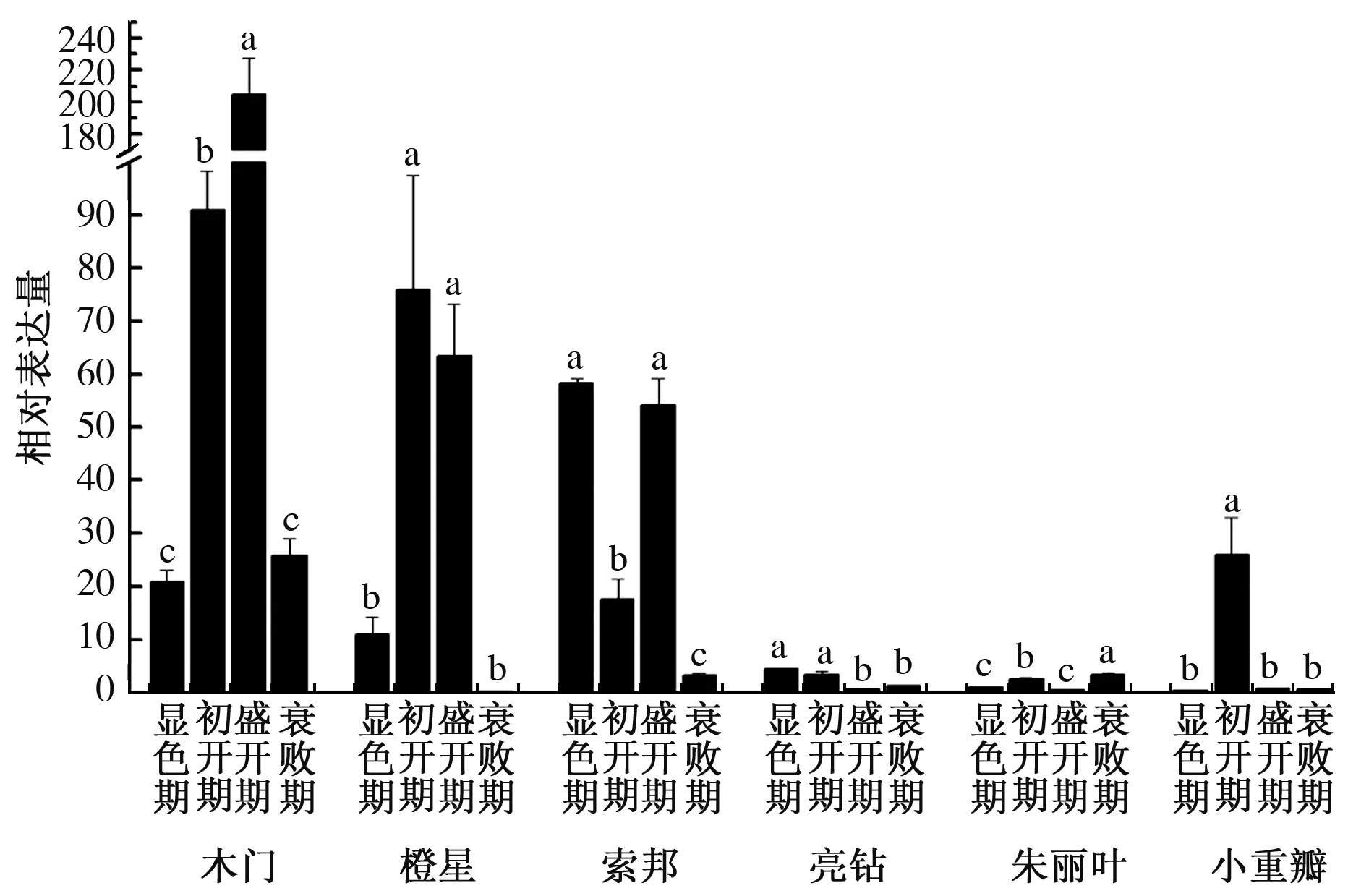
同一品种不同小写字母表示差异显著 (P<0.05)
2.3 LhTPS基因的表达水平与单萜化合物含量的相关性分析
使用Origin 6.0对5种有香百合中对LhTPS基因的相对表达量与各单萜类物质依次进行相关性分析发现,在盛开期时,LhTPS基因表达水平与罗勒烯和芳樟醇2种化合物的含量显著相关,相关系数分别为0.968和0.934,其中LhTPS基因表达水平与罗勒烯的含量极显著相关(图4)。由此可见,LhTPS基因的表达对于罗勒烯和芳樟醇2种化合物的合成具有重要的作用。
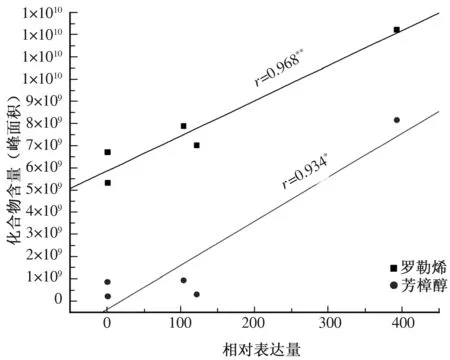
图4 LhTPS基因的表达水平与罗勒烯和芳樟醇含量的相关性
3 结论与讨论
通过研究13种百合4个时期单萜类物质的组成和含量发现,有香百合释放的单萜类化合物种类和含量都较无香百合释放的多,此结果与Kong等[7,10]、张辉秀等[13]、Hu等[26]从不同香型百合挥发物的成分所检测出的结果相一致。此外,各个品种随其发育进程也表现出了一定的规律:单萜化合物的种类和含量随发育进程先增大后减小,在初开期或盛开期达到了最高值,这不仅与白天堂百合[11]和西伯利亚百合[12]随发育时期表现出的规律相一致,在其他植物如水仙[27]和紫藤[28]的不同开花期也发现了同样的规律。同时,与张辉秀等[13]、Kong等[10]报道结果一致的是,本研究发现在东方百合、麝香百合、新铁炮百合和有香的亚洲百合中,罗勒烯是百合的关键致香成分,个别东方百合除罗勒烯外也含有大量的芳樟醇,而东喇百合和喇叭百合则释放出较多的1,8-桉叶素。不同的挥发性化合物的含量和种类使得百合成为香味富有变化的芳香植物,提供了百合作为模式花香植物研究的可能性。
不同百合品种其LhTPS基因表达量不同。从整体上来说,墨香型和浓香型百合的LhTPS基因表达水平高于淡香型和无香型百合。唐彪等[23]从浓香型的西伯利亚和淡香型的罗马广场百合花瓣中克隆得到芳樟醇合酶基因Li-LiS和月桂烯合酶基因Li-MyS,发现在花蕾、半开、盛开、衰败4个花期中,西伯利亚花瓣2个单萜合成酶基因表达水平均高于罗马广场,这与本研究在显色期、初开期、盛开期的研究结果相一致。但在本试验中,发现在衰败期时,除墨香型百合木门中LhTPS基因的表达量显著高于在其他5种百合中的表达量外,其余香型百合中LhTPS基因的表达量并没有显著差异,这可能与本试验所采用的百合品种有关,有待继续进行试验检测结果。
木门、橙星和小重瓣的单萜合酶基因表达水平随发育进程表现出先增加后减少的规律,这与唐彪等[23]发现的芳樟醇合酶基因和月桂烯合酶基因这2种单萜合成酶基因的表达规律随花朵的开放程度表现出先增加后减少的规律相一致。但是,奇怪的是,索邦、亮钻和朱丽叶的单萜合酶基因表达水平没有明显的变化规律,可能与其参与调控的关键酶和底物供应水平有关。
LhTPS基因的表达水平与单萜化合物含量的相关性分析表明,在盛开期时,LhTPS基因与罗勒烯的合成极显著相关,与芳樟醇的合成显著相关。罗勒烯在所有有香百合中均被检测到,芳樟醇是个别东方百合花香化合物中主要的致香成分,因此,LhTPS基因在研究百合花香分子育种等方面具有很大的研究价值,需要继续进行基因功能验证。花香代谢调控复杂,因此需要继续同时结合代谢路径关联性以及调控分析探索百合花香调控的机制。
单萜类物质含量的高低,被认为是百合香味差异的原因之一。本研究发现,随着百合花朵的开放,其香气成分中单萜类物质的含量表现出先增加后减少的规律,有香百合的主要单萜类成分为罗勒烯和芳樟醇,但喇叭百合和东喇百合中的单萜类成分主要是1,8-桉叶素和罗勒烯。喇叭百合、东喇百合和东方百合的LhTPS基因表达水平高于麝香百合和亚洲百合。盛开期时,LhTPS基因的表达水平与罗勒烯和芳樟醇2种化合物的合成具有显著关联性,因此LhTPS基因在研究百合花香分子育种等方面具有很大的研究价值,本研究为百合花香育种研究奠定了基础。
参考文献:
[1] 员梦梦,李保印,周秀梅.静态顶空进样-气质联用法测定玫瑰花香成分[J].食品工业科技,2016,37(20):101-103.
[2] 侯丹.桂花主要品种花香和花色及其对温度变化的响应[D].杭州:浙江农林大学,2014.
[3] 徐瑾,李莹莹,郑成淑,等.菊花不同花期及花序不同部位香气成分和挥发研究[J].西北植物学报,2012,32(4):722-730.
[4] 彭红明.中国兰花挥发及特征花香成分研究[D].北京: 中国林业科学研究院,2009.
[5] 张莹,王雁,田敏,等.不同种兰花香气成分分析[J].分析科学学报,2012,28(4):502-506.
[6] 赵印泉,潘会堂,张启翔,等.梅花花朵香气成分时空动态变化的研究[J].北京林业大学学报,2010,32(4):201-206.
[7] Kong Y,Bai J R,Lang L X,etal.Floral scents produced byLilium,andCardiocrinum,species native to China[J].Biochemical Systematics & Ecology,2017,70:222-229.
[8] 杜方.百合引种栽培与分子研究[M].北京:中国林业出版社,2015.
[9] Johnson T S,Schwieterman M L,Kim J Y,etal.Liliumfloral fragrance: A biochemical and genetic resource for aroma and flavor[J].Ashs Conference,2015,122:103-112.
[10] Kong Y,Sun M,Pan H T,etal.Composition and emission rhythm of floral scent volatiles from eight lily cut flowers[J].Journal of the American Society for Horticultural Science,2012,137(6):376-382.
[11] 张辉秀,胡增辉,冷平生,等.‘白天堂’百合不同开花期香气成分动态变化研究[J].北方园艺,2012(16):68-71.
[12] 张辉秀,冷平生,胡增辉,等.‘西伯利亚’百合花香随开花进程变化及日变化规律[J].园艺学报,2013,40(4):693-702.
[13] 张辉秀,胡增辉,冷平生,等.不同品种百合花挥发性成分定性与定量分析[J].中国农业科学,2013,46(4):790-799.
[14] Muhlemann J K,Klempien A,Dudareva N.Floral volatiles:From biosynthesis to function[J].Plant,Cell & Environment,2014,37:1936-1949.
[15] 郝瑞杰.植物花香研究[M].北京:中国林业出版社,2014.
[16] Tholl D.Biosynthesis and biological functions of terpenoids in plants[J].Advances in Biochemical Engineering-Biotechnology,2015,148:63-106.
[17] Nieuwenhuizen N J,Chen X,Wang M Y,etal.Natural variation in monoterpene synthesis in kiwifruit: transcriptional regulation of terpene synthases by NAC and ETHYLENE-INSENSITIVE3-like transcription factors[J].Plant Physiology,2015,167(4):1243-1258.
[18] Zeng X L,Cai L,Zheng R R,etal.Emission and accumulation of monoterpene and the key terpene synthase(TPS) associated with monoterpene biosynthesis inOsmanthusfragranslour[J].Frontiers in Plant Science,2015,6(13):1232.
[19] Dudareva N,Cseke L,Pichersky E.Evolution of floral scent inClarkia:Novel patterns of S-linalool synthase gene expression in theC.breweriflower[J].Plant Cell,1996,8(7):1137-1148.
[20] Chen F,Tholl D,D′Auria J C,etal.Biosynthesis and emission of terpenoid volatiles fromArabidopsisflowers[J].Plant Cell,2003,15(2):481-494.
[21] Li R,Fan Y.Molecular cloning and expression analysis of a terpene synthase gene,HcTPS2, inHedychiumcoronarium[J].Plant Molecular Biology Reporter,2011,29(1):35-42.
[22] Aros D,Gonzalez V,Allemann R K,etal.Volatile emissions of scentedAlstroemeriagenotypes are dominated by terpenes, and a myrcene synthase gene is highly expressed in scentedAlstroemeriaflowers[J].Journal of Experimental Botany,2012,63(7):2739-2752.
[23] 唐彪,胡增辉,冷平生,等.浓香型和淡香型百合单萜合酶基因差异表达[J].北京农学院学报,2016,31(2):88-94.
[24] 李路路,王欢,孙明,等.岷江百合单萜合酶基因克隆与表达分析[J].福建农林大学学报(自然科学版),2014,43(4):397-402.
[25] 李天娇,冷平生, 杨凯,等.百合单萜合成酶基因的克隆与序列分析[J].北京农学院学报,2014,29(3):6-10.
[26] Hu Z H,Tang B,Wu Q,etal.Transcriptome sequencing analysis reveals a difference in monoterpene biosynthesis between scentedLilium‘Siberia’ and unscentedLilium‘Novano’[J].Frontiers in Plant Science,2017,8:1351.
[27] 黄巧巧,冯建跃.水仙花开放期间香气组分变化的研究[J].分析测试学报,2004,23(5):110-113.
[28] 李祖光,李建亮,曹慧,等.紫藤鲜花在不同开花期的头香成分[J].浙江农林大学学报,2009,26(3):308-313.

