芫荽籽精油成分解析及其对秀丽隐杆线虫寿命和运动的影响
徐悦 束成杰 聂韡

摘要:以水蒸气提取法获得芫荽籽精油,通过气质联用(GC-MS)方法检测鉴定分析了精油的组分与含量,同时以秀丽隐杆线虫为模式生物研究芫荽籽精油对线虫的影响。结果表明,GC-MS检测确定精油中有效组分有18种,其中芳樟醇含量最高,为83.43%;其次为乙酸橙花酯,为3.21%;萜品烯,为2.85%;α-蒎烯,为2.53%;樟脑,为1.33%;橙花醇,为1.11%等。动物试验结果表明,芫荽籽精油对线虫具有抑制作用,与对照试验组相比,芫荽籽精油处理后的线虫出现寿命缩短、运动行为能力下降、后代数目减少以及体内ROS水平升高的变化,且2组间差异显著,推测芫荽籽精油处理后可能导致线虫神经系统受损及胰岛素信号通路变化是导致线虫出现上述变化的原因。
关键词:芫荽籽精油;芳樟醇;秀丽隐杆线虫;GC-MS;ROS水平
中图分类号:S432.4+5 文献标志码: A 文章编号:1002-1302(2019)14-0111-05
芫荽(Coriandrum sativum L.)为一年生或两年生的伞形科芫荽属草本植物,最早在汉代从西方国家引入我国,目前在我国种植广泛,不仅是美味的蔬菜,同时也是一味常见中药材。芫荽籽可药食两用,其精油成分不仅可用于调配食品,还有防腐抑菌及多种疾病治疗的作用[1-3]。秀丽隐杆线虫(Caenorhabditis elegans)是一种广泛应用于药理学、遗传学、发育学和神经生物学等领域研究的模式生物,具有体积小、体透明、结构简单、生命周期短、易饲养等特点,其神经系统、生殖系统、消化系统与哺乳动物具有高度同源性,是一种适用于化合物物质性质评价与机制研究的模式生物[4-5]。本研究以水蒸气蒸馏法提取芫荽籽精油,并采用气质联用(GC-MS)法对其成分进行鉴定与解析;同时还研究了芫荽籽精油对秀丽隐杆线虫寿命、运动行为能力、后代数目以及体内活性氧水平方面的影响,以期为探究芫荽籽精油对线虫作用影响提供依据。
1 材料与方法
1.1 材料与仪器
芫荽籽采自江苏省南京市高淳地区,由南京野生植物综合利用研究院肖正春教授鉴定为伞形科芫荽属的籽实,芫荽籽于2016年8月采集保存,经干燥后粉碎过40目筛备用。秀丽隐杆线虫(N2野生型)和OP50(尿嘧啶渗漏突变型)大肠埃希菌由东南大学惠赠,线虫试验工作于2017年4月在南京野生植物研究院线虫实验室内开展。
琼脂,日本制药株式会社生产;活性氧(ROS)试剂盒,南京建成科技有限公司生产;胆固醇、多聚蛋白胨、NaCl、CaCl2、MgSO4·7H2O、K3PO4、KH2PO4、Na2HPO4、NaCl、NaOH、NaClO、DMSO均为国药集团化学试剂有限公司生产。
顶空气质联用仪,美国安捷伦科技有限公司生产;LDZX-50KBS 立式压力蒸汽灭菌锅,上海申安医疗器械厂生产;HCB-1300V洁净工作台,青岛海尔特种电器有限公司生产;SPX-150B-Z型生化培养箱,上海博讯实业有限公司医疗设备厂生产;JW-2017HR高速冷冻离心机,安徽嘉文仪器装备有限公司生产;奥林巴斯显微镜,OlympusBX41,南京艾朗仪器有限公司生产。
1.2 试验方法
1.2.1 芫荽籽精油提取 精确称取芫荽籽粉末120 g置于蒸馏瓶中,加入蒸馏水进行水蒸气蒸馏法提取精油,料液比为1 ∶ 10,浸泡1 h后蒸馏3 h,馏出液冷凝收集,经萃取、过滤、干燥、除杂后得样品精油0.61 g,得油率为0.508%,使用该精油做GC-MS成分分析和秀丽线虫体内试验。
1.2.2 GC-MS测定条件与成分解析[6] 气相色谱条件:色谱柱为HP-5MS毛细管色谱柱(30.00 m×0.25 mm×0.25 μm),载气为高纯He(99.999%),进样量为1 μL,分流比为60 ∶ 1,流速为1 mL/min。升温程序:初始温度80 ℃保留 1 min,然后2 ℃/min至180 ℃,然后5 ℃/min至220 ℃保留8 min。
质谱条件:EI离子源,电能量70 eV,离子源温度230 ℃,接口温度250 ℃,扫描范围为全扫描。
成分解析:对照标准谱库NIST11检索,用峰面积归一法计算各组分相对百分含量。
1.2.3 芫荽籽精油对秀丽隐杆线虫的影响
1.2.3.1 试剂的制备 线虫生长(NGM)培养基的配制:3.0 g NaCl、17.0 g琼脂、2.5 g多聚蛋白胨,溶于975 mL蒸餾水中,经高压蒸汽灭菌、冷却至55 ℃左右后,加入10 mL CaCl2(0.1 mol/L),10 mL MgSO4(0.1 mol/L),1 mL胆固醇(5 mg/L),25 mL K3PO4溶液(0.1 mol/L),混匀使用。
M9缓冲液的配制:3 g KH2PO4、6 g Na2HPO4、5 g NaCl、1 mL MgSO4(1 mol/L),溶于1 L蒸馏水中,经高压蒸汽灭菌后使用。
裂解液的配制:0.5 mol/L NaOH、2.5%(体积比)NaClO,使用时按体积比1 ∶ 1混合。
精油浓度配制:将芫荽籽精油先溶于同体积的二甲基亚砜(DMSO)中,再用M9缓冲液稀释至所需浓度。
1.2.3.2 线虫同步化 用涂有OP50的NGM培养基培养线虫,待成年线虫体内有卵时,用M9缓冲液将成虫从培养基表面冲下来,吸取放入无菌EP管中,待虫体自然沉降后吸去上清液,然后加入适量M9缓冲液洗涤3次,然后向EP管中加入1 mL裂解液,将离心管反复来回颠倒,重悬至完整的线虫数量显著下降,5 000 r/min离心1 min,弃上清,再加入1 mL M9缓冲液洗涤3次,离心后将沉淀转移到新的涂有OP50的培养基上,放入20 ℃培养箱中培养。
1.2.3.3 线虫存活率和寿命测定 线虫经同步化后培养至L4期成虫时,收集该时期的线虫,随机分组加入到96孔板中,每孔线虫数量相同,分别加入100 μL体积分数为1.0%、0.8%、0.6%、0.5%、0.4%、0.3%、0的芫荽籽精油样液,置于20 ℃培养箱中暴露24 h后计数存活的线虫数目,计算存活率。取暴露后的线虫用于寿命测定,将存活的线虫挑取到新的涂有OP50的培养基上,每组100条线虫,每天记录当天培养基上存活和死亡的线虫数目,然后将活着的线虫挑取到新的培养基上,直至培养基上线虫全部死亡为止(对铂金丝刺激无反应者记为死亡)。
1.2.3.4 线虫运动行为测定 运动行为测定包括头部摆动频率、身体弯曲频率、吞咽频率和排泄周期4个方面。同寿命试验方法处理收集线虫后进行试验测定,每组10条线虫。
头部摆动频率的测试是将线虫转移到含有适量M9缓冲液的NGM培养基上,待其恢复1 min后测试其在后20 s内头部摆动次数。1次成功的头部摆动定义为其头部摆动方向转过其身体朝向方向。
身体弯曲频率的测试是计数线虫在培养基上20 s内身体弯曲的次数,1次成功的身体弯曲定义为以身体形成的S型中轴线为轴,向前行进1个正弦波形的过程。
吞咽频率的测定是计数线虫在涂有OP50的培养基上 20 s 内咽泵运动次数。
排泄周期的测定是计数线虫在涂有OP50的培养基上2次排泄之间的间隔时间。线虫的排泄孔位于尾部,排泄时尾部会发生明显收缩,并伴有排泄物的释放。
1.2.3.5 线虫后代数目测定 同寿命试验方法处理线虫,将线虫收集至无菌EP管中,用M9缓冲液反复冲洗3次,将虫体转移到新的培养基上,每个培养基上放置1条线虫,每天计数培养基上的后代数目并将该成虫转移到新培养基上,直至该成虫不产生后代为止,计算每条虫子所有后代数目的总和,每组共10条线虫。
1.2.3.6 线虫体内活性氧水平测定 收集L4期线虫,用生存率为0对应浓度的精油暴露线虫,然后按照ROS试剂盒的操作说明进行试验,用激光扫描共聚焦显微镜激发线虫产生的荧光并拍照记录,激发波长488 nm,测量波长510 nm。
1.2.4 统计学分析 数据以平均数±标准差表示,使用Microsoft Office Excel软件进行统计学t-检验分析。
2 结果与分析
2.1 芫荽籽精油成分分析
水蒸气法提取的芫荽籽精油呈浅黄色,具有浓郁的香味,经GC-MS分析得总离子流色谱图,经解析鉴定,共检出77个峰,鉴定出18种有效组分,占精油总量的97.84%,芫荽籽精油化学成分分析结果见表1。
从表1可以看出,芫荽籽精油中包含了烯萜类、醇、醛、酯等化合物成分,其中含量最高的是芳樟醇,为83.43%;其次有乙酸橙花酯,为3.21%;萜品烯,为2.85%;α-蒎烯,为 2.53%;樟脑,为1.33%;橙花醇,为1.11%;以上组分共占精油总含量的94.46%,可以判断是芫荽籽独特香味的主要成分。芫荽籽精油中的主要成分是芳樟醇,含量占比最高,是天然芳樟醇的重要来源,因而芳樟醇的含量成为衡量芫荽籽品质的指标之一。李伟等研究了黑龙江省产芫荽籽中芳樟醇含量为73.61%[6]。李丛民等研究了湖北省来凤县产芫荽籽中芳樟醇含量为56.82%[7]。李锋等研究了新疆维吾尔自治区产芫荽籽中芳樟醇含量为77.00%[8]。任安祥等比较研究了不同国家产地芫荽籽精油的芳樟醇含量,发现样品中泰国产芫荽籽的芳樟醇含量约为78.96%~82.97%,澳大利亚产芳樟醇含量约为76.63%~93.50%,国产2种芫荽籽芳樟醇含量为 84.44%、90.49%[9]。由此可见,不同产地的芫荽籽中芳樟醇含量具有明显差异,采自南京市高淳地区的芫荽籽与上述研究中芫荽籽相比较芳樟醇含量较高,属于较优品质。
2.2 芫荽籽精油对秀丽线虫的影响
2.2.1 线虫存活率和寿命试验 从前期试验结果可知,不高于1%浓度的DMSO对线虫不具有生物学影响,因而试验以DMSO作为精油助溶剂。从表2可以看出,芫荽籽精油对线虫的存活有显著影响,在试验浓度范围内,浓度大于等于0.6%时,线虫的存活率为0,浓度低于 0.6% 时,线虫的存活率会随着浓度的降低而增大,当精油浓度为0时线虫的存活率为100%,由此可见,芫荽籽精油对线虫的生存状态有抑制作用。因此寿命、后代数量和运动行为能力试验选择的精油浓度为0.5%,ROS试验选择精油浓度为0.6%,以0浓度为空白对照组,以此来研究芫荽籽精油对秀丽隐桿线虫寿命及运动的影响。
从图1可以看出,空白对照组及精油处理组的线虫寿命变化的趋势,对照组线虫的平均寿命为(10.72±0.33) d,精油处理组平均寿命为(9.29±0.41) d。与对照组相比,精油处理后的线虫寿命明显缩短,平均寿命低于对照组,处理间差异显著,说明芫荽籽精油影响线虫寿命,出现寿命缩短的现象。
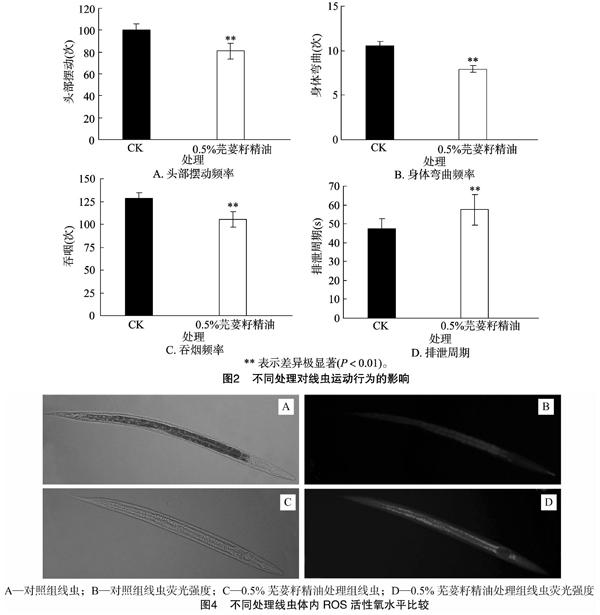
2.2.2 线虫运动行为能力试验 线虫的运动行为反映了它的生活状态,头部摆动频率、身体弯曲频率、吞咽频率、排泄周期是线虫主要的4种运动行为。从图2可以看出,与对照组线虫相比,芫荽籽精油处理后的线虫的头部摆动、身体弯曲、
吞咽频率都极显著下降(图2-A、图2-B、图2-C),排泄周期明显增长(图2-D),处理间差异极显著。结果表明,芫荽籽精油会对线虫的运动行为能力产生抑制,使其低于正常线虫的能力水平。
2.2.3 线虫后代数目试验 线虫后代数目反映了线虫的繁殖能力,测定后代数目可以评价芫荽籽精油对线虫繁殖能力的影响。从图3可以看出,对照组线虫产的后代数量平均值为(197±51)个,经0.5%浓度精油处理后的线虫产的后代数量的平均值为(161±49)个,显著低于对照组。由此可知,芫荽籽精油会影响线虫的繁殖能力,表现出减少线虫后代数目的作用。
2.3.4 线虫体内ROS变化 生物体正常代谢会产生一定浓度水平的活性氧,但高于正常水平的活性氧在体内会对生物大分子造成氧化损伤,包括对核酸、蛋白质以及生物膜造成氧化损伤,进而影响生命活动,因而自由基可以反映出机体损伤程度。从图4可以看出,ROS经荧光探针标记后,通过荧光显微镜观察发现芫荽籽精油处理后的线虫体内的ROS荧光强度明显高于对照组线虫,处理间差异显著。说明精油处理导致线虫体内积累的ROS浓度升高。
3 讨论与结论
芫荽籽精油是一种富含芳樟醇的天然植物精油,具有独特的芳香气味。据报道,芳樟醇是一种重要的香精香料和工业生产的中间体,芫荽籽是其天然来源之一[10],因而芳樟醇含量的高低是衡量芫荽籽精油品质好坏的指标之一,不同地区芫荽籽精油中芳樟醇含量具有差異性。本试验所用芫荽籽采自南京市高淳地区,采用水蒸气法获得精油,经试验发现,该芫荽籽精油共鉴定出18种有效组分,成分含量最高的是芳樟醇,占精油总成分的83.43%,与黑龙江省产的73.61%、湖北省来凤县产的56.82%、新疆维吾尔自治区产的77.00%芫荽籽中芳樟醇含量相比,芳樟醇成分占比更高,品质更好,所得芫荽籽精油成分还包括乙酸橙花酯为3.21%、萜品烯为2.85%、2-蒎烯为 2.53%、樟脑为1.33%、橙花醇为1.11%等萜类物质,与已有报道中的鉴定成分大致相符[9,11],但组分和含量存在差异,这些差异可能是由于不同品种遗传上的差异,也可能是产地的种植环境不同造成的。
本试验还研究了芫荽籽精油对秀丽隐杆线虫的影响,结果发现,芫荽籽精油对线虫的生命活动具有抑制作用,对线虫存活率影响的IC50值介于0.4%~0.5%(体积比)之间。与对照组相比,芫荽籽精油对线虫生命活动会造成明显抑制作用,出现寿命缩短、后代数目降低、运动行为能力降低的现象,同时对线虫体内ROS水平进行检测发现处理组线虫体内ROS水平明显高于对照组,表明芫荽籽精油会诱导线虫体内产生过量的ROS,可对线虫产生氧化损伤。秀丽隐杆线虫的神经系统由302个神经元组成,调控着线虫的各项生命活动,其中感觉神经元与线虫的行为、发育和寿命有关,运动神经元支配着线虫的肌肉活动,从而控制运动行为,包括头部摆动、身体弯曲前进等[12-13]。许云等发现线虫体内VD和AVL这2种运动神经元的缺失会造成线虫的身体弯曲频率降低并且抑制排泄行为[14]。Alcedo等研究发现,味觉神经元和嗅觉神经元影响着线虫寿命,其中除了部分味觉神经元会抑制线虫长寿,其他感受神经元均与促进线虫寿命延长有关[15]。线虫生理机能的协调运作还与其体内的ILP基因家族的作用密不可分,其感受神经元就是由ILP基因表达的,这些ILP基因还可以作为DAF-2胰岛素样受体的配体并调控下游信号级联放大,从而调控线虫的生理机能[16-17]。胰岛素信号通路是线虫体内一条重要的信号通路,参与调节线虫的寿命以及体内的氧化应激,主要是通过信号通路上的激素与激酶水平的上调或下调来启动一系列细胞保护机制从而达到延长线虫寿命的效果[18-19]。
本试验采自南京市高淳地区的芫荽籽所制芫荽籽精油品质较好,芳樟醇含量较高。同时本试验首次研究了芫荽籽精油对秀丽隐杆线虫的生物影响,结果表明,芫荽籽精油对秀丽隐杆线虫的生命活动表现出一定的抑制作用,主要表现为对寿命、子代产出和运动行为有抑制作用,同时还会引起线虫体内活性氧积累水平升高,由此可推测芫荽籽精油对线虫造成了氧化损伤,但具体作用机制尚不明确,根据已有文献推测这可能与芫荽籽精油导致线虫的神经系统受损、胰岛素信号通路变化有关,相关机制有待进一步试验验证。芫荽籽精油在众多领域有着广泛应用,多方位探究了解其生物活性对于更加合理利用开发芫荽籽精油有着重要意义,本研究结果可为芫荽籽精油对线虫的抑制作用以及诱发的保护机制提供相关基础,以期对芫荽籽精油生物活性作进一步了解。
参考文献:
[1]Begnami A F,Duarte M,Furletti V,et al. Antimicrobial potential of Coriandrum sativum L. against different Candida species in vitro[J]. Food Chemistry,2010,118(1):74-77.
[2]戴国彪,姜子涛,李 荣. 天然调味香料芫荽籽精油的研究进展[J]. 中国调味品,2009,34(1):32-35.
[3]Attanachaikunsopon R,Phumkhachorn P. Potential of coriander(Coriandrum sativum)oil as a natural antimicrobial compound in controlling Campylobacter jejuniin raw meat[J]. Bioscience Biotechnology and Biochemistry,2014,74(1):31-35.
[4]Ewbank J J,Zugasti O C. Elegans:model host and tool for antimicrobial drug discovery[J]. Disease Models & Mechanisms,2011,4(3):300-304.
[5]Leung M C,Williams P L,Benedetto A,et al. Caenorhabditis elegans:an emerging model in biomedical and environmental toxicology[J]. Toxicological Sciences,2008,106(1):5-28.
[6]李 伟,封 丹,陆占国. 黑龙江产芫荽籽精油成分及其抗菌活性[J]. 中国调味品,2008(1):42-45.
[7]李丛民,尚 军,任云辉,等. 来凤芫荽子油化学成分分析[J]. 香料香精化妆品,2001(6):1-2.
[8]李 锋,解成喜,范维刚,等. 气相色谱-质谱法分析芫荽籽挥发油化学成分[J]. 质谱学报,2005,26(2):105-107.
[9]任安祥,何金明,肖艳辉,等. 不同品种芫荽籽的精油含量与成分分析[J]. 时珍国医国药,2006,17(10):1867-1868.
[10]姜冬梅,朱 源,余江南,等. 芳樟醇藥理作用及制剂研究进展[J]. 中国中药杂志,2015,40(18):3530-3533.
[11]高玉国,李铁纯,侯冬岩. 芫荽籽中挥发性成分的GC/MS分析[J]. 粮食与食品工业,2003(4):59-61.
[12]Shen Y,Wen Q,Samuel A D,et al. An extrasynaptic GABAergic signal modulates a pattern of forward movement in Caenorhabditis elegans[J]. Elife,2016,5:e14197.
[13]Allen E N,Ren J,Zhang Y,et al. Sensory systems:their impact on C. elegans survival[J]. Neuroscience,2015,296:15-25.
[14]许 云,阮秦莉,纪蕾蕾,等. 芫花素对模式生物秀丽隐杆线虫的毒性作用[J]. 中国药理学与毒理学杂志,2017,31(5):414-421.
[15]Alcedo J,Kenyon C. Regulation of C.elegans longevity by specific gustatory and olfactory neurons[J]. Neuron,2004,41(1):45-55.
[16]Cornils A,Gloeck M,Chen Z A,et al. Specific insulin-like peptides encode sensory information to regulate distinct developmental processes[J]. Development,2011,138(6):1183-1193.
[17]Chen Z A,Hendricks M,Cornils A,et al. Two insulin-like peptides antagonistically regulate aversive olfactory learning in C. elegans[J]. Neuron,2013,77(3):572-585.
[18]Sakashita T,Takanami T,Yanase S,et al. Radiation biology of Caenorhabditis elegans:germ cell response,aging and behavior[J]. Journal of Radiation Research,2010,51(2):107-121.
[19]Kenyon C. The first long-lived mutants:discovery of the insulin/IGF-1 pathway for ageing[J]. Philosophical Transactions of the Royal Society B-biological Sciences,2011,366(1561):9-16.

