胸椎黄韧带骨化症的临床特点及手术治疗
吴德鹏 裴磊 袁伟 朱悦
(中国医科大学附属第一医院骨科,沈阳110001)
胸椎黄韧带骨化症(thoracic ossification of ligamentum flavum,TOLF)是指由于各种原因导致黄韧带增生、肥厚和骨化,引起胸椎管狭窄并产生脊髓压迫相应症状的脊柱疾病[1]。对于TOLF尚无有效的保守治疗方法,而手术治疗是被广泛认可的最佳治疗方案[2],手术方式以椎管后壁切除减压为主,常用的术式有:整块椎板切除术、分层椎板切除术、椎板成形术等[3],其中揭盖法整块椎管后壁切除法在临床上应用较广。但在长期实践中,部分病例存在椎板掀起困难,出现术中硬膜损伤、术后脑脊液漏等并发症[4],这些并发症往往是由于TOLF合并硬脊膜骨化(dural ossification,DO)导致的[5]。我科于2009年11月至2016年6月,针对术前评估黄韧带骨化较重、可疑合并DO的TOLF患者采用分层薄化法胸椎后壁切除术,其他TOLF患者采用揭盖法治疗,疗效满意。
1 资料与方法
1.1 一般资料
2009年11 月至2016年6月,于我院诊断为胸椎黄韧带骨化症并接受分层薄化法或揭盖法胸椎后壁切除术治疗的患者48例,男23例,女25例;年龄34~69岁,平均52岁。术前症状持续时间0.5~240个月,平均34.1个月。单节段发病15例(31.3%),双节段发病9例(18.8%),三节段发病8例(16.7%),四节段以上发病16例(33.3%),其中跳跃式节段发病12例(25.0%)。48例TOLF患者累及胸椎共138个节段,平均2.9个节段,主要分布于T10~T11(32个节段,23.18%)、T9~T10(25个节段,18.12%)、T11~T12(18个节段,13.04%),见图1。术前或术中发现合并硬脊膜骨化10例(20.8%)。
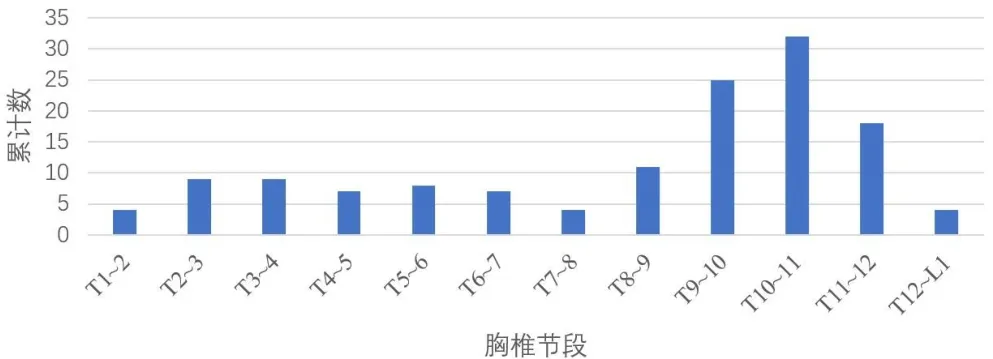
图1 病变累及各胸椎节段的分布
1.2 主要临床症状、体征和影像学表现
48例患者症状多呈缓慢进行性加重,其中下肢麻木无力、行走困难46例(95.8%),腰背部疼痛23例(47.9%),胸部束带感19例(39.6%),下肢疼痛21例(43.8%),小便功能障碍28例(58.3%)。查体方面,存在感觉平面21例(43.8%),下肢肌张力增高、腱反射亢进30例(62.5%),Banbinski征阳性44例(91.7%)。所有病例均完善X线,并进行三维CT(3D-CT)、MRI扫描检查确诊。典型影像学见图2。
1.3 手术方法
术前根据症状体征,结合影像学结果,确定黄韧带骨化部位及椎板减压范围。患者全身麻醉成功后,取俯卧位,常规消毒铺单;后正中切口,暴露棘突椎板至双侧小关节,通过椎弓根置针、C型臂透视定位,确认手术节段。对于常规“揭盖法”椎管后壁切除,以高速磨钻在双侧椎板小关节内侧缘纵行开槽,磨透椎板全板及黄韧带骨化灶,暴露硬脊膜囊外侧,切断上下棘间韧带和黄韧带,用齿钳夹住棘突上提,用神经剥离器分离骨化黄韧带与硬脊膜粘连,必要时尖刀锐性分离,最终将椎板、黄韧带整块切除;对于分层薄化法椎管后壁切除,先以高速磨钻在双侧椎板小关节内侧缘纵行开槽,磨除椎板外侧大部分,切断上下棘间韧带和黄韧带,继而用咬骨钳咬除棘突及椎板中部外层,最后用高速磨钻于中间椎板扫描式打磨,打薄骨化病变组织,在考虑保证脊髓安全的前提下,以硬膜囊膨胀良好为止,模式图见图3。对于边缘残留骨化灶或椎板,使用合适大小的椎板钳切除,减压结束。无论何种减压方法,尽量避免椎板钳直接进入椎管内操作。一般不行内固定,对个别手术切除范围达三个节段或以上病例,根据患者脊柱稳定情况考虑是否行椎弓根钉棒内固定。所有病例均未行后外侧植骨融合。
对于合并硬脊膜骨化者,根据硬脊膜膨起情况决定是否予以尖刀锐性分离或切除。对于硬脊膜撕裂(dural tear,DT)者,首先考虑采取细丝线间断缝合,对于不能缝合或硬脊膜缺损者,覆盖以生物防粘连膜及游离脂肪垫,并增加缝合密度逐层严密缝合,留置引流管。

图2 患者,女,43岁,胸椎黄韧带骨化症
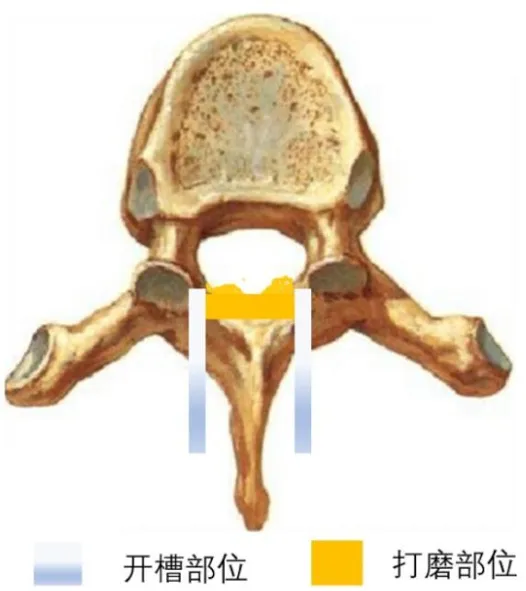
图3 磨钻开槽打磨示意图
典型术中所见,见图4。
1.4 疗效评估
术前及末次随访采用疼痛视觉模拟评分(Visual Analogue Score,VAS)、改良日本骨科协会评分系统(modified Japanese Orthopedic Association,mJOA)评价患者的神经功能[6],包括下肢运动功能0~4分,下肢感觉功能0~2分,躯干感觉功能0~2分及膀胱括约肌功能0~3分,共11分。计算神经功能改善率根据Hirabayashi法[7]:改善率=(术后评分-术前评分)/(11-术前评分)×100%。疗效根据改善率分4级:改善率≥75%为优;50%≤改善率<75%为良;25%≤改善率<50%为一般;改善率<25%为无改变。
1.5 统计学分析
应用SPSS 20.0统计软件进行统计学分析,所有结果均以均数±标准差形式表示,采用配对t检验分析术前和末次随访VAS、mJOA评分,以P<0.05差异有统计学意义。
2 结果
全部48例患者均顺利完成手术减压,随访时间为6~87个月,平均34.8个月,均无神经症状加重且末次随访前未进行再次手术治疗。
末次随访时腰背部及下肢VAS评分均显著降低,mJOA评分显著增加;与术前相比,差异均有统计学意义(P<0.01,表1)。手术疗效:优15例(31.5%),良16例(33.3%),一般13例(27.1%),无改善4例。
48例患者中,术中硬脊膜撕裂10例(20.8%)。首先采取细丝线间断缝合,对于不能缝合或硬脊膜缺损者,覆盖以生物防粘连膜及游离脂肪垫,并增加缝合密度逐层严密缝合。合并硬脊膜骨化的10例患者中出现术中硬脊膜撕裂7例(70%),术后脑脊液漏(cerebrospinal fluid leakage,CSFL)4例(40%),采用制动、头低足高位等综合保守治疗。所有患者伤口愈合良好,未出现感染表现。此外,末次随访未见明显手术节段后凸畸形。
1例患者术后两年由于邻椎出现黄韧带骨化加重再次手术,术后恢复良好。
3 讨论
3.1 胸椎黄韧带骨化症临床特点
TOLF是引起胸椎管狭窄(thoracic spinal stenosis,TSS)最常见的原因,占TSS发患者群61%[8],好发生于老年人,Lang等[9]回顾分析993例TOLF患者,平均年龄为60岁,其中50~59岁占79.2%,Schulte等[10]研究指出TOLF常常合并其他韧带骨化、椎间关节增生肥大、椎体增生或骨桥形成等慢性退行性改变,Jayakumar等[11]进一步研究,发现骨化黄韧带的病理符合典型的慢性退行性改变,内部弹力纤维明显减少,胶原纤维大量增生。本研究发现发病平均年龄为52岁,个别患者合并其他退行性病变,退变因素可能在TOLF的发展起到一定作用。此外,受累的胸椎主要分布在下位胸椎,依次为T10~11、T9~10、T11~12,分别占32例(23.19%),25例(18.12%)和18例(13.04%),位于胸腰交接处,此外,跳跃式发病病例中占25%并不少见,但其中以下位胸椎位为责任病灶的占91.67%,这些部位脊柱屈伸负荷和旋转应力最大,局部应力增加引起黄韧带骨化[12]。
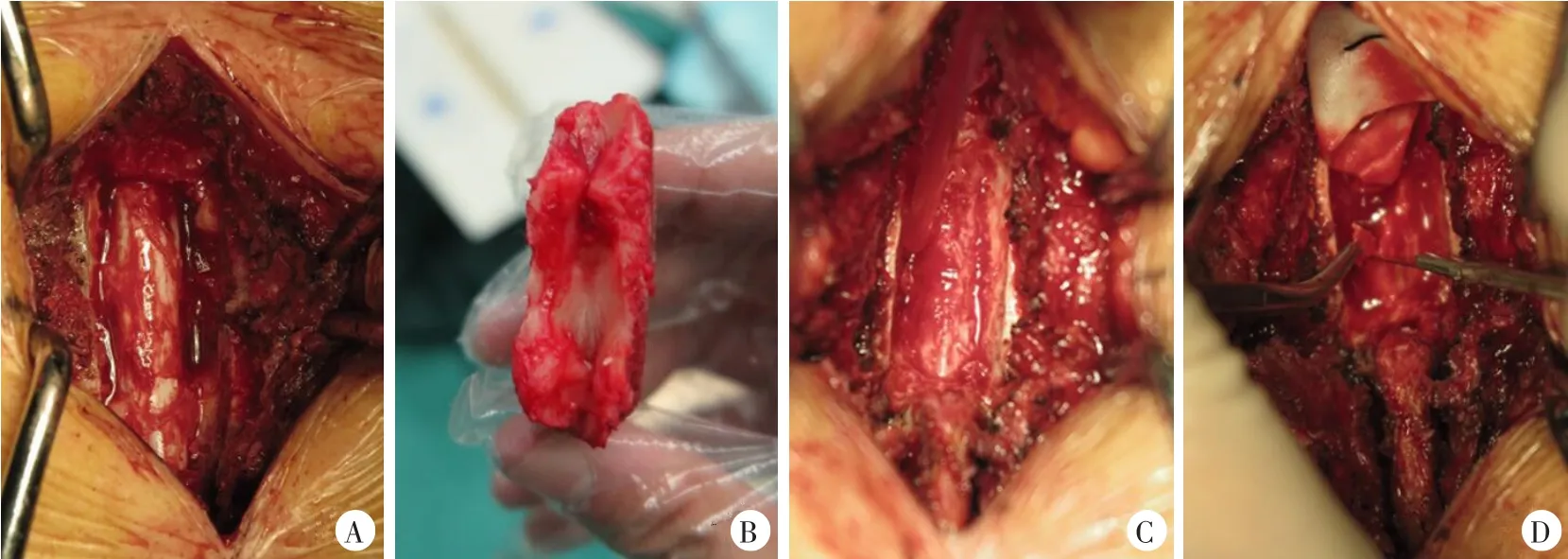
图4 典型术中图片
表1 术前、末次随访评分比较(±s)

表1 术前、末次随访评分比较(±s)
评分项目腰背部VAS评分下肢VAS评分mJOA评分术前评分2.31±2.67 1.75±2.25 6.33±1.89末次随访评分0.71±1.07 0.56±0.89 9.15±1.18 P值<0.001<0.001<0.001
TOLF发病比较隐匿,大部分患者(95.83%)以下肢麻木无力、行走困难为主要症状入院,常伴有小便功能障碍(58.33%)、下肢肌张力及腱反射亢进(62.50%)、Banbinski征(+)(91.67%)等,在本研究中发生率均超过50%。本研究发现TOLF常以短节段为主(≤3个节段),占所有TOLF患者69%,而平均受累节段为2.9节,手术平均切除节段为1.25,获得满意疗效,说明不是所有骨化黄韧带均引起症状,所以寻找责任节段尤为重要。虽然出现感觉平面(43.75%)相对较少,但作为一种重要定位体征,常常结合3DCT、MRI对明确责任病灶有重要意义,所以仔细查体在该类患者中非常重要。
3.2 TOLF 合并硬脊膜骨化(DO)
TOLF治疗过程中,硬膜损伤、脑脊液漏等并发症并不少见,Muthukumar[5]等提出这些并发症往往由于TOLF合并DO导致的,术前DO诊断主要依据影像学,其中3D-CT最为重要,术前通过“轨道征”、“逗点征”诊断DO准确率高,Li等[13]进一步研究发现,结合上述两种特征性影像学表现,排除以下4种假TSS表现:①小关节平面的假TSS征;②骨化黄韧带和上关节突平面的假TSS征;③骨化黄韧带和椎板平面的假TSS征;④上关节突内外侧骨皮质的假TSS征,能有效提高TOLF合并DO的准确率,主要从静态的角度排除假TSS征。本团队通过IMPAX软件分析胸椎3DCT结果,配合矢状位胸椎CT成像,动态连续地观察横截面胸椎CT改变,对寻找特征性影像学表现及排除假TSS征能获得同样的效果。在Sun等[12]研究中,TOLF合并DO发生率高达39%,与本研究合并DO发生率20.8%存在差异,考虑由于样本量少及地区差异等原因导致。此外,有报道[14]指出,合并DO的病例中发生DT、CSFL的发生率可高达93%,本研究中,合并DO患者接受手术减压治疗发生DT和CSFL分别为70%、40%。此外,本研究团队发现合并DO的TOLF患者,骨化黄韧带的外侧部常增厚明显,但仍需要更多病例数据进行统计分析。总体来说,TOLF合并DO并不少见,对于这类病例,在治疗过程中并发症发生率往往较高,以术中硬脊膜撕裂、术后脑脊液漏为主,从而增加住院时间,应予以重视。
3.3 手术处理技巧
胸椎区别于颈椎和腰椎,其椎板和棘突由上而下彼此重叠,呈叠瓦状排列,一定程度上对定位造成干扰,术前单纯利用体表标志物进行C臂定位无法精准指出责任病灶,因此导致的错误定位并不少见。而上下椎弓根之间彼此独立,不存在重叠,是良好的定位标志,我们建议尤其对于跳跃式多发病灶的病例术前结合影像学病灶压迫情况、脊髓信号改变及感觉平面的位置确定责任节段,而术中在暴露棘突椎板至双侧小关节后,先通过椎弓根置针、C臂透视再次明确病灶术中位置,然后再进行减压。本研究所有患者通过本方法定位未出现错误定位,能达到精准定位病灶术中位置。对于跳跃式多发病灶,原则上只处理责任病灶,对于邻近上下节段压迫较重以后可能加重引起症状,可考虑一并切除。本研究中的12例跳跃多节段一般以上位胸椎和下位胸椎发病,虽影像学上可诊断为跳跃多节段发病,但主要引起症状的节段分布在下位胸椎,而手术部位主要在下位胸椎。我们主要考虑要达到手术效果同时减少手术对患者的创伤。在切除责任节段时,如果邻近节段影像上压迫较重,也会予以切除,而对于其他尚未引起症状的节段采保守态度。
近年来国内外学者越来越重视小关节在脊柱稳定性上起的作用,Aizawa[15]和Hirabayashi[16]等认为小关节大半部分影响着脊柱稳定性,而Yu[17]提出小关节对维持脊柱弯曲、旋转时的稳定起重要作用,在切除任何脊椎小关节超过50%会引起明显的脊柱失稳,本研究采用双侧小关节内侧缘纵行开槽,尽可能保留了更多小关节成分,维持脊柱的稳定性;传统揭盖法减压常常从双侧小关节中1/2开槽,实践中常常出现开槽过深、揭盖困难等问题,本研究发现通过小关节内侧开槽,大部分患者均可通过揭盖法轻松掀开椎板;此外,引起症状的骨化黄韧带始发于上位椎板下部前方,压迫脊髓的侧后方,对于大部分骨化黄韧带外侧增厚不明显的病例,从小关节内侧开槽揭盖和后续使用开口角度大头宽小于2 mm的椎板钳修理残余椎板和黄韧带,均能达到彻底减压。
对于少数骨化黄韧带外侧增厚明显的患者,小关节内侧开槽往往不能磨透全层椎板及骨化黄韧带,采用分层薄化法切除椎板,虽然利用高速磨钻直接在病变黄韧带上操作,使周边组织产生震荡、热能,从而可能对脊髓造成干扰,但术者仔细使用磨钻配合生理盐水冲洗可降低其干扰,实践证明并无神经学加重且手术效果令人满意。Sun等[18]对这类合并DO患者采取类似的减压方式,指出手术难度一定程度上增加,但是并不影响术后神经功能恢复。本研究认为无论何种减压方法,必须强调尽量避免椎板钳直接进入椎管内操作,是有效预防医源性神经损害的措施。值得一提的是近年来超声刀在脊柱外科中得到迅速发展,较传统高速磨钻和咬骨钳具有出血少、手柄所需握持力低、对软组织干扰少等优势,尤其是“冷切割”模式使在硬膜附近操作更安全,是一种比较理想的脊柱减压的工具[19,20]。
综上,胸椎黄韧带骨化症以短节段(≤3个节段)受累为主,通过感觉平面等定位体征结合影像学明确责任病灶尤为重要。胸椎黄韧带骨化症合并硬脊膜骨化并不少见,手术治疗并发症发生率高,术前应仔细阅读影像学,术中精细操作。椎板切除减压过程中,小关节内侧开槽效果良好,对脊柱稳定性影响小。合理使用高速磨钻和椎板钳等工具以及细致操作是避免神经学加重的关键。
[1]Aizawa T,Sato T,Sasaki H,et al.Thoracic myelopathy caused by ossification of the ligamentum flavum:clinical features and surgical results in the Japanese population.J Neurosurg Spine,2006,5(6):514-519.
[2]Inamasu J,Guiot BH.A review of factors predictive of surgical outcome for ossification of the ligamentum flavum of the thoracic spine.J Neurosurg Spine,2006,5(2):133-139.
[3]Ahn DK,Lee S,Moon SH,et al.Ossification of the ligamentum flavum.Asian Spine J,2014,8(1):89-96.
[4]刘健,彭小龙,周初松.改良“揭盖式”椎管后壁切除术治疗胸椎黄韧带骨化症.中国骨与关节损伤杂志,2013,28(1):16-18.
[5]Muthukumar N.Dural ossification in ossification of the ligamentum flavum:a preliminary report.Spine(Phila Pa 1976),2009,34(24):2654-2661.
[6]Li M,Meng H,Du J,et al.Management of thoracic myelopathy caused by ossification of the posterior longitudinal ligament combined with ossification of the ligamentum flavum-a retrospective study.Spine J,2012,12(12):1093-1102.
[7]Hirabayashi K,Miyakawa J,Satomi K,et al.Operative results and postoperative progression of ossification among patients with ossification of cervical posterior longitudinal ligament.Spine(Phila Pa 1976),1981,6(4):354-364.
[8]Takenaka S,Kaito T,Hosono N,et al.Neurological manifestations of thoracic myelopathy.Arch Orthop Trauma Surg,2014,134(7):903-912.
[9]Lang N,Yuan HS,Wang HL,et al.Epidemiological survey of ossification of the ligamentum flavum in thoracic spine:CT imaging observation of 993 cases.Eur Spine J,2013,22(4):857-862.
[10]Schulte TL,Heidenreich JO,Schilling AM,et al.Comparison of metric analysis of spinal structures,exemplarily of the ligamentum flavum,obtained with CT and MRI.Eur J Radiol,2004,52(3):224-228.
[11]Jayakumar PN,Devi BI,Bhat DI,et al.Thoracic cord compression due to ossified hypertrophied ligamentum flavum.Neurol India,2002,50(3):286-289.
[12]Ben Hamouda K,Jemel H,Haouet S,et al.Thoracic myelopathy caused by ossification of the ligamentum flavum:a report of 18 cases.J Neurosurg,2003,99(2 Suppl):157-161.
[13]Li B,Qiu G,Guo S,et al.Dural ossification associated with ossification of ligamentum flavum in the thoracic spine:a retrospective analysis.BMJ Open,2016,6(12):e013887.
[14]Sun X,Sun C,Liu X,et al.The frequency and treatment of dural tears and cerebrospinal fluid leakage in 266 patients with thoracic myelopathy caused by ossification of the ligamentum flavum.Spine(Phila Pa 1976),2012,37(12):E702-E707.
[15]Aizawa T,Sato T,Ozawa H,et al.Sagittal alignment changes after thoracic laminectomy in adults.J Neurosurg Spine,2008,8(6):510-516.
[16]Hirabayashi H,Ebara S,Takahashi J,et al.Surgery for thoracic myelopathy caused by ossification of the ligamentum flavum.Surg Neurol,2008,69(2):114-116.
[17]Yu S,Wu D,Li F,et al.Surgical results and prognostic factors for thoracic myelopathy caused by ossification of ligamentum flavum:posterior surgery by laminectomy.Acta Neurochir(Wien),2013,155(7):1169-1177.
[18]Sun J,Zhang C,Ning G,et al.Surgical strategies for ossified ligamentum flavum associated with dural ossification in thoracic spinal stenosis.J Clin Neurosci,2014,21(12):2102-2106.
[19]潘显纬,张浩,王建喜,等.超声骨刀在治疗黄韧带骨化型胸椎管狭窄症中的应用.颈腰痛杂志,2017,38(2):101-105.
[20]李文菁,赵宇,孙志坚.超声骨刀在脊柱外科手术中的应用进展.中华外科杂志,2014,52(3):215-218.

