离子液体的制备及其在酶催化中的应用进展
王明启,杜仕国,闫 军,俞卫博,孟胜皓,李 晨
(陆军工程大学 石家庄校区弹药工程系, 石家庄 050003)
离子液体(Ionic liquids,ILs)是由有机阳离子和无机或有机阴离子组成的一种盐类化合物,且阴、阳离子数目相等,因而整体呈现电中性。组成ILs的阴、阳离子具有高度的不对称特性,不易密集堆积,难以结晶固化,因此,在室温条件下为液体状态,通常也被称为“室温离子液体”、“室温熔盐”[1]。相比于传统有机溶剂(如醛类、醇类、卤代烷烃等)的易挥发、易燃、易爆、低毒等性质,ILs的物理、化学性质均较为稳定,具有较强的溶解能力、良好的导电性能、较宽的液体范围(大约为-90 ℃~400 ℃),并以其非挥发性以及较强的催化活性等特点,让人们看到了替代传统有机溶剂的希望[2-4]。ILs不易挥发(蒸汽压近似为零),且易于回收循环再利用,故此,是一种理想的“绿色溶剂”[5-6]。
ILs的最早出现可追溯到1914年,Walden等制备的硝酸乙基胺([EtNH3][NO3]),其熔点为12 ℃,且极易爆炸,这一发现在当时并未受到足够的重视,很快就被人们遗忘。直至1992年,美国空军研究院Wilkes等[7]制备出了ILs 二烷基咪唑类四氟硼酸[Emim][BF4],之后,对于ILs的研究才开始迅速发展。近几年,随着绿色化学理念的深入人心,在国内外掀起了对ILs的研究热潮。特别是以ILs为介质的酶催化过程,酶分子表现出了比其在水和有机溶剂中更高的热稳定性、催化活性、绿色性,已成为酶催化领域的研究前沿课题。
1 分类
现阶段所研究的ILs,均由阴离子[B]-和阳离子[A]+组成,结构表示为[A]+[B]-,其分类可按阴、阳离子组成的不同进行划分。根据阳离子的不同,通常可将ILs分为吡啶盐、咪唑盐、季铵盐和季膦盐4类,如表1所示。

表1 根据阳离子的不同分类
其中以对烷基取代的咪唑类ILs的研究最早且研究最多。根据阴离子的不同,通常可将ILs分为卤化盐、非卤化盐2类,如表2所示。

表2 根据阴离子的不同分类
理论上,根据阴离子和阳离子的不同排列方式,ILs的种类可达1018种,可具有应用价值并被实际应用的却不多[8-10]。
2 制备方法
ILs制备方法分为传统制备法和辅助合成法,其中传统制备法包括一步合成法和两步合成法;辅助合成法包括超声波法、微波法及电化学法。
2.1 一步合成法
一步合成法即直接合成法,指通过季铵化反应或者酸碱中和反应一步合成目标产物。如EtNH2和HNO3的水溶液进行酸碱中和反应制备ILs [EtNH3][NO3]。反应式为:
此外,具有1,3-对称取代的咪唑类ILs也可以通过一步合成法制得。
该法具有操作简便,经济时效,无副产物,产品易纯化等特点。
2.2 两步合成法
第一步,卤代烷烃和含目标阳离子的化合物进行季铵化反应制得含目标阳离子的卤化物盐;第二步,用含目标阴离子的酸或盐和上述卤化物盐进行阴离子交换,得到目标产物。例如典型的烷基吡啶类ILs的制备(图1):
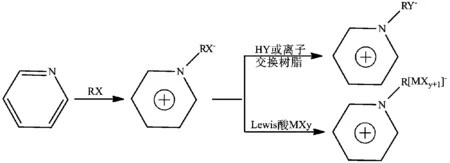
图1 两步合成法制备烷基吡啶类ILs
该法的优点是普适性好、收率高,缺点是伴随有其他副产物产生。四氟硼酸盐、六氟磷酸盐等ILs通常就是采用两步合成法制备。
2.3 辅助合成法
传统合成法常以加热的方式提高反应速率,即便如此,反应完成也需很长时间,而辅助技术的运用,可有效加速ILs的合成,产品的纯度和收率也较传统方法有所提高,且减少了制备过程中所需大量的有机试剂,符合绿色化学的理念。
2.3.1 超声辅助合成法
超声辅助合成法是通过搅拌作用和超声空化作用加快ILs合成的速率,对非均相催化反应效果更佳[11]。
Leveque等[12]利用超声辅助技术在常温条件下以30 kHz的微波辐射原料1h,制备了ILs 1-丁基-3-甲基咪唑六氟磷酸盐(图2)。结果表明:反应时间比传统方法短很多,且产率提高80%~90%。

图2 超声辅助合成1-丁基-3-甲基咪唑六氟磷酸盐
李学琴等[13]以N-甲基咪唑、2-氯乙醇为原料,利用超声波辅助技术合成了N-(2-羟乙基)-3-甲基咪唑四氟硼酸盐([C2OHmim])(图3)。相比较于传统加热法制备过程,合成反应时间由原来的24~48 h缩短至4 h,产率提高至57.69%。
该法的优点是能耗低,反应速率快,合成条件简单,可制备传统方法不易制备新型ILs[14]。
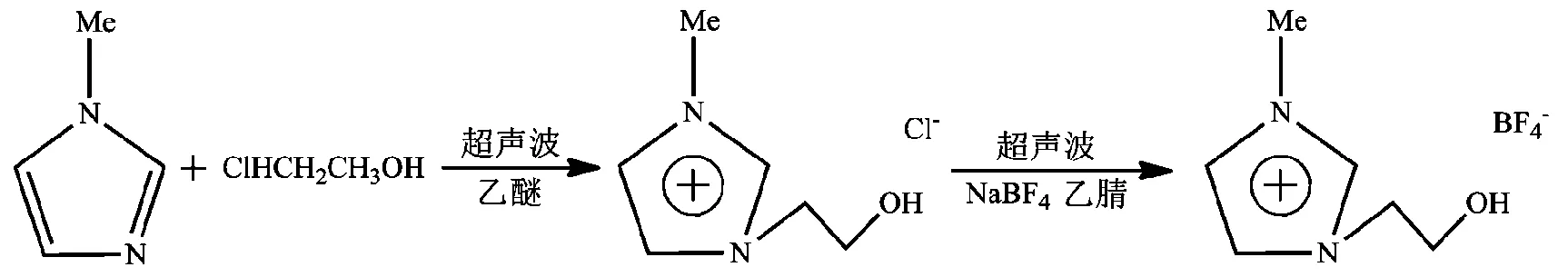
图3 超声辅助合成N-(2-羟乙基)-3-甲基咪唑四氟硼酸盐
2.3.2 微波辅助合成法
微波辅助合成法的原理是极性分子在快速变化的电磁环境里不断改变方向,使分子因摩擦而温度升高,同时无规则运动的分子可视为分子搅拌的作用,显著提高了目标ILs的产率[15]。
侯金松等[16]采用微波辐射技术,以N-甲基咪唑、正溴丁烷以及四氟硼酸铵作为原料,制备了ILs [Hmim][BF4](图4)。实验结果表明:采用微波技术不仅使反应时间大大减少,且将目标ILs的产率提高到97.2%。
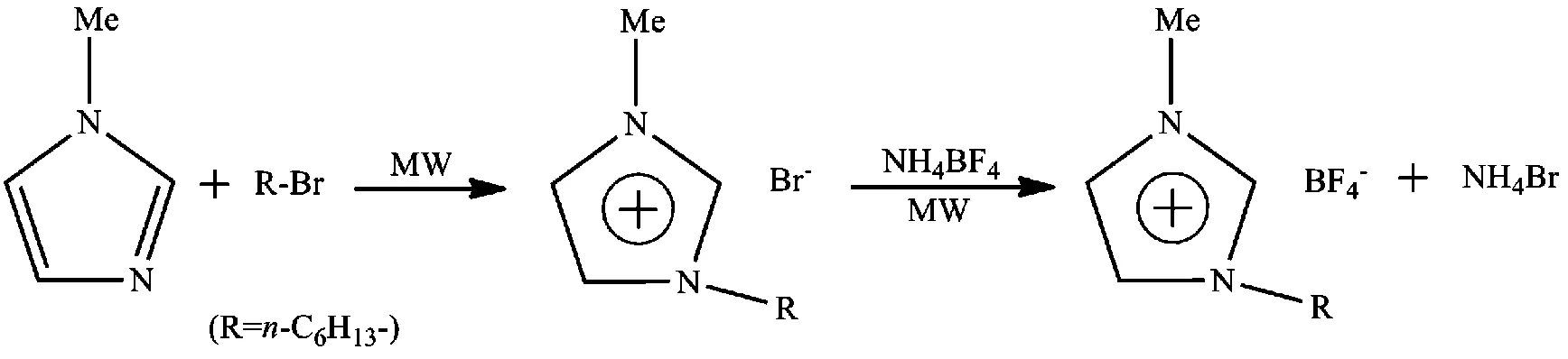
图4 微波辅助合成[Hmim][BF4]
陆丽新[17]使用Discover微波精密有机合成反应器,合成了ILs四氟硼酸1-丁基-3-甲基咪唑,并探究了反应功率、反应时间等因素对反应的影响(图5)。实验结果显示:采用微波技术不仅使反应时间大大减少,不及常规合成法的10%,且将目标ILs的产率提高30%以上。
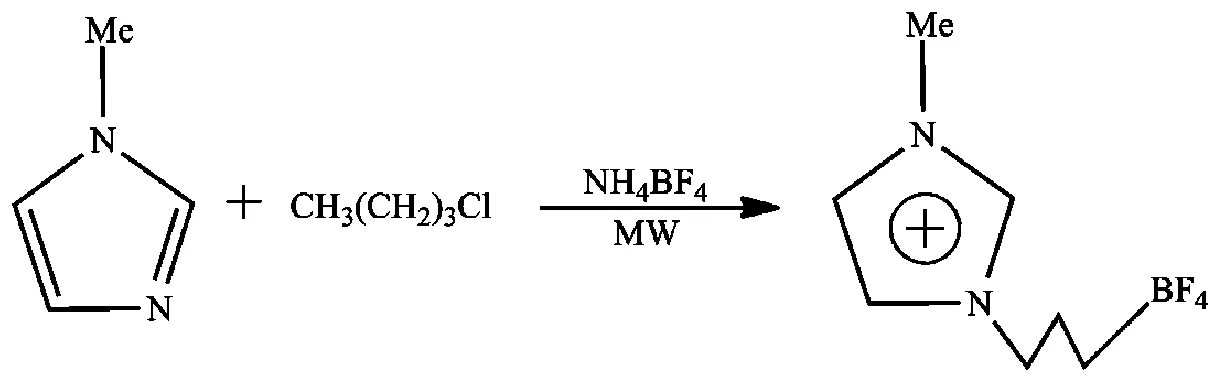
图5 微波辅助合成四氟硼酸1-丁基-3-甲基咪唑
该法的优点是所需有机溶剂少或不需要有机溶剂,反应速率快,产品产率高;缺点是微波反应器的价格比较昂贵,且微波在ILs合成过程中不易控制,伴随着副反应的发生易出现过热的现象,很难在工业上大规模运用[18]。
2.3.3 电化学辅助合成法
电化学辅助合成法的原理是选用含目标阳离子的盐类化合物(季铵盐、硫鎓盐或含氮杂环等),其阴离子经电解可转化成二氧化碳或氮气等;选用含目标阴离子的化合物(硝酸、醋酸等),其阳离子经电解可转化为氢气、氮气等。将电解生成的气体从电解池移出,剩余的阴离子和阳离子经电解池中的离子交换膜合成目标产品[19]。以ILs [Bmim][Ac]的合成为例(图6)。
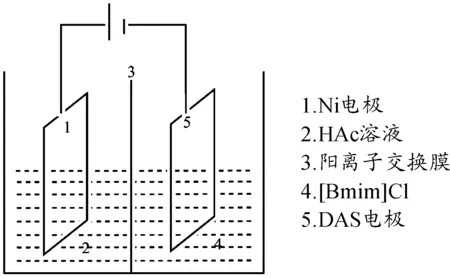
图6 电化学辅助合成[Bmim][Ac]
该法的优点是可制备不含卤素离子的ILs,且纯度很高,可达99.99%。但该法的缺点是操作和制备装置较复杂,目前,不适于大规模的工业合成。
3 ILs在生物酶催化领域中的应用
酶催化又名生物催化,是指利用生物催化剂将原料彻底转化成产物的过程。酶催化具有高效选择性、反应速度快、绿色环保、条件温和等优点。传统的有机溶剂通常限制了酶的催化活性和选择性,使反应体系受到了诸多限制[20]。而ILs的运用,不仅在很大程度上改善了上述现状,更为酶催化领域开辟了一条新的绿色的途径。根据相关数据显示,许多酶在ILs介质中不仅不会失活,而且选择性、催化活性、稳定性都有很大的提升[21-23]。除少数酶在ILs中活性下降甚至活性丧失,例如嗜热菌蛋白酶在[Bmim][PF6]中催化活性降低,甚至无催化活性[24]。近年来,随着人们对ILs中酶催化反应研究的不断深入,ILs已被广泛应用于蛋白酶、脂肪酶、纤维素酶、氧化还原酶等酶分子的催化过程,取得了很好的效果。
3.1 ILs中蛋白酶催化反应
蛋白酶作为最重要的工业酶制剂,可高效催化多肽和蛋白质的水解,与ILs的协同运用,使酶的催化活性得到有效提高。
第一个在ILs介质中实现生物酶催化转化的酶即是蛋白酶。2000年,Erbeldinger等[25]在ILs [Bmim][PF6](含5%H2O,体积分数)中以嗜热菌蛋白酶作催化剂,催化合成Z-天(门)冬氨酰苯丙氨酸甲酯(又名“阿斯巴甜”,APM),转化率为40%,产率高达95%,且ILs易与产物分离,可重复再利用(图7)。
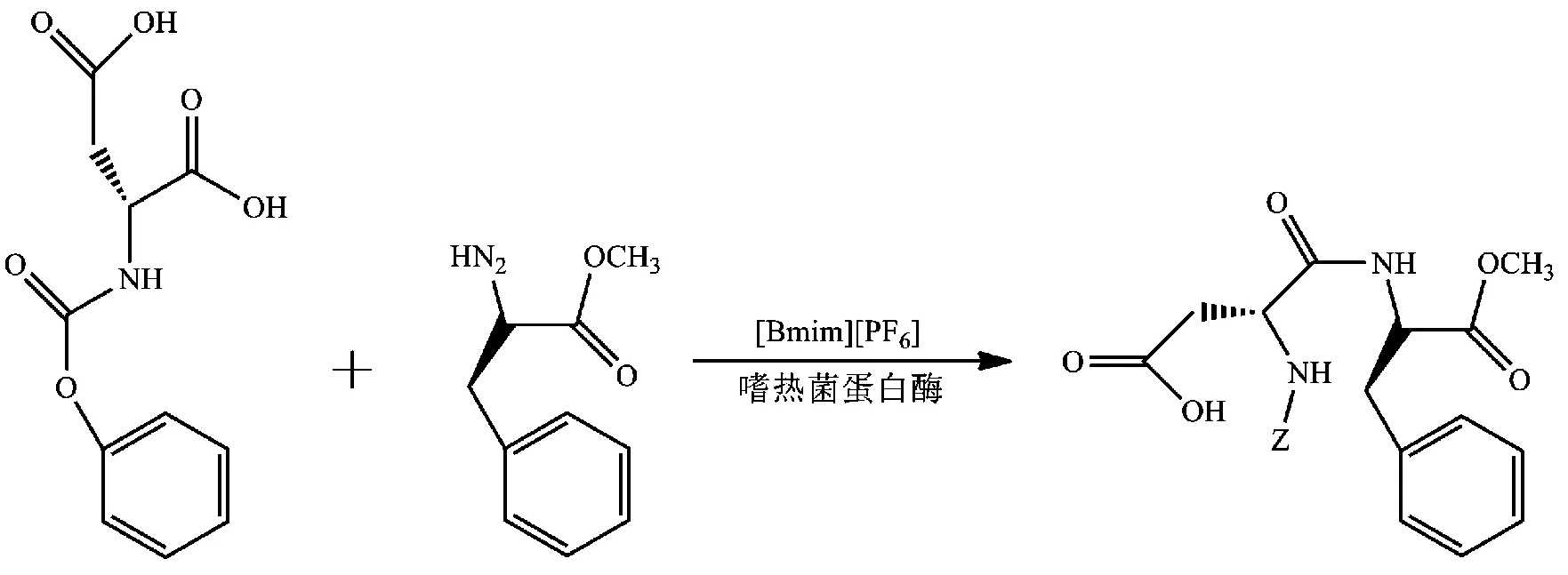
图7 嗜热菌蛋白酶在[Bmim][PF6]中催化合成APM
文献[25]被当作绿色溶剂与绿色生物合成相结合的标志,让人们看到了ILs在酶催化领域取代传统有机溶剂的希望[26]。自此,ILs中的酶催化反应得到了广泛的关注[27-30]。
Wehofsky等[31]指出,胰凝乳蛋白酶在ILs [Mmim][Me2PO4]和吗啉代丙烷磺酸(MOPS)双体系(体积比7∶3,此时催化效果最好)中,其与蛋白质亚基的连接产率比在单一MOPS体系中高42.3%,达到87.4%;在与上述相同的环境条件下,胰蛋白酶与蛋白质亚基的连接产率是在纯MOPS体系中的4.22倍,达到79.7%。
袁久刚等[32]使用ILs 1-丁基-3-甲基咪唑([Bmim][Cl])在100 ℃温度下处理羊毛10 min,再用蛋白酶催化羊毛。实验结果表明,羊毛经ILs处理后,蛋白酶对纤维的水解程度明显提高,使织物的表面自由能下降,润湿性能提高。
侯雪丹等[33]对木瓜蛋白酶(Papain)在ILs中催化N-苯甲酰-L-精氨酸乙酯水解的活性和热稳定性进行了研究,结果发现,在所选用的ILs中,大部分带有[PF6]-、[BF4]-的ILs对Papain的活性或热稳定性起促进作用,在ILs [Bmim][PF6]中Papain的水解活性最高,在ILs [HOEtmim][BF4]中,其热稳定性最好。
3.2 ILs中脂肪酶催化反应
脂肪酶(Lipase)又名甘油酯水解酶,三酰基甘油酰基水解酶,是指能将甘油三酯逐步水解成甘油和脂肪酸的一类酶[34-36]。截至目前,由于脂肪酶可在多种ILs中稳定存在,且能进行多种类型的催化反应,所以人们对脂肪酶在ILs体系中的运用与研究最多[37]。
早在2000年,Lau等[38]第一次证明了ILs可用于生物催化体系的可能性,他们利用脂肪酶(固定化酶Nov435、游离酶SP525)在ILs([Bmim][PF6]、[Bmim][BF4])中催化正丁醇与丁酸乙酯合成丁酸丁酯,反应时间4 h,产率近81%。
Lee等[39]探究了脂肪酶(Novozym435)在ILs [Bmim][TfO]/[Bmim][Tf2N]双体系(体积比1∶1)中催化月桂酸乙烯酯和葡萄糖的转化成酯的反应,产品葡萄糖酯的产率近69%,对反应后的脂肪酶进行回收再利用,脂肪酶的催化活性仍较高。
Kurata等[40]在ILs [Bmim][Tf2N]介质的存在下,利用脂肪酶催化苯乙醇与咖啡酸甲酯合成咖啡酸苯乙酯,结果发现,与在单独有机相中反应相比,反应速率大幅度提升,原料的转化率高达93.8%。
Li等[41]探究了烷基咪唑型ILs对脂肪酶催化水解反应活性的影响因素,实验结果表明,ILs中阳离子的烷基链长和阴离子的类型对酶活性的影响较大,在最适宜的环境条件下,ILs [C8mim][Br]对脂肪酶活性的促进作用最大,酶的相对活力最高可达1734%,该结果有利于人们更清楚的认识ILs的结构和酶活性之间的关系。
李明等[42]以脂肪酶CRL在ILs 1,3-二正辛基咪唑六氟磷酸盐([DnOIM][PF6])中催化丙酸酐和薄荷醇合成丙酸薄荷酯(图8)。结果表明:CRL在[DnOIM][PF6]中的催化活性很大提高,且稳定性是常用有机溶剂正己烷的4.3倍,CRL经回收循环利用7次后,其催化活性仍无明显下降。

图8 在[DnOIM][PF6]中CRL催化合成丙酸薄荷酯
苏二正等[43]研究了不同种ILs介质对木瓜脂肪酶(CPL)催化伯醇类萜烯醇(香叶醇和香茅醇)与乙酸乙烯酯合成萜烯醇芳香酯的实验影响。结果表明,CPL在具有阴离子[PF6]-的ILs中催化效果最佳,在所选[Omim][PF6]、[Hmim][PF6]、[Dmim][PF6]、[Bmim][PF6]介质中,底物的转化率均在95%以上;CPL在常用有机溶剂正己烷中循环使用4次后,其活性低于50%,而在ILs中循环使用15次后,CPL的催化活性仍在90%之上。
3.3 ILs中纤维素酶催化反应
纤维素是一种廉价的绿色材料,其世界产量每年近 2 200亿吨,在化石能源短缺的今天受到人们格外的重视,具有重要的研究意义[44]。纤维素的聚合度较高,且分子内和分子间皆存在大量的氢键,致使其在常规有机溶剂中的溶解度很低,寻找一种可高效溶解纤维素的绿色溶剂成为研究的热点[45]。
2002年,Swatloski[46]著文介绍纤维素可以稳定的溶解于ILs 1-丁基-3-甲基咪唑氯盐([Bmim][Cl])。自此,ILs的应用拓展到纤维素领域,并且逐步在生物质的转化与分离中得到运用,为生物质能源的开发和利用开拓了一条新的路径[47-49]。
Shen等[50]在ILs [Emim][Ac]/N-甲基吡咯烷酮两相体系中研究了纤维素酶和纤维二糖酶水解玉米秸秆中的纤维素,在140 ℃的油浴中进行催化反应,经过24 h,葡萄糖的产率高达60.8%。
范琳等[51]分别研究了ILs 1-乙基-3-甲基咪唑醋酸([Emim][Ac])、1-乙基-3-甲基咪唑磷酸二乙酯([Emim][DEP])对纤维素酶溶解微晶纤维素的影响。结果发现,在ACE超声化学反应系统的辅助下,[Emim][Ac]、[Emim][DEP]对溶解的促进作用效果明显,使纤维素的结晶度降到62.3%、53.6%;ILs的最佳投入量为0.5%,此时纤维素水解程度最大,纤维素酶的酶解率分别提高17.5%、11.4%,且使得纤维素酶体系中的β-葡萄糖苷酶催化活性分别提高了87%、120%。
朱长辉等[52]在ILs [Emim][Ac]/水(体积比4∶1)的双体系中,探讨了纤维素酶、纤维二糖酶协同作用对催化纤维素成糖的影响。发现两种酶协同作用下可有效提高纤维素还原成糖的产率,当反应72 h时,还原糖和葡萄糖的产率分别达86.5%、35.2%,且随着时间的增长两种糖的产量仍在持续增加。
耿秀娟等[53]讨论了利用ILs([Bmim][Cl])/碱溶液(NaOH)双体系预处理麦草秸秆对酶水解成糖的影响。将[Bmim][Cl]/NaOH双体系预处理风干麦草秸秆与单独NaOH预处理风干麦草秸秆进行对比研究,结果发现,前者预处理过的麦草秸秆的酶解率高达95.3%,比后者高24.6%,该实验结果为ILs处理工艺和碱处理工艺的结合运用提供了有价值的参考。
3.4 ILs中氧化还原酶催化反应
氧化还原酶在含ILs介质的酶催化反应中,主要用于合成手性化合物,该催化过程常需辅酶(价格昂贵)的参与,所以为了降低成本,常用完整的细胞进行催化反应。该酶的活性受ILs浓度的影响,一般情况下,随着ILs浓度的升高,酶的活性随之降低[54]。
2002年,Budde等[55]首次介绍了大豆过氧化酶、辣根过氧化酶等几种氧化酶在ILs介质中存在一定的催化活性。同年,Laszlo等[56]用微过氧化酶、血晶素过氧化物酶、细胞色素c过氧化物酶分别在ILs [Omim][PF6]、[Bmim][PF6]、[Bmim][(CF3SO2)2N]中催化邻甲氧基苯酚(以微过氧化酶为例,图9),与在常用有机溶剂二甲基亚砜、甲醇中的催化相比,三种酶的催化活性大大提高。该实验证实了氧化还原酶可在ILs中实现酶催化。
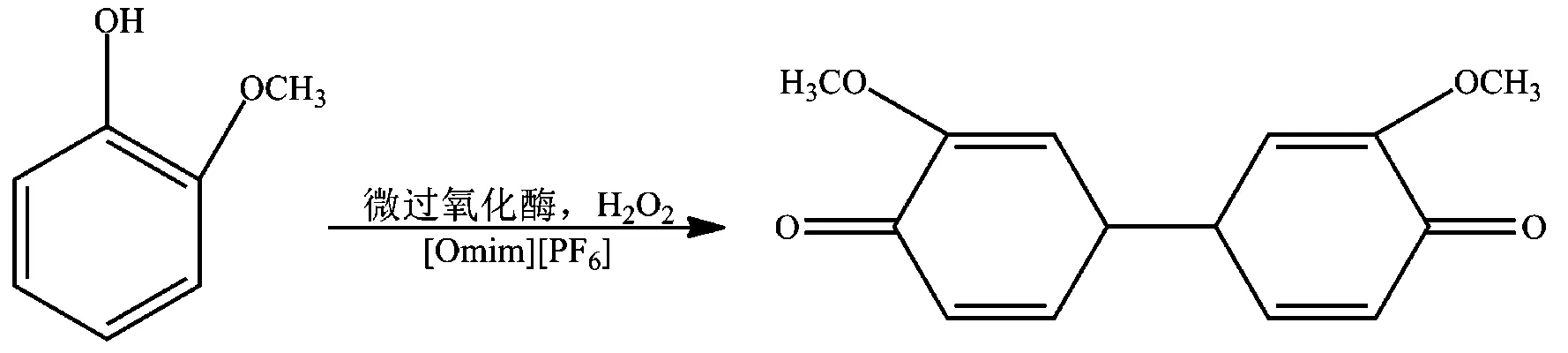
图9 在[Omim][PF6]中微过氧化酶催化邻甲氧基苯酚聚合
Eckstein等[57]介绍了在[Bmim][(CF3SO2)2N] /缓冲液双体系中利用脱氢还原酶催化2-辛酮的还原反应,发现酶在该双体系中的稳定性和催化速率明显高于有机溶剂(甲基叔丁基醚)/缓冲液双体系,且大幅地减少了副产物的产生,使转化率近100%。
刘洋洋等[58]研究了ILs [Bmim][Cl]对酿酒酵母的乙醛脱氢酶活性的影响,实验结果表明,[Bmim][Cl]的浓度在0.001~2.000 mg/mL之间,酶活性随[Bmim][Cl]浓度的增加而提高;当[Bmim][Cl]的浓度大于2.000 mg/mL时,酶活性受到抑制,且浓度越高,受抑制影响越严重。
Choi等[59]在ILs [Bmim][NTf2]/水两相体系中,研究了枯草杆菌葡萄糖脱氢酶、酵母还原酶(YOL151W)和透性化大肠杆菌细胞三者协同催化还原3-氯-1-苯基-1-丙酮,结果发现在ILs的存在下,基质的溶解度大大提高,且左旋型目标产物的产率在99%以上。
4 结论
虽然ILs以其结构可设计、极性可调等独特的性质,在酶催化领域的应用受到相关学者们的重点关注,取得了多项喜人的成果,但就目前研究现状而言,仍存在很多不足之处有待解决:
1) ILs对酶分子活性影响的机理研究比较模糊,ILs对酶结构的影响因素仍需进一步明确;
2) ILs的种类虽多,但相关数据仍不健全,例如“溶度参数、极性分数”等,难以根据数据库找到最适合的ILs进行酶催化;
3) 对ILs极性的准确判断和酶分子之间的关系尚不明确;
4) 酶催化合成产物后,ILs和酶的有效回收问题有待深入研究。
随着合成技术的不断发展,制备出新型、成本低、更加高效环保的ILs,将会在酶催化领域得到大规模应用;且随着人们对酶催化研究的不断深入,探寻出既能发挥酶在ILs中的高效催化活性,又能兼具酶在ILs中溶解性和稳定性的方法也会在未来有所突破。
[1] 张霞,于志刚.离子液体研究进展[J].内蒙古石油化工,2008(3):8-12.
[2] WANG H,GURAU G,ROGERS R D.Ionic liquid processing of cellulose[J].Chemical Society Reviews,2012,41(4):1519-1537.
[3] 邓友全.离子液体介质与材料研究进展[J].成果与应用,2005,20(4):298-300.
[4] 张庆华,王瑞峰,李作鹏,等.离子液体在绿色催化和清洁合成中应用的进展[J].石油化工,2007,36(10):975-983.
[5] 韩燕.离子液体在绿色有机合成中的应用[J].化工之友,2007(1):36-37.
[6] 李秀华,许红英,陈鹏.离子液体与绿色化工[J].河北化工,2012,35(9):52-54.
[7] WILKES J S,ZAWOROTKO M J.Air and water stable 1-ethyl-3-methylimidazolium based ionic liquids[J].Journal of the Chemical Society,1992(13):965-967.
[8] 王钧凤,张锁江,陈慧萍.离子液体的性质及其在催化反应中的应用[J].过程工程学报,2003,3(2):177-185.
[9] 单冲冲.离子液体中羟基化合物的电化学反应[D].上海:华东师范大学,2011.
[10] 赵新,殷冬媛,伍振毅.离子液体的研究现状及发展趋势[J].精细与专用化学品,2013,21(11):24-28.
[11] 蒋平平,李晓婷,冷炎,等.离子液体制备及其化工应用进展[J].化工进展,2014,33(11):2815-2828.
[12] LEVEQUE J M,LUCHE J L,PRTRIER C,et al.An improved preparation of ionic liquids by ultrasound[J].Green Chemistry,2002,4:257-260.
[13] 李学琴,程建文,魏玲,等.超声波辅助法合成离子液体[C2OHmim]及其双水相体系的研究[J].精细化工,2012,29(3):308-312.
[14] 吴鹏.绿色离子液体的合成与应用[J].科技与创新,2016,179(2):38-41.
[15] MARTINEZ-PALOU R.Microwave-assisted synthesis using ionic liquids[J].Molecular Diversity,2010,14(1):3-25.
[16] 侯金松,李永红.微波辐射合成离子液体[Hmim]BF4及其在Biginelli反应中的应用[J].化学世界,2015,(8):483-500.
[17] 陆丽新.微波一步法合成离子液体-四氟硼酸1-丁基-3-甲基咪唑[D].天津:天津大学,2007.
[18] 王丽华.绿色溶剂-离子液体的合成[J].广东化工,2012,39(3):76-77.
[19] SCHOFER S H,KAFTZIK N,KRAGL U,et al.Enzyme catalysis in ionic liquids:lipase catalysedkineticre solution of 1-phenylethanol with improved enantioselectivity[J].Chemical Communications,2001(1):425-426.
[20] 王要令,徐军,陈宜俍,等.离子液体介质中绿色催化研究新进展[J].科技进展,2006(21):16-20.
[21] YANG Z,PAN W.Ionic liquids:Green solvents for non-aqueous bio catalysis[J].Enzyme and Microbial Technology,2005,37(1):19-28.
[22] SHAN H X,LU Y,LI Z J,et al.A novel temperature-controlled ionic liquid as the medium for phenylethyl acetate synthesis catalyzed by lipase[J].Chinese Journal of Catalysis,2010,31(3):289-294.
[23] SU R N,XIE M X,LI H J,et al.Preparation of poly(quaternary ammonium ionic liquids) materials and their adsorption properties for proteins[J].Chinese Journal of Chromatography,2016,34(6):545-549.
[24] 刘丽英,陈洪章.离子液体在生物催化中的应用[J].化工学报,2005,56(3):382-386.
[25] ERBELDINGER M,MESIANO A J,RUSSEU A J.Enzymatic catalysis of formation of Z-aspartame in ionic liquid an alternative to enzymatic catalysis in organic solvents[J].Biotechnology Progress,2000,16(6):1129-1131.
[26] 单海霞.新型烷基咪唑离子液体的合成及应用[D].无锡:江南大学,2010.
[27] FAN Y,QIAN J.Lipase catalysis in ionic liquids/supercritical carbon dioxide and its applications[J].Journal of Molecular Catalysis B:Enzymatic,2010,66(1/2):1-7.
[28] MONIRUZZAMAN M,KAMIYA N,GOTO M.Activation and stabilization of enzymes in ionic liquids[J].Organic & Biomolecular Chemistry,2010,13(8):2887-2899.
[29] ZHANG Q,ZHANG S,DENG Y.Recent advances in ionic liquid catalysis[J].Green Chemistry,2011,13:2619-2637.
[30] ZVJEZDANA F,GABOR M,LASZLO G,et al.Lipase catalyzed synthesis of glucose palmitate in ionic liquid[J].Journal of Cleaner Production,2016,112(1):1106-1111.
[31] WEHOFSKY N,WESPE C,CEROVSKY V,et al.Ionic liquids and proteases:a clean alliance for semisynthesis[J].Chembiochem,2009(9):1493-1499.
[32] 袁久刚,王强,范雪荣,等.离子液体/蛋白酶对羊毛表面的亲水化改性[J].纺织学报,2010,31(3):83-87.
[33] 侯雪丹,娄文勇,颜丽强,等.离子液体对木瓜蛋白酶催化特性的影响[J].高等学校化学学报,2012,33(6):1245-1251.
[34] HASAN F,SHAN A A,HAMEED A.Industrial applications of microbiallipases[J].Enzyme and Microbial Technology,2006,39(2):235-251.
[35] YANG J K,GUO D Y,YAN Y J.Cloning,expression and characterization of a novel thermal stable and short-chain alcohol tolerant lipase from burkholderiacepacia strain G63[J].Journal of Molecular Catalysis B:Enzymatic,2007,45(3/4):91-96.
[36] 初旭明,贾儒,杨姣,等.功能化离子液体化学修饰猪胰脂肪酶的催化性能[J].生物加工工程,2014,12(3):42-46.
[37] 李晓严,毛丽惠.酶运用于离子液体中的催化反应研究现状探讨[J].化工设计通讯,2016,42(4):142-144.
[38] LAU R M,SEDDON K R,RANTWIJK F,et al.Lipase-catalyzed reactions in ionic liquids[J].Organ Letter,2000(2):4189-4191.
[39] LEE S H,HA S H,CHANG W J,et al.Lipase-catalyzed synthesis of glucose fatty acid ester using ionic liquids mixtures[J].Journal of Biotechnology,2008,133(7):486-489.
[40] KURATA A,KITAMURA Y,IRIE S,et al.Enzymatic synthesis of caffeic acid phenethyl ester analogues in ionic liquid[J].Journal of Biotechnology,2010,148(2/3):133-138.
[41] LI N,DU W Y,HUANG Z N,et al.Effect of imidazolium ionic liquids on the hydrolytic activity of lipase[J].Chinese Journal of Catalysis,2013,34(4):769-780.
[42] 李明,徐晓丰,李在均,等.新型离子液体中脂肪酶催化薄荷醇选择性酯化[J].食品与生物技术学报,2015,34(9):935-942.
[43] 苏二正,尤鹏永,魏东芝,等.非水相体系中木瓜脂肪酶催化合成萜烯醇芳香酯的研究[J].林产化学与工业,2015,35(1):45-50.
[44] FANG Z.How can we best solubilize lignocellulosic biomass for hydrolysis[J].BiofuelsBioproducts and Biorefining,2015,9(6):621-622.
[45] 李珂,张健飞,孟春丽.工业绿色革命之离子液体[J].毛纺科技,2013,41(12):47-52.
[46] SWATLOSKI R P,SPEAR S K,HOLBREY J D,et al.Dissolution of cellulose with ionic liquids[J].Journal of the American Chemical Society,2002,124(18):4974-4975.
[47] KUO C H,LEE C K.Enhancement of enzymatic saccharification of cellulose by cellulose dissolution pretreatments[J].Carbohydrate Polymers,2009,77(1):41-46.
[48] LI Q,HE Y C,XIAN M,et al.Improving enzymatic hydrolysis of wheat straw using ionic liquid 1-ethyl-3-methyl imidazolium diethyl phosphate pretreatment[J].Bioresource Technology,2009,100(14):3570-3575.
[49] RAMAKRISHANA S,COLLIER J,OYETUNJI R,et al.Enzymatic hydrolysis of cellulose dissolved in N-methyl morpholine oxide/water solutions[J].Bioresource Technology,2010,101(13):4965-4970.
[50] SHEN H W,XIE H B,GONG Z W,et al.Enzymatic hydrolysates of corn stover pretreated by a N-methylpyr-rolidone ionic liquid solution for microbial lipid production[J].Creen Chemistry,2012,14(4):1202-1210.
[51] 范琳,王少君,李坤兰.咪唑类离子液体在纤维素酶降解纤维素体系中的作用[J].化工学报,2015,66(1):121-125.
[52] 朱长辉,郭峰,方真,等.纤维素在离子液体水介质中酶解的研究[J].云南大学学报(自然科学版),2016,38(1):103-108.
[53] 耿秀娟,夏新兴,巩海永.碱-离子液体预处理对麦草秸秆酶水解糖化的影响[J].中国纸业,2015,36(16):30-34.
[54] 左竹,覃小丽,王家续.离子液体中酶法催化合成糖酯的研究进展[J].食品工业科技,2015(11):390-395.
[55] BUDDE C,HINCKLEY G,MOZHAEV V V,et al.Oxidative enzymes possess catalytic activity in systems with ionic liquids[J].Biotechnology Letters,2002,24(24):2083-2087.
[56] LASZLO J A,COMPTON D L.Comparison of peroxidase activities of hemincytochrome c and microperoxidase-11 in molecular solvents and imidazolium-based ionic liquids[J].Journal of Molecular Catalysis B:Enzymatic,2002,18(1):109-120.
[57] ECKSTEIN M,VILLELA F M,LIESE A,et al.Use of an ionic liquid in a two phase system to improve an alcohol dehydrogenase catalysedreduction[J].Chemical Communications,2004(9):1084-1087.
[58] 刘洋洋,童彦杰,宋杨,等.离子液体[Bmim]Cl对酿酒酵母生长及其乙醛脱氢酶活性的影响[J].湖北农业科学,2012,51(15):3306-3307.
[59] CHOI H J,UHM K N,KIM H K.Production of chiral compound using recombinant Escherichia coli cells co-expressing reductase and glucose dehydrogenase in an ionic liquid/water two phase system[J].Journal of Molecular Catalysis B:Enzymatic,2011,70(3/4):114-118.

