聚苯胺肿瘤光热疗法构建
吴维峰,王瑾晔
(上海交通大学生物医学工程学院,上海 200240)
0 引言
肿瘤治疗一直是医学领域关注的重点话题。随着医学技术的不断发展,肿瘤治疗方法不断革新,从最初的手术切除发展到20世纪兴起的放射疗法和化学药物治疗。尽管这些都是肿瘤患者可以诉求的治疗手段,但其自身的局限性也给患者带来不少负面影响。比如,手术切除需要在病人身上打开大的“操作窗口”;放疗和化疗 “一视同仁”的特性会给人体正常组织带来同等损伤。因此,发展一种无创、毒副作用小的治疗手段成为一种迫切需求。
20世纪,纳米技术和材料的兴起极大地丰富和拓宽了人们对微观领域的认识。人们不断发展和构建将纳米科技用于肿瘤治疗的新思路,开创出肿瘤治疗的新技术或新方法,而光热治疗就是其中的一种[1-4]。
光热治疗以光响应材料作为载体,在外源光的照射下,材料实现光能与热能的相互转化,能够起到对机体组织“加热”的作用。鉴于肿瘤细胞的热耐受能力较正常组织差[5],这样可实现既杀死肿瘤细胞又不损伤正常组织的治疗目的。考虑到近红外波段的光(650-950 nm)对生物组织有良好的穿透能力且损伤小[6],利用近红外光及其对应的光响应材料是目前光热疗法的主要实现方式。本文利用聚苯胺在近红外区域的光吸收特性,以瘤内注射的方式将水分散性聚苯胺颗粒注射到小鼠瘤内,在808nm近红外激光器照射下,实施肿瘤光热治疗。
1 材料和方法
1.1 实验材料
苯胺(99%,Alfa),聚乙烯吡咯烷酮 K-30(PVP-K30,GR,国药集团化学试剂有限公司),二氯甲烷(AR,上海凌峰化学试剂有限公司),过硫酸铵(AR,国药集团化学试剂有限公司),柠檬酸(AG,国药集团化学试剂有限公司),磷酸盐缓冲液(PBS,实验室自配),细胞培养液RPMI-1640(Gibco)。
1.2 聚苯胺颗粒制备
A液:称量PVP-K304g,加入35mL 超纯水,置于恒温磁力搅拌器(HJ-3,常州国华电器有限公司)搅拌。待其完全溶解后加入苯胺0.73mL,继续搅拌使其充分混匀。
B液:称量柠檬酸5.25g,过硫酸铵0.9128g,加入超纯水25mL,超声振荡溶解。然后加入25mL二氯甲烷,在冰水浴中预冷1h。
以一定速度搅拌B液,将A液温度控制在20℃后逐滴加入B液中,冰水浴下反应4h。反应结束后静置2h,经超纯水洗涤两次后即得到所需样品。
1.3 材料表征
激光散射粒度分析仪表征:将聚苯胺溶液用超纯水稀释50倍,利用Zetasizer 3000测试粒径,扫描角度为90°,激光波长633nm,温度25℃。
透射电子显微镜表征:将聚苯胺溶液用超纯水稀释50倍,滴在有碳膜支持的铜网上,用超纯水洗两次,除去盐分,干燥后于Tecnai G2 Spirit Biotwin透射电子显微镜下观察。
1.4 聚苯胺材料光热效应
分别取PBS,聚苯胺溶液(1mg/mL,2mg/mL)3 mL,置于808 nm激光器(2W/cm2,北京镭志威光电技术有限公司)下光照8min,每隔1min用热像仪(Testo 875-1,德国)记录对应温度数值。
1.5 聚苯胺材料细胞毒性及其光热杀伤细胞能力
将肿瘤细胞BEL-7402(中科院上海细胞库)按1x105个/mL密度接种到96孔板中,每孔100 μL。在细胞培养箱中过夜孵育后,分别加入不同浓度的聚苯胺溶液(0,0.5mg/mL,1mg/mL,2mg/mL)100μL,作用24h后加入终浓度为1mg/mL的MTT,然后孵育4h。结束后每孔加入200μL DMSO,充分震荡后用酶标仪(ENSPIRE 2300)分别在490nm和630nm处检测光吸收值。
为了评价聚苯胺在近红外光照射下对肿瘤细胞杀伤能力,将肿瘤细胞BEL-7402以1x105个/mL密度接种到96孔板中,每孔100μL。过夜孵育后,加入1mg/mL聚苯胺溶液100μL 孵育24h,然后在808 nm激光器下照射8min(空白组和单一激光组分别作为对照)。结束后更换培养液,孵育24h后用MTT法鉴定细胞活力。
1.6 KM小鼠肿瘤模型构建
1.6.1 肿瘤细胞选取
雌性KM小鼠(18-20g,4-6周龄)购于上海杰思捷实验动物有限公司。待小鼠适应饲养环境后,分别选取小鼠腹水瘤细胞s180和人肝癌细胞BEL-7402(中科院上海细胞库)约100μL接种到小鼠右前肢腋下(2x106个/mL,每组n=4),跟踪观察小鼠成瘤情况。
1.6.2 接种密度的选择
选取小鼠腹水瘤细胞s180作为接种细胞,分别接种3x106个/mL,2x106个/mL和1x106个/mL s180细胞100μL至雌性KM小鼠右前肢腋下(每组n=4),跟踪观察小鼠成瘤情况。
1.7 KM小鼠肿瘤光热治疗
雌性KM小鼠(18-20g,4-6周龄),每只小鼠于右前肢腋下接种小鼠腹水瘤细胞s180(2.5x106个/mL)100μL。待肿瘤尺寸达到4-5mm后,瘤内注射50μL(1 mg/mL)聚苯胺,然后在808nm激光器下照射8min,结束后每天进行跟踪观察,未进行任何处理的荷瘤小鼠作为空白对照。
2 结果与分析
2.1 聚苯胺表征结果
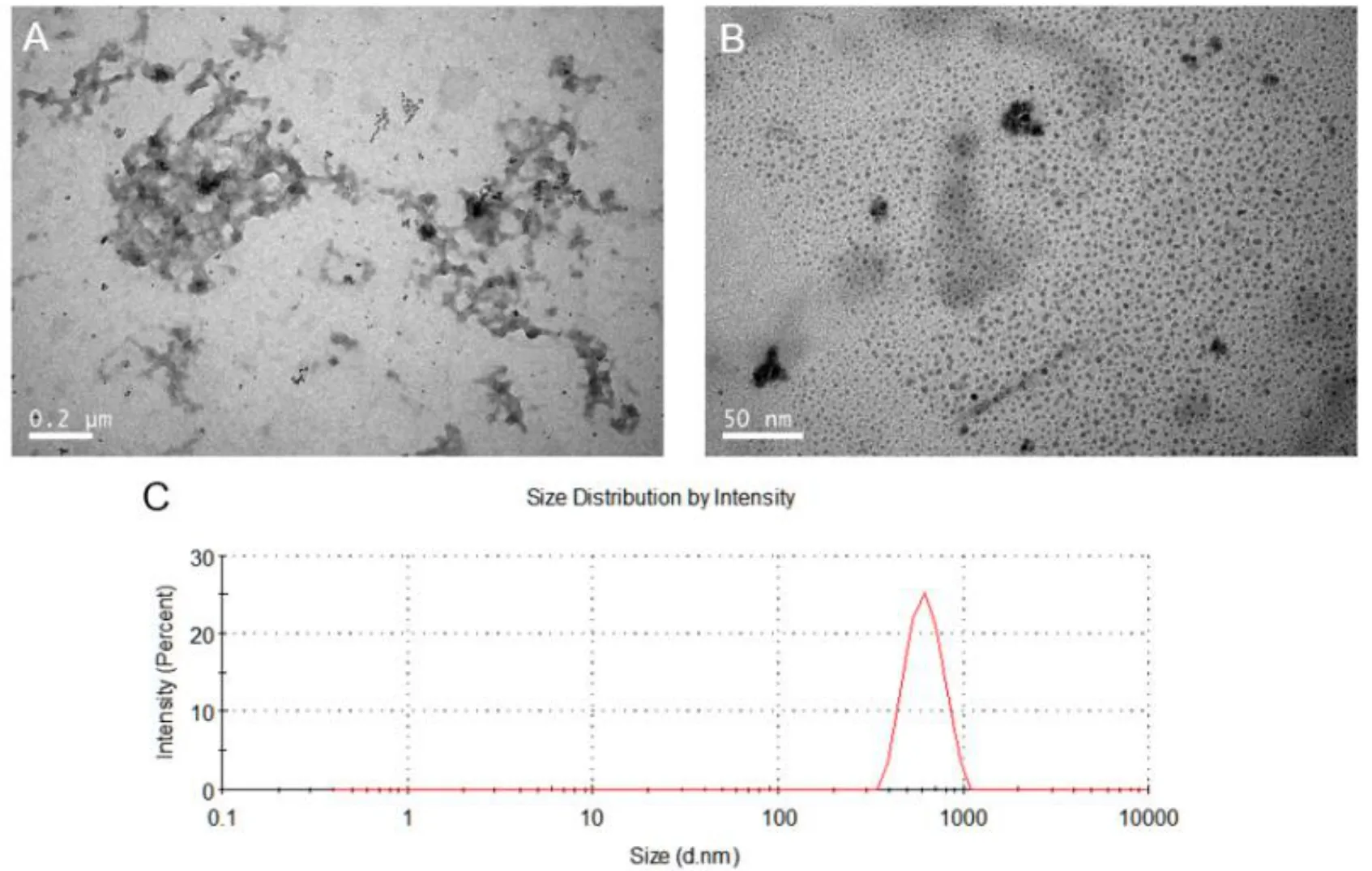
图1 聚苯胺颗粒表征结果
(A)TEM 图片,(B)TEM图片放大,(C)DLS测试曲线。
图1反应了聚苯胺颗粒的微观形貌。图1(A)和(B)展示出聚苯胺颗粒的两种状态,一种是分散性好的小颗粒,另一种是较大的聚集体。两种形貌颗粒并存可能是以下两方面作用的综合结果。一方面,表面活性剂PVP-K30的羰基O原子与苯胺的N原子发生氢键作用而被包绕在聚苯胺颗粒表面[7],形成空间位阻,有效避免颗粒之间相互碰撞、融合,因而处于小尺寸状态;另一方面,小颗粒拥有更高的表面能,表现出很强的活跃性[8],彼此间碰撞的几率增加,易形成大的聚集体。DLS测试结果对大颗粒极为敏感,反映出的信号强度数量级倍(106)高于小颗粒,所以图1(C)的粒径测试结果以聚集状态的聚苯胺为主导,尺寸分布集中在600 nm附近(PDI=0.321)。
2.2 聚苯胺光热效应
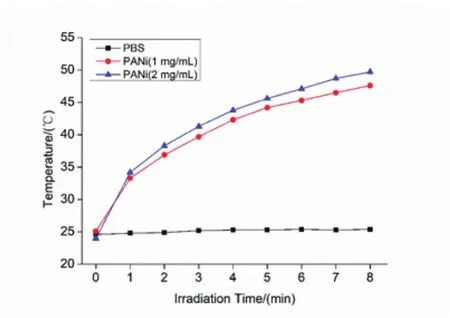
图2 不同溶液光照后温度-时间曲线
从图2可以很清楚地看到,聚苯胺溶液在808nm激光照射下溶液温度迅速升高,从最初的25℃上升至接近50℃,温度变化值ΔT超过20℃,这已足够用于光热疗法消融肿瘤组织[9]。此外,图2也反映出溶液温度与聚苯胺浓度存在依赖关系:随着浓度升高,温度也呈上升趋势。但溶液温度对聚苯胺浓度的敏感性不强:在相同时间点,1mg/mL和2mg/mL 聚苯胺溶液的温度差值在2℃之内。相比之下,PBS缺乏光热升温能力,8min之内引起的温度变化ΔT小于1℃。由此说明,聚苯胺能作为一种有效的光热转换材料,应用于肿瘤光热治疗。
2.3 聚苯胺细胞毒性及其光热杀伤细胞能力
从图3反应的细胞毒性看,随着聚苯胺浓度升高,材料对BEL-7420细胞的毒性增强,细胞活力逐渐下降。当浓度达到1mg/mL时,细胞活力为56.4%。我们推测导致聚苯胺细胞毒性源于两方面。一是小尺寸颗粒被细胞摄取后使细胞致死;二是分散性不好的聚集体在与肿瘤细胞作用时无法被摄取,这种情况下理应表现出弱的毒性,因为材料未能进入细胞内部[10]。但是,受重力作用的影响,聚集体在培养液中逐渐沉降并最终覆盖在细胞表面,阻碍了细胞与培养液间正常的物质交换,致使细胞缺乏养分死亡。
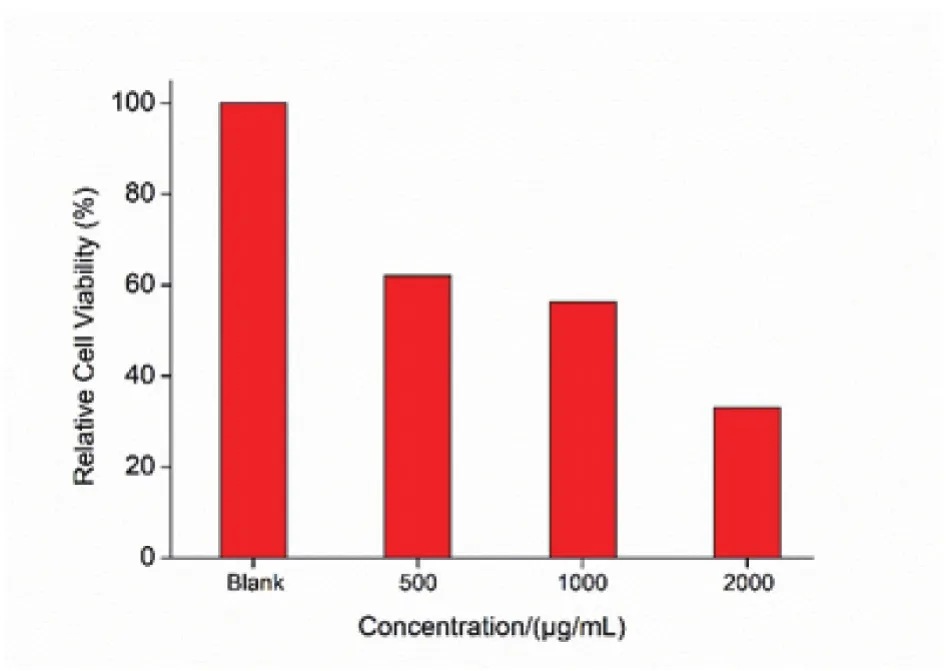
图3 与不同浓度聚苯胺溶液作用后BEL-7402细胞的相对活力
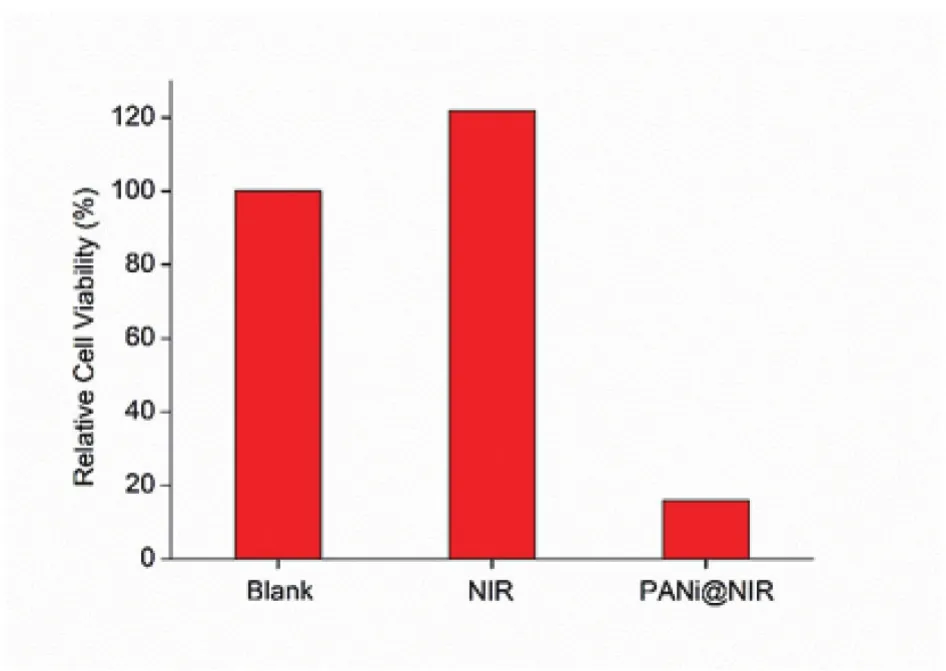
图4 与聚苯胺溶液作用后再经近红外光照射后肿瘤细胞BEL-7402细胞活力
为了证实聚苯胺颗粒有光热杀死肿瘤细胞的能力,将材料与BEL-7402孵育后给光,结果如图4所示。单纯的激光照射对细胞没有造成显著性损伤(121.8%),但在加入材料并给光后则引起细胞大批量死亡,细胞活力仅为16%。细胞活力的下降一方面来自材料自身毒性,另一方面是因为材料光照后使溶液温度短时间内急剧升高,导致细胞受热死亡。以上实验结果充分证明聚苯胺可以作为一种合适的光响应材料用于肿瘤的光热治疗。
2.4 KM小鼠肿瘤模型
2.4.1 肿瘤细胞选取
通过对KM小鼠接种后一段时间的观察,我们发现肝癌细胞BEL-7402无法在KM小鼠体内成瘤,推测原因在于KM小鼠自身健全的免疫系统。人肝癌细胞BEL-7402作为一种“异源”物质,进入小鼠体内后会引起强烈的免疫排斥反应,进而被免疫系统攻击和清除,最终无法成瘤。相比之下,鼠源s180细胞在小鼠体内引发的免疫排斥反应要弱,因而可在KM小鼠皮下成瘤,接种8天后,小鼠成瘤率可达50%。这说明KM小鼠肿瘤模型对接种细胞具有选择性。因鼠源s180细胞在KM小鼠体内能够表现出良好的成瘤性,我们选其作为KM小鼠肿瘤模型构建的细胞株。
2.4.2 接种密度的选择为了合理地掌握和控制动物实验周期和有效的成瘤率,我们探究了肿瘤细胞接种密度和肿瘤形成的关系。接种8天后,高密度组(3x106个/mL)成瘤率达到100%,中等密度组(2x106个/mL)和低密度组(1x106个/mL)成瘤率分别为50%和25%。这说明成瘤率随接种密度的升高而升高。此外,在一定范围内,接种密度和出瘤时间呈负相关关系,上述三组小鼠的出瘤时间在4-6天不等。综合考虑成瘤率和出瘤时间,我们选取2.5x106个/mL这一接种密度用于后续实验。
2.5 KM小鼠体内光热治疗
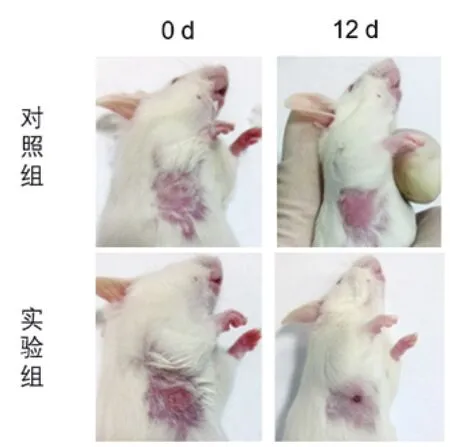
图5 光照后12天小鼠图片
由图5可见,实验组和对照组在光照后12天差异明显。对照组小鼠腋下肿瘤没有表现出任何受损迹象,肿瘤持续增大。而实验组小鼠经过光照处理后,肿瘤组织出现坏死、结痂,12天后肿瘤表面结痂脱落,留下明显疤痕。这说明了聚苯胺肿瘤光热疗法的有效性。关于肿瘤萎缩、坏死的原因,我们分析认为:一方面是因为聚苯胺颗粒自身的毒性引发了肿瘤细胞的死亡;另一方面,聚苯胺吸收近红外光后产生的热量使肿瘤组织内部温度升高[6],超过了肿瘤细胞的温度耐受范围,引起肿瘤细胞死亡。在这两方面的协同作用下,小鼠腋下肿瘤得以抑制,出现结痂、萎缩。
但是,实验组小鼠腋下肿瘤并没有得到完全根除,在疤痕周边还存在“残留”的肿瘤组织。分析原因,推断是光热治疗过程中肿瘤组织内部温度分布不均造成的。由于合成的聚苯胺颗粒存在一定程度聚集,瘤内注射后未能在肿瘤组织内部充分扩散,而是局限以注射位点为中心的周边部分区域,致使光照后局部温度显著升高,达到杀死肿瘤细胞要求[11]。距离注射位点偏远的组织尽管因热交换温度得到升高,但上升幅度受限,未能达到杀死肿瘤细胞的温度条件。
通过以上实验结果,我们充分说明了聚苯胺光热疗法抑制肿瘤的可行性,但囿于颗粒自身的分散性,未能取得理想化的结果。
3 小结
本文构建了聚苯胺肿瘤光热疗法实验体系。采用氧化聚合法,我们制备出水分散性聚苯胺纳米颗粒。体内外实验结果反映出聚苯胺具有良好的光热转换效率和显著性抑瘤效果,这充分说明了聚苯胺可作为一种应用于肿瘤光热治疗的理想材料。但受限于材料自身的分散性问题,聚苯胺光热疗法未能达到根除肿瘤的目的,这还需要在材料的合成制备上予以改进和优化。
[1] Wu X,Ming T,Wang X,et al.High-photoluminescence-yield gold nanocubes: for cell imaging and photothermal therapy[J].Acs Nano,2009,4(1):113-120.
[2] Tian Q,Tang M,Sun Y,et al.Hydrophilic Flower-Like CuS Superstructures as an Efficient 980 nm Laser-Driven Photothermal Agent for Ablation of Cancer Cells[J].Advanced Materia ls,2011,23(31):3542-3547.
[3] Yang K,Wan J,Zhang S,et al.The influence of surface chemistry and size of nanoscale graphene oxide on photothermal therapy of cancer using ultra-low laser power[J].Biomaterials,2012,33(7):2206-2214.
[4] Yang K,Xu H,Cheng L,et al.In vitro and in vivo near-infrared photothermal therapy of cancer using polypyrrole organic nanoparticles[J].Advanced materials,2012,24(41):5586-5592.
[5] 王晓莉,孙瑞梅.肿瘤热疗的机理及临床研究[J].科技资讯,2016,14(25):181-182.
[6] Zhou J,Lu Z,Zhu X,et al.NIR photothermal therapy using polyaniline nanoparticles[J].Biomaterials,2013,34(37):9584-9592.
[7] Stockton W B,Rubner M F.Molecular-level processing of conjugated polymers. 4. Layer-by-layer manipulation of polyaniline via hydrogen-bonding interactions[J].Macromolecules,1997,30(9):2717-2725.
[8] 张阳德.纳米生物技术学[M].北京:科学出版社,2005:61-63.
[9] Piao J G,Liu D,Hu K,et al.Cooperative nanoparticle system for photothermal tumor treatment without skin damage[J].ACS applied materials & interfaces,2016,8(4):2847-2856.
[10] 汤京龙,王硕,刘丽,等.纳米银颗粒的细胞毒性作用及机制初探[J].北京生物医学工程,2013,32(05):485-489.
[11] Li Z,Huang H,Tang S,et al.Small gold nanorods laden macrophages for enhanced tumor coverage in photothermal therapy[J].Biomaterials,2016,74:144-154.

