体外膜肺氧合辅助下经导管主动脉瓣置换术的临床应用研究
(空军军医大学西京医院,陕西 西安 710032; 1 心血管外科; 2 麻醉科; 3 超声科)
主动脉瓣狭窄及关闭不全是一种常见的心脏瓣膜疾病,大多为老年主动脉瓣退行性变引起的[1]。体外循环下主动脉瓣膜置换术是此种疾病的经典治疗方法[2-4]。然而,许多病人由于高龄、体质差及全身合并症多等原因,无法耐受传统外科手术。经导管主动脉瓣置换术(TAVR)自2002年问世以来,由于具有微创、无需开胸、中远期疗效良好的优势[5-8],适合治疗不易于传统外科开胸置换主动脉瓣的病人。但是对于病史长、心脏长期损害致心脏射血分数(EF)显著降低,已经进入失代偿期的主动脉瓣疾病病人,即使行微创TAVR,仍存在术中血流动力学崩溃、恶性心律失常等严重并发症,极大增加了TAVR的风险[9-11]。2018年我院采用TAVR治疗极高危主动脉瓣狭窄病人2例,采用体外膜肺氧合(ECMO)技术支持,治疗效果较好。现报告如下。
1 资料与方法
1.1 一般资料
病例1,男,60岁,主因“间歇性胸闷、气短2年,加重1周”入院。入院时体温36.6 ℃,心率57次/min,呼吸18次/min,血压12.8/9.2 kPa;实验室检查:pro-BNP 5 518 ng/L,TropI 0.05 μg/L。入院后48 h病人出现气短、胸闷,咳白色泡沫痰,心率120次/min,双肺可闻及湿啰音;血氧饱和度91%;心电图显示:心率85次/min,左心室肥厚伴劳损,左心室高电压;X线胸片显示:心胸比0.73,双肺未见实质性病变;心脏彩超显示:主动脉瓣狭窄,最大收缩压力阶差10.67 kPa,左心室显著扩大,左心室各壁及室间隔普遍增厚,搏幅减低,单平面EF 13%(图1),CTA检查显示为典型主动脉瓣狭窄影像,Type 0型二叶瓣,瓣叶钙化程度重(图2),STS评分32.8分。入院后给予1周强心、利尿等治疗,效果不佳。病人为主动脉瓣狭窄导致心脏功能衰竭,系极高危病人,传统开胸行主动脉瓣置换术已不具备条件,TAVR也风险较高。经心脏外科全体讨论,拟定治疗方案为ECMO辅助下行TAVR治疗。告知病人家属手术风险性及预后情况。

A:EF=13%,HR 180次/min;B:超声所见室壁处于无运动状态。

A:主动脉瓣瓣环长短径,作为选用瓣膜大小的参考;B:窦部大小测量,CTA检查所示为Type 0二叶瓣,伴有瓣膜明显钙化。
病例2,男,70岁,主因“间歇性心悸、气短胸闷、胸痛5年,加重4 d”入院。入院后48 h病人出现气短、胸闷,心率110次/min,双肺可以闻及湿啰音,氧饱和度91%,实验室检查:pro-BNP 9 476 ng/L。肺功能检查显示:重度混合性通气障碍,弥散功能轻度降低;心电图检查显示:左心室肥厚伴劳损;心脏彩超检查显示:主动脉瓣狭窄,最大收缩压力阶差12.27 kPa,伴关闭不全并钙化,瓣口面积0.8 cm2,瓣下反流容积为7.0 mL,左心室左右径分别为66、96 mm,单平面EF值17%;STS评分23.5分;CTA显示为典型主动脉瓣狭窄影像,Type0型二叶瓣,瓣叶钙化程度重(图3)。病人经1周强心、利尿等治疗后,临床症状略有改善。经讨论认为该病人传统开胸行主动脉瓣置换术不具备条件,TAVR风险也较高,制定治疗方案为ECMO辅助下行介入置换瓣膜。充分告知病人家属手术风险性及预后情况。完善术前检查(图3)。
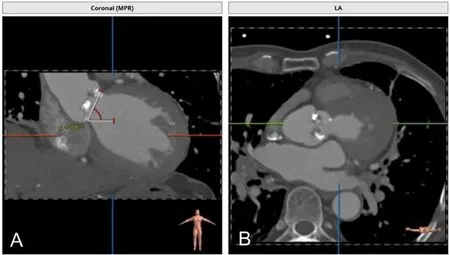
A:CTA冠状位显示瓣环水平面夹角,可见左心室扩大明显;B:CTA横截位显示心肌增厚伴有主动脉瓣明显钙化。
1.2 ECMO的建立及TAVR治疗
病人全麻后,切开并暴露左侧股动脉及股静脉,应用A15F股动脉插管以及V18F股静脉插管建立ECMO,循环辅助流量为3.0~3.5 L/min,血压稳定于约9.3 kPa。术中确保管道的位置良好,防止牵拉、打折、移位以及脱出等,辅助期间观察管道的血液颜色以及管道的张力、管道是否抖动、ACT是否大于480 s及是否有血凝块等,给予病人保暖,维持病人血液温度36~37 ℃,以保证血液回流到体内的温度接近生理温度。显露右侧股动脉,穿刺置入6F股鞘;右侧桡动脉穿刺置入5F桡鞘管;逆行5F猪尾巴导管造影,右侧颈静脉置入6F起搏器导管鞘管,调试起搏导管至右心室心尖处;泥鳅导丝引导AL2导管至主动脉根部,置换2.6 m直头泥鳅导丝引导AL2导管成功通过主动脉瓣狭窄瓣口;置入20F主动脉鞘管,将AL2导管交换以带弯lunderquist导丝并留置于左心室内,撤出AL2导管,送入Z-MEDⅡ主动脉扩张球囊,在起搏心率180次/min条件下扩张主动脉瓣;DSA造影显示主动脉瓣,观察瓣环是否扩开,在ECMO辅助下维持血压,食管超声监测心功能以及瓣膜反流情况。根据术前CTA评估及球囊扩张测定选择相应型号Venus-A支架瓣膜,退出球囊后瓣膜输送系统沿着lunderquist导丝跨越主动脉瓣口至瓣环水平,根据造影确定位置,起搏心率180次/min,调整瓣膜位置准确释放,造影显示瓣膜位置是否良好,观察病人血压,食管超声监测主动脉支架瓣膜位置、瓣叶开闭情况,确认正常后,退出瓣膜输送系统。病人循环稳定,逐步减少ECMO流量,加大心脏负荷直至停止循环,观察血流动力学情况。病人送监护室观察,病情稳定后转回普通病房。病例1术中造影显示瓣膜释放过程见图4。2例病人术前、术中及术后血流动力学参数及使用的器材情况见表1。
表12例病人术前、术中及术后血流动力学参数及使用的器材情况

参数或器材病例1病例2术前血压未测出(病人浑身湿冷)11.2/8.2 kPa术前左心室压未测21.3/0 kPaZ-MEDⅡ主动脉扩张球囊直径18 mm23、25 mm球囊扩张后血压12.0/6.6 kPa 13.6./10.6、16.5/12 kPaVenus-A支架瓣膜直径26#29#支架置入后血压15.7/8.3 kPa16.0/8.6 kPa术后左心室压15.7/0.5 kPa16.0/0 kPaECMO辅助时间150 min38 min
2 结 果
2例ECMO辅助极高危病人均进行了TAVR手术,围手术期病人的血流动力学稳定,于TAVR手术结束前撤除ECMO,手术时间分别为220及190 min,DSA的照射时间分别为38及26 min,ECMO辅助时间分别为150和38 min。病例1于术后7 d出院,术后1个月随访心脏缩小,EF值回升至41%。病例2术中即刻食管超声检查显示EF值提升至28.4%(图5),于术后6 d出院,术后1月随访心脏显著缩小,EF值回升至40%,生活质量明显提高,目前2例病人均在密切随访中。
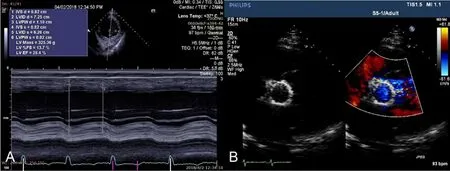
A:超声结果显示EF为28.4%;B:超声显示瓣膜位置良好。
3 讨 论
正常成人主动脉瓣开口面积为3~4 cm2,一般主动脉瓣瓣膜面积降至正常人的1/3~1/4时,才会出现血流动力学改变,病人出现临床症状。一般认为主动脉瓣的瓣口面积1.50 cm2为轻度狭窄,瓣口面积为0.75~1.50 cm2为中度狭窄,瓣口面积小于0.75 cm2为重度狭窄。另一种根据跨瓣压差进行判断,当峰压跨瓣压差大于6.67 kPa为重度狭窄,当压差为3.33~6.67 kPa时为中度狭窄,当压差小于3.33 kPa为轻度狭窄。极高危主动脉瓣狭窄病人为年龄大于60岁,主动脉瓣瓣口面积小于0.75 cm2或者主动脉瓣跨瓣压差大于6.67 kPa的病人,属于外科手术风险高的病人[12]。
TAVR是一项用于主动脉瓣疾病治疗的新技术。经过十几年的迅速发展,TAVR在治疗中重度主动脉瓣狭窄上的可行性和安全性已经在全球范围内得到了广泛的认可,目前已经被推荐成为其主要的治疗方式之一。然而,临床上有相当比例的病人合并有小左心室、低EF值等进行TAVR手术的高风险因素。欧洲心脏杂志的一项研究显示,当左心室EF低于30%时,接受手术病人的比例低至3%。而根据统计,保守治疗的病人年病死率高达10%~20%,其10年并发症的发生率和病死率也不容乐观[3]。如何为此类极高危病人寻找一种安全有效的治疗方法始终是心血管领域的一个难题[13-16]。
ECMO的理念源于心脏手术体外循环(CPB)技术,是一种可以使用较长时间的简化CPB装置,近年来用于各种原因导致的急性循环和呼吸衰竭的抢救性辅助治疗。对于循环不稳定病人ECMO可以提供稳定的血流量及氧气供应,有效治疗可逆心力衰竭[17-20]。我院在国内较早尝试将ECMO应用于TAVR手术,通过2例临床实践,发现术中给予病人主动脉瓣扩张时对病人循环影响不大,ECMO有效地保障了手术期间血流动力学稳定,可反复多次扩张病变的主动脉瓣,无室上速以及心室颤动等恶性心律失常出现,极大降低了TAVR的手术风险,可以最大限度地保证病人血流动力学的平稳,使得TAVR术中关键手术步骤(主动脉瓣球囊扩张、介入瓣的释放)最小干扰病人血流动力学的稳定,显著降低心脏激惹,有效地保障高危病人的手术安全性。同时,对于严重主动脉瓣狭窄病人,ECMO辅助下进行球囊扩张后血压都有不同程度的改善,避免了此类病人无保护状态下进行球囊扩张出现的循环崩溃等的风险,使得病人最大程度获益。TAVR术中使用ECMO可用于术后抢救并发症,预防性使用ECMO有3项指征:心源性休克、EF严重降低和肺动脉高压并右心室功能不全。术前ECMO支持可能不仅提高了紧急TAVR的预后,而且也拓宽了病人的心功能储备。国外的一项回顾性研究认为,对于血流动力学情况不稳定的病人,ECMO辅助下行TAVR手术有利于改善预后、减少围手术期的并发症[21]。自2002年CRIBIER等[22]施行了全球首例TAVR开始,全球累计TAVR手术病例已超过了30万例,在瓣膜设计、手术途径、瓣膜释放方式、辅助器械以及辅助手段等方面不断地更新与发展[19,23-25],从球囊扩张型瓣膜到自膨式瓣膜,从股动脉途径到经心尖途径,从单瓣植入到瓣中瓣(valve in valve)技术、瓣膜可回收技术,TAVR的适应证也在不断扩大[26-28]。目前国内开展TAVR的中心逐渐增多,但尝试利用ECMO辅助下行TAVR手术的此前鲜见报道。ECMO手术操作难度大,技术要求高,对整个手术团队及医院的综合条件要求较高[26];对于极高危的TAVR病人,需要充分考虑到各种严重围手术期并发症的可能,做好手术预案,才能充分保障手术成功和病人安全。
综上,TAVR手术的出现,对于高危主动脉瓣疾病病人,提供了一种安全、有效的治疗选择。对于心功能差、全身状况差的极高危主动脉瓣疾病病人,联合应用ECMO进行术中辅助循环支持,大大降低了手术风险。ECMO辅助下TAVR手术可能为此类高危病人提供一种新的治疗手段,此类技术的强强联合为极高危主动脉瓣疾病病人提供了有效保障,但目前ECMO和TAVR在国内均为新型技术,临床应用也处于起步阶段,为更好地便于临床推广,为高危病人提供新的治疗方案,特把我院临床应用经验做简单分享。
[参考文献]
[1] ROSS J J, BRAUNWALD E. Aortic stenosis[J]. Circulation, 1968,38(1 Suppl):61-67.
[2] VAHANIAN A, OTTO C M. Risk stratification of patients with aortic stenosis[J]. Eur Heart J, 2010,31(4):416-423.
[3] IUNG B, BARON G, BUTCHART E G, et al. A prospective survey of patients with valvular heart disease in Europe:The Euro heart survey on valvular heart disease[J]. Eur Heart J, 2003,24(13):1231-1243.
[4] IUNG B, CACHIER A, BARON G, et al. Decision-making in elderly patients with severe aortic stenosis:Why are so many denied surgery[J]? Eur Heart J, 2005,26(24):2714-2720.
[5] VAHANIAN A, ALFIERI O, ANDREOTTI F, et al. Guidelines on the management of valvular heart disease (version 2012):The joint task force on the management of valvular heart disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS)[J]. Eur J Cardiothorac Surg, 2012,42(4):S1-S44.
[6] D’ERRIGO P, BARBANTI M, RANUCCI M, et al. Transcatheter aortic valve implantation versus surgical aortic valve replacement for severe aortic stenosis:Results from an intermediate risk propensity-matched population of the Italian OBSERVANT study[J]. Int J Cardiol, 2013,167(5):1945-1952.
[7] 刘庆荣,吴永健. 经导管主动脉瓣膜置换心脏团队建设[J]. 心电与循环, 2016,35(6):401-402,406
[8] 张昊,吴永健. 经导管主动脉瓣置换术的进展与未来[J]. 中国循环杂志, 2016,31(7):711-714.
[9] SCHYMIK G, SCHROFEL H, SCHYMIK J S, et al. Acute and late outcomes of Transcatheter Aortic Valve Implantation (TAVI) for the treatment of severe symptomatic aortic stenosis in patients at high- and low-surgical risk[J]. J Interv Car-diol, 2012,25(4):364-374.
[10] NISHIMURA R A, OTTO C M, BONOW R O, et al. 2014 AHA/ACC guideline for the management of patients with valvular heart disease:A report of the American College of Car-diology/American Heart Association Task Force on Practice Guidelines[J]. J Thorac Cardiovasc Surg, 2014,148(1):e1-e132.
[11] PIAZZA N, KALESAN B, VAN MIEGHEM N, et al. A 3-center comparison of 1-year mortality outcomes between transcatheter aortic valve implantation and surgical aortic valve replacement on the basis of propensity score matching among intermediate-risk surgical patients[J]. JACC Cardiovasc Interv, 2013,6(5):443-451.
[12] PATRICIO L. Comment on “1-year outcomes after transfemoraltranscatheter or surgical aortic valve replacement. Results from the Italian OBSERVANT study”[J]. Rev Port Cardiol, 2015,34(11):711-712.
[13] ROTMAN O M, KOVAROVIC B, SADASIVAN C, et al. Realistic vascular replicator for TAVR procedures[J]. Cardiovasc Eng Technol, 2018.
[14] BUCHANAN K D, ROGERS T, SHULTS C, et al. Successful transcatheter aortic valve replacement in an oversized 800 mm(2) annulus and bicuspid aortic valve[J]. Cardiovasc Revasc Med, 2018.
[15] PFISTER R, WAHLERS T, BAER F M, et al. Utility of NT-pro-BNP in patients undergoing transapical aortic valve replacement[J]. Clin Res Cardiol, 2010,99(5):301-307.
[16] REHMAN H, KLEIMAN N S, KALRA A. Transcathetervalvular interventions in 2017:Some things old, some things new[J]! Curr Opin Cardiol, 2018.
[17] ANNABI M S, CLISSON M, CLAVEL M A, et al. Workup and management of patients with paradoxical low-flow, low-gradient aortic stenosis[J]. Curr Treat Options Cardiovasc Med, 2018,20(6):49.
[18] HUI S, GOOLEY R, RASHID H N, et al. Transcatheteraortic valve replacement and atrial fibrillation:Impact of antithrombotic strategy on clinical outcomes[J]. Heart Lung Circ, 2018.
[19] MONDAL S, ASHISH K, BANDYOPADHYAY D, et al. Role of TAVR in pure native valvular aortic regurgitation: A new paradigm[J]. Int J Cardiol, 2018.
[20] LAZAR H L. One-year outcomes in TAVR patients:Dying from versus dying with aortic stenosis[J]. J Card Surg, 2018,33(5):250-251.
[21] DOLMATOVA E, MOAZZAMI K, COCKE T P, et al. Extracorporeal membrane oxygenation in transcatheter aortic valve replacement[J]. Asian Cardiovasc Thorac Ann, 2017,25(1):31-34.
[22] CRIBIER A, ELTCHANINOFF H, BASH A, et al. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis:First human case description[J]. Circulation, 2002,106(24):3006-3008.
[23] BAVARIA J E, SZETO W Y, ROCHE L A, et al. The progression of a transcatheter aortic valve program:Adecision analysis of more than 680 patient referrals[J]. Ann ThoracSurg, 2011,92(6):2072-2077.
[24] LANGE R, SCHREIBER C, GOTZ W, et al. First successful transapical aortic valve implantation with the CorevalveReval-ving system:A case report[J]. Heart Surg Forum, 2007,10(6):e478-479.
[25] WILLSON A, TOGGWEILER S, WEBB J G. Transfemoral aortic valve replacement with the SAPIEN XT valve:Step-by-step[J]. Semin Thorac Cardiovasc Surg, 2011,23(1):51-54.
[26] BANJAC I, PETROVIC M, AKAY M H, et al. Extracorporeal membrane oxygenation as a procedural rescue strategy for transcatheteraortic valve replacement cardiac complications[J]. ASAIO J, 2016,62(1):e1-4.
[27] MAKDISI G, MAKDISI P B, WANG I W. New horizons of non-emergent use of extracorporeal membranous oxygenator support[J]. Ann Transl Med, 2016,4(4):76.
[28] UEHARA K, MINAKATA K, SAITO N, et al. Use of extracorporeal membrane oxygenation in complicated transcatheter aortic valve replacement[J]. Gen Thorac Cardiovasc Surg, 2017,65(6):329-336.

