三磷酸腺苷酶家族蛋白2在不同病变胃组织中的表达及其意义
,
(青岛大学,山东 青岛 266021 1 基础医学院病理学系; 2 附属医院病理科)
胃癌是世界上消化系统常见的恶性肿瘤之一,其较高的发病率和死亡率严重威胁人类的健康[1],尽管胃镜活检健康筛查逐渐普及,但是由于早期症状不明显,多数病人就诊时往往处于中晚期,预后较差。胃癌的发生、发展过程涉及一系列遗传学改变,如众多抑癌基因的失活和癌基因的激活,但其具体的分子机制目前尚不十分清楚。目前,胃腺癌是胃恶性肿瘤中最常见的组织学类型[2]。三磷酸腺苷酶家族蛋白2(ATAD2)是近年来发现的一种肿瘤相关分子。已有研究显示,ATAD2在多种恶性肿瘤中过表达,并与多种肿瘤的生存预后不良相关[3-6]。目前,有关ATAD2在不同病变胃组织中表达情况的研究相对较少。本文旨在通过检测ATAD2在新鲜胃腺癌组织中mRNA水平的表达,以及ATAD2在不同病变胃组织中的表达情况,初步探讨其表达与胃腺癌的发生发展的关系及意义。
1 材料与方法
1.1 材料
收集青岛大学附属医院2017年经手术切除的新鲜胃腺癌及相应癌旁相对正常组织12例,2011—2012年行手术切除的胃腺癌与相应癌旁相对正常组织(其中相应癌旁相对正常组织距肿瘤>5 cm)121例;另收集121例非瘤变胃组织(78例慢性浅表性胃炎、43例慢性萎缩性胃炎),16例低级别上皮内瘤变,13例高级别上皮内瘤变组织。所有胃腺癌病人术前均未行放射、化学药物治疗,病人年龄38~85岁,平均62.7岁。所有切片均经2位经验丰富的病理医生阅片复诊。本实验经青岛大学附属医院伦理委员会同意。
1.2 试剂
浓缩型鼠抗人单克隆抗体ATAD2(1∶100,英国Abcam公司);PV6000免疫组化检测试剂盒(北京中杉金桥生物技术有限公司)。
1.3 方法
1.3.1实时荧光定量PCR法检测ATAD2在胃腺癌组织中的表达 用Trizol提取12例新鲜胃腺癌及相应癌旁相对正常组织总RNA,Prime ScriptTM反转录试剂盒(大连Takara公司生产)合成第一链cDNA,以cDNA为模板,应用Bio-Rad CFX96实时荧光定量PCR仪器以及SYBR Premix Ex TaqTM Ⅱ荧光定量试剂盒(大连Takara公司)对ATAD2和β-actin的表达水平进行检测。ATAD2引物序列为:5′-GGAATCCCAAACCACTGGACA-3′(正义链),5′-GGTAGCGTCGTCGTAAAGCACA-3′(反义链);β-actin的引物序列为:5′-CGCAAAGACCT-GTATGCCAA-3′(正义链);5′-CACACAGAGTAC-TTGCGCTC-3′(反义链)。反应条件如下:95 ℃预变性30 s;随后95 ℃变性5 s,55 ℃退火30 s,72 ℃延伸30 s,共进行40个循环。使用2-△△Ct方法计算ATAD2在胃腺癌组织中的相对表达量。
1.3.2组织微阵列构建 对121例胃腺癌及相应癌旁相对正常组织进行石蜡包埋、切片,苏木精-伊红(HE)染色后,由两位经验丰富的病理医生诊断阅片,并对典型的区域进行确认及标记,用孔径为1.5 mm细针对蜡块进行打孔,并矩形排阵于空白受体蜡块,受体蜡块经53 ℃阵列融合,4 μm厚连续切片,HE染色以后,对每一个组织样本行复诊质检。
1.3.3免疫组化染色 所有标本经常规石蜡包埋、4 μm厚连续切片、脱蜡、水化后,采用PV6000法进行免疫组化染色。以体积分数0.03 H2O2灭活内源性过氧化物酶,高压热抗原(1 mmol/L EDTA,pH 8.0)修复,室温冷却,PBS冲洗2次以后,滴加一抗于4 ℃冰箱孵育过夜,PBS冲洗3次,滴加二抗,37 ℃孵育20 min,PBS冲洗3次,滴加DAB显色,苏木精复染,中性树胶封片。用已知阳性表达ATAD2的正常睾丸组织作为阳性对照,用PBS代替一抗作为阴性对照。
1.4 结果判读
以在细胞核中出现棕黄色和棕褐色的颗粒为ATAD2阳性表达,评判标准参考相关的文献[7-8]。按照阳性细胞所占的百分比进行评分。0分:阳性细胞百分比<5%,1分:阳性细胞百分比占5%~25%,2分:阳性细胞百分比26%~50%,3分:阳性细胞百分比占51%~75%,4分:阳性细胞百分比占76%~100%;按照染色强度评分。0分:无着色,1分:浅黄色,2分:棕黄色,3分:棕褐色。ATAD2免疫组化染色得分=阳性细胞所占百分比得分×染色强度得分,ATAD2免疫组化染色得分≤4分为低表达,>4分为高表达。
2 结 果
2.1 新鲜胃腺癌与相应癌旁相对正常组织中的ATAD2 mRNA表达
ATAD2在胃腺癌与相应癌旁相对正常组织中的平均相对表达量分别为-2.36±1.21、-2.90±1.15,差异具有统计学意义(t=4.664,P<0.01)。
2.2 胃腺癌与相应癌旁相对正常组织中ATAD2蛋白的表达
ATAD2在121例胃腺癌组织中有23例(23/121)呈高表达,而在相应癌旁相对正常组织中均不表达,两者比较差异具有统计学意义(z=-12.588,P<0.01)。
2.3 不同病变胃组织中ATAD2蛋白的表达
ATAD2在121例非瘤变的胃组织中均不表达(图1A、B),在16例低级别上皮内瘤变中8例低表达,8例不表达(图1C),在13例高级别上皮内瘤变中11例低表达,2例不表达(图1D),在121例胃腺癌中有23例高表达,98例低表达(20例不表达)(图1E)。高级别上皮内瘤变及胃腺癌组织中ATAD2蛋白表达与低级别上皮内瘤变组织比较明显升高(z=-2.531、-2.285,P<0.05);与低级别上皮内瘤变相比,非瘤变胃组织中ATAD2蛋白无表达(z=-7.984,P<0.01)。ATAD2在高级别上皮内瘤变与胃腺癌组织中表达无差异(P>0.05)。
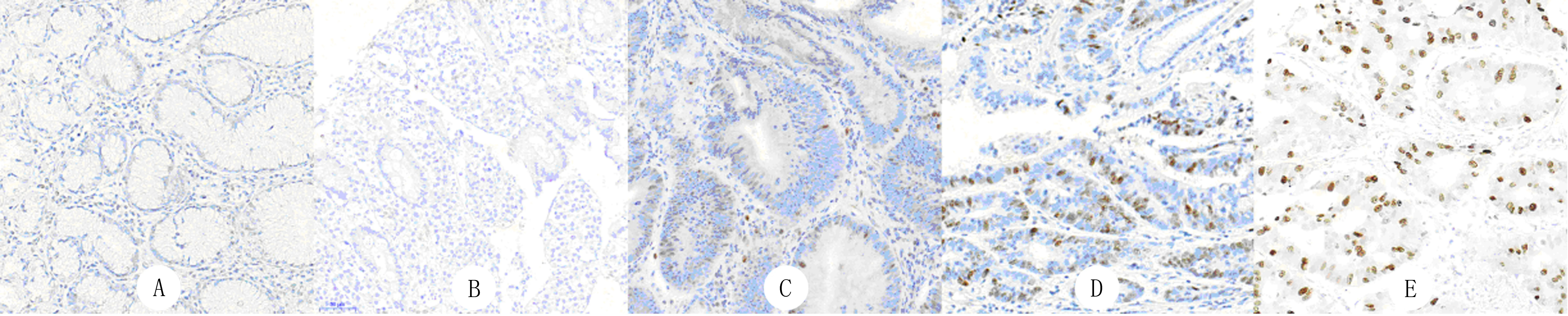
A:慢性浅表性胃炎;B:慢性萎缩性胃炎;C:低级别上皮内瘤变;D:高级别上皮内瘤变;E:胃腺癌。PV6000法,200倍。
2.4 ATAD2蛋白在胃腺癌中的表达及与临床病理特征的关系
ATAD2蛋白在胃腺癌中的表达水平与肿瘤大小、分化程度相关(χ2=5.506、8.412,P<0.05),而与病人年龄、性别、淋巴结是否转移、TNM分期、浸润深度均无关(P>0.05)。见表1。
表1ATAD2蛋白在胃腺癌中的表达及与临床病理特征的关系(例(χ/%))
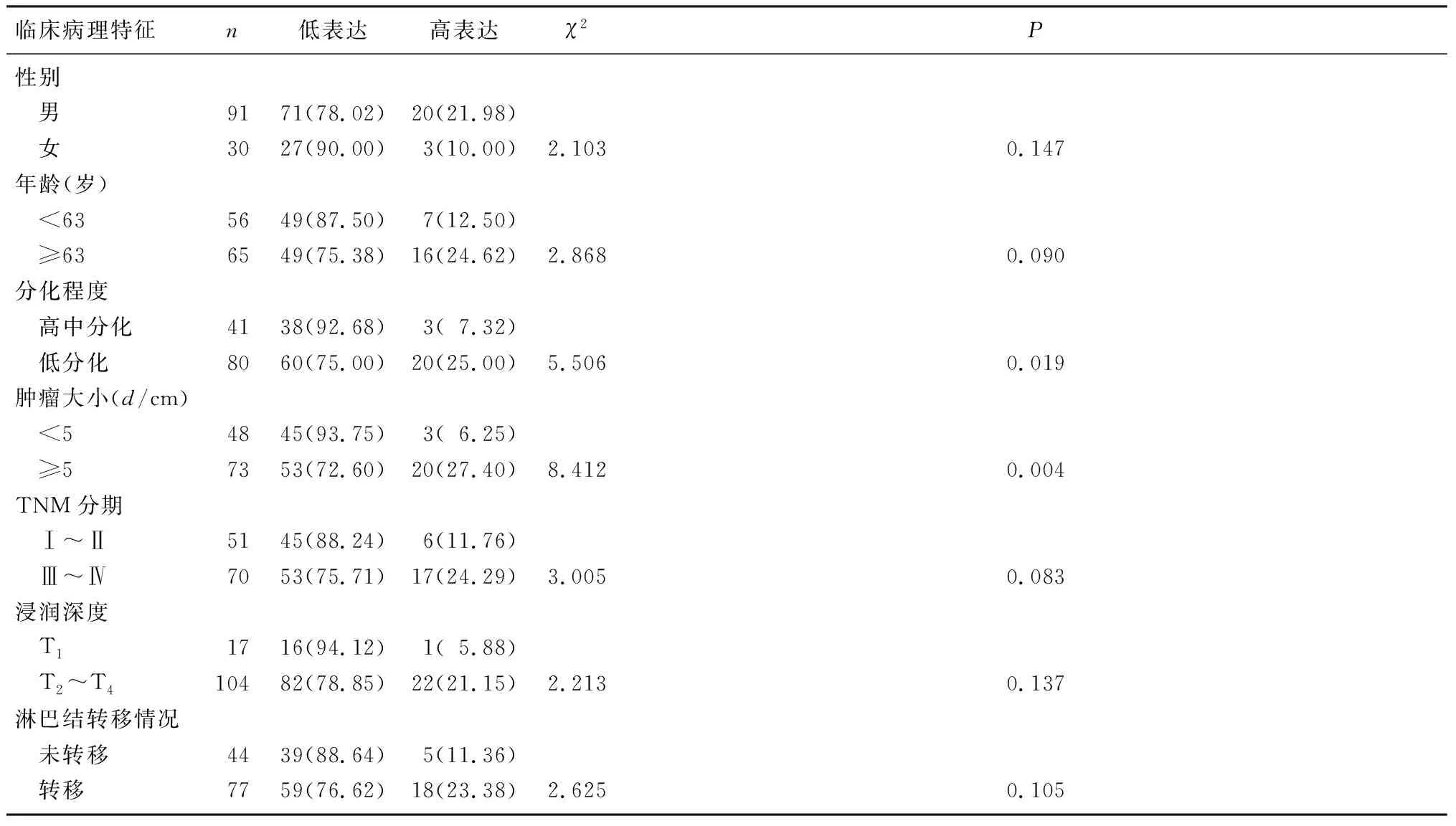
临床病理特征n低表达高表达χ2P性别 男9171(78.02)20(21.98) 女3027(90.00)3(10.00)2.1030.147年龄(岁) <635649(87.50)7(12.50) ≥636549(75.38)16(24.62)2.8680.090分化程度 高中分化4138(92.68)3(7.32) 低分化8060(75.00)20(25.00)5.5060.019肿瘤大小(d/cm) <54845(93.75)3(6.25) ≥57353(72.60)20(27.40)8.4120.004TNM分期 Ⅰ~Ⅱ5145(88.24)6(11.76) Ⅲ~Ⅳ7053(75.71)17(24.29)3.0050.083浸润深度 T11716(94.12)1(5.88) T2~T410482(78.85)22(21.15)2.2130.137淋巴结转移情况 未转移4439(88.64)5(11.36) 转移7759(76.62)18(23.38)2.6250.105
3 讨 论
ATAD2的编码基因位于染色体8q24.13,其表达产物ATAD2又称为PRO2000或ANCCA,主要包含两个结构域,一个与细胞活性相关的ATP酶结构域[9-10],另一个为参与蛋白质翻译后修饰相关的溴结构域[11]。有研究显示,ATAD2参与调控肿瘤相关的信号转导通路,如ATAD2可以与E2F以及Myc相互作用,从而导致多种肿瘤的发生[12];ATAD2可以与ACTR启动子结合,参与肿瘤的发生及发展[12]。已有研究显示,ATAD2在卵巢癌、结直肠癌、子宫内膜癌以及肝癌等多种恶性肿瘤中呈过表达[6,7,13],并且参与了多种肿瘤的DNA的复制过程[14]。有研究证明ATAD2与肺癌、子宫内膜癌、肾细胞癌等恶性肿瘤的不良预后相关[15]。
目前,关于ATAD2在胃腺癌中的研究相对较少,有研究通过免疫组化法仅检测其在胃癌与邻近非肿瘤组织中的表达[16],而胃癌的发生是一个多阶段演进的过程,该研究并未检测ATAD2在不同病变胃组织中的表达。本文通过RT-qPCR、免疫组化法检测显示,ATAD2在胃腺癌中mRNA及蛋白水平均高于相应癌旁相对正常组织,这与黄国全等[16]在胃癌中的研究结果相一致。另外,本文通过检测不同病变胃组织中ATAD2的表达水平,结果显示ATAD2在高级别上皮内瘤变、胃腺癌中的表达高于低级别上皮内瘤变,在低级别上皮内瘤变中的表达高于慢性浅表性及慢性萎缩性胃炎,而ATAD2在胃腺癌与高级别上皮内瘤变、慢性浅表性胃炎与慢性萎缩性胃炎之间的表达却没有统计学差异。已有研究显示,ATAD2在宫颈癌、高级别上皮内病变中的表达升高,高于在宫颈正常上皮及宫颈低级别上皮内病变组织中的表达,高表达的ATAD2可以促进宫颈癌细胞的增殖、转移和侵袭[17]。本文的研究结果显示,ATAD2在胃腺癌mRNA及蛋白水平表达均升高,提示ATAD2参与了胃腺癌的发生过程,ATAD2蛋白在非瘤变胃组织中不表达,在低级别上皮内瘤变组织中出现了少量表达,而在高级别上皮内瘤变及胃腺癌组织中的表达明显增多,提示ATAD2是胃腺癌发生过程中的一个早期事件,对某些胃黏膜病变性质的判定具有重要的参考价值。
本文通过分析ATAD2与胃腺癌临床病理特征的关系显示,ATAD2的表达与肿瘤的大小、分化程度相关。在低分化胃腺癌组中ATAD2的表达明显升高,高于在高中分化胃腺癌组中的表达,这与KRAKSTAD等[18]在子宫内膜癌中的研究结果一致,该研究发现ATAD2在子宫内膜癌中的表达水平与子宫内膜癌的分级相关;在肿瘤直径大于5 cm的病人组中ATAD2的表达升高,高于肿瘤直径小于5 cm的病人组中的表达,这提示ATAD2参与了胃腺癌的发展过程。目前研究表明,ATAD2可以促进多种恶性肿瘤细胞的增殖[7,19],这提示在胃腺癌中,ATAD2可能通过影响胃腺癌细胞的增殖过程,从而影响胃腺癌的进展。本文免疫组化结果显示ATAD2的表达与TNM分期、淋巴结转移及浸润深度无关,与黄国全等[16]的研究结果不一致,推测与样本选取不同有关,本文的研究对象为胃腺癌,而黄国全等[16]的研究对象为胃癌;另外,临床病理特征的分组标准也存在一定差异。目前,国内外关于ATAD2在胃腺癌中的研究相对较少,相关结果有待进一步验证。
综上所述,ATAD2可能参与了胃腺癌的发生、发展过程,是胃腺癌发生过程中的一个早期事件,对某些胃黏膜病变性质的判定有重要的参考价值;ATAD2在胃腺癌细胞中发挥的具体生物学作用及影响癌细胞生物学行为的具体分子机制,需要在以后的研究中进一步探讨。
[参考文献]
[1] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[2] AJANI J A, LEE J, SANO T, et al. Gastric adenocarcinoma[J]. Nat Rev Dis Primers, 2017,3:1-19.
[3] HOU M M, HUANG R, SONG Y N, et al. ATAD2 overexpression is associated with progression and prognosis in colo-rectal cancer[J]. Jan J Clin Oncol, 2016,46(3):222-227.
[4] HWANG H W, HA S Y, BANG H, et al. ATAD2 as a poor prognostic marker for hepatocellular carcinoma after curative resection[J]. Cancer Res Treat, 2015,47(4):853-861.
[5] KALASHNIKOVA E V, REVENKO A S, GEMO A T, et al. ANCCA/ATAD2 overexpression identifies breast cancer patients with poor prognosis, acting to drive proliferation and survival of triple-negative cells through control of B-Myb and EZH2[J]. Cancer Res, 2010,70(22):9402-9412.
[6] WAN W N, ZHANG Y X, WANG X M, et al. ATAD2 is highly expressed in ovarian carcinomas and indicates poor prognosis[J]. Asian Pac J Cancer Prev, 2014,15(6):2777-2783.
[7] LUO Y, YE G Y, QIN S L, et al. ATAD2 overexpression identifies colorectal cancer patients with poor prognosis and drives proliferation of cancer cells[J]. Gastroent Res Pract, 2015, 2015(2015):1-8.
[8] ZHENG L, LI T R, ZHANG Y, et al. Oncogene ATAD2 promotes cell proliferation, invasion and migration in cervical cancer[J]. Oncology Reports, 2015,33(5):2337-2344.
[9] LU W J, CHUA M S, SO S K. Suppression of ATAD2 inhi-bits hepatocellular carcinoma progression through activation of p53-and p38-mediated apoptotic signaling[J]. Oncotarget, 2015,6(39):41722-41735.
[10] CATTANEO M, MOROZUMI Y, PERAZZA D, et al. Lessons from yeast on emerging roles of the ATAD2 protein family in gene regulation and genome organization[J]. Mol Cells, 2014,37(12):851-856.
[11] REVENKO A S, KALASHNIKOVA E V, GEMO A T, et al. Chromatin loading of E2F-MLL complex by cancer-associated coregulator ANCCA via reading a specific histone mark[J]. Mol Cell Biol, 2010,30(22):5260-5272.
[12] HSIA E Y, KALASHNIKOVA E V, REVENKO A S, et al. Deregulated E2F and the AAA+ coregulator ANCCA drive proto-oncogene ACTR/AIB1 overexpression in breast cancer[J]. Mol Cancer Res, 2010,8(2):183-193.
[13] 刘芬,王彦,李宏,等. ATAD2在不同病变肝组织中的表达及意义[J]. 齐鲁医学杂志, 2017,32(2):158-161.
[14] MOROZUMI Y, BOUSSOUAR F, TAN M, et al. Atad2 is a generalist facilitator of chromatin dynamics in embryonic stem cells[J]. J Mol Cell Biol, 2016,8(4):349-362.
[15] WANG D, PAN Y, HAO T, et al. Clinical and prognostic significance of ANCCA in squamous cell lung carcinoma patients[J]. Arch Med Res, 2016,47(2):89-95.
[16] 黄国全,孙建华,吴泉峰. 三磷酸腺苷酶家族蛋白2过表达作为胃癌预后标志物可行性研究[J]. 实用医院临床杂志, 2016,13(6):29-32.
[17] 杨薇,徐梅梅,夏凤宇,等. 下调ATAD2表达对胃癌细胞增殖的影响及其机制探讨[J]. 山东医药, 2015,55,(8):29-30.
[18] KRAKSTAD C, TANGEN I L, HOIVIK E A, et al. ATAD2 overexpression links to enrichment of B-MYB translational signatures and development of aggressive endometrial carcinoma[J]. Oncotarget, 2015,6(29):28440-28452.
[19] WU G, LIU H, HE H, et al. miR-372 down-regulates the oncogene ATAD2 to influence hepatocellular carcinoma proliferation and metastasis[J]. BMC Cancer, 2014,14(107):1-9.

