Ag3PO4/BiPO4复合光催化剂的制备及其降解罗丹明B的研究
刘向辉,杨巧文,徐 菁
(中国矿业大学(北京)化学与环境工程学院, 北京 100083)
自1972年Fujishima 和 Honda发现利用 TiO2作电极在紫外光的照射下将水分解为 H2和 O2后,光催化技术就引起了人们的广泛关注[1],并开始在处理环境问题中有了较好的应用。
BiPO4作为一种新型的非金属含氧酸盐光催化剂,具有电子-空穴复合率低稳定性强的特点,正逐步应用在光催化领域,然而BiPO4具有太大的禁带宽度(3.8 eV),只能在320 nm以下产生紫外响应,不能有效利用太阳能;因此,对BiPO4结构进行适当调控改变其禁带宽度成为研究的热点[2-5]。
近年来,CdS、Ag基半导体材料与BiPO4能够形成异质结结构,从而有效对结构进行调控。采用微波辅助合成的CdS/BiPO4复合催化剂在500 nm下对MO去除率能够达到98%[6];水热法和溶剂热法制备的CdS/BiPO4复合光催化对MB的催化活性是单独CdS的2.1倍[7];卤化银作为无机光敏材料也具有很好的光催化活性,与BiPO4复合可以克服光照条件易分解的缺点,故将它与半导体复合进行光催化实验。AgBr在460 nm下对亚甲蓝的去除是纯BiPO4的9倍[8];AgI/BiPO4对RhB 降解比单独AgI提升了36.5%[9];10%AgBr/BiPO4(原子分数)对MB的降解性能是BiPO4的3倍,50%AgBr/BiPO4(原子分数)对苯酚的降解性能是BiPO4的2倍[10];可见光下Ag/AgCl/BiPO4对RhB 的光催化性能是BiPO4的30倍,并且对MB和MO也具有很好的效果[11];此外,铋基半导体材料(BiVO4、BiMoO6、BiOI、BiOCl、BiOBr等)与BiPO4复合也可以有效提升复合材料的光催化活性[12-17]。
Ag3PO4也是常用的Ag基半导体材料,具有价带位置比较低,且导带有反 π 键的特点,逐步应用在光催化领域能够使电子的迁移率远大于空穴,使得光生电子与空穴能够得到分离[18];但缺点是成本高。将BiPO4与Ag3PO4进行复合改性,可以形成异质结构,其机理为:利用半导体的能级差使光生载流子由一种半导体的能级转入另一半导体的能级上,实现电荷的有效分离,从而扩宽光谱响应范围[6]。
本研究利用水热法合成Ag3PO4/BiPO4复合光催化剂,通过控制前驱液的 pH、BiPO4与 Ag3PO4的复合比例制备了不同的 Ag3PO4/BiPO4复合光催化剂,与纯相BiPO4进行对比,并进行表征分析。
1 实验过程
1.1 BiPO4的制备
称取 4 mmol的 Bi(NO3)3·5H2O 溶解于 5 mL 的 2 mol/L 稀硝酸中,记为溶液 A 。称取 4 mmol的 Na3PO4·12H2O 溶解于 75 mL 去离子水中,记为溶液 B。在磁力搅拌下将 B 溶液逐渐加入到 A 中,待溶液滴加结束后用 2 mol/L NaOH 溶液调节前驱液的 pH,再磁力搅拌 15 min。将前驱液转入具有聚四氟乙烯内衬的高压反应釜中,放入恒温干燥箱,在 180℃下恒温反应 24 h。反应完成后取出反应釜,自然冷却至室温,之后取出反应釜中的沉淀,用大量蒸馏水和无水乙醇洗涤数次,于60 ℃恒温干燥 12 h,制得样品。
1.2 Ag3PO4/BiPO4的制备
第1组将 4 mmol 的 Bi(NO3)3·5H2O 和 3 mmol 的 AgNO3加入到 30 mL 去离子水的烧杯中,用磁力搅拌器搅拌 0.5 h 以达到均相,加入 4 mmol的 Na3PO4·12H2O,继续搅拌 0.5 h。然后用浓硝酸和 NaOH 溶液调节 pH 分别为3、5、7、9。将水热高压反应釜密封后放入烘箱在 180 ℃下反应 72 h,而后将得到的产物用去离子水与无水乙醇离心洗涤3次,在 60 ℃下干燥 24 h。第2组控制合成复合光催化剂的水热反应体系 pH 为 7.0,其他反应条件均一致。控制 Ag3PO4/BiPO4复合催化剂中BiPO4与Ag3PO4的摩尔比分别为4 ∶1、2 ∶1、4 ∶3和1 ∶1。
1.3 样品的光催化性能测试
采用可见光照射下降解罗丹明B对所合成的样品进行光催化测试。配制质量浓度为 10 mg/L的罗丹明B水溶液,取0.1 g的光催化剂样品分散于60 mL的罗丹明B水溶液中,避光磁力搅拌30 min后,在氙灯(500 W,λ>420 nm)的照射下,每隔5 min取5 mL上清液离心分离测吸光度,在最大波长处测吸光度来确定降解过程中罗丹明 B 的浓度变化。
D=(C0-Ct)/C0。
式中:D为降解率;C0为初始溶液的浓度;Ct为各反应时刻的浓度。
1.4 表征方法
利用日本理学公司 D/MAX2500 型 X 射线衍射仪进行物相结构分析,采用 CuKɑ辐射,扫描范围 2θ为 20°~80°,扫描速度为 10 (°)/min,λ=0.154 06 nm,管电压 40 kV,管电流 200 mA。利用北京中科科技有限公司 KYKY-2008 型扫描电子显微镜 (SEM) 和日本日立公司 H-7650 型透射电子显微镜 (TEM) 表征样品的表面形貌。利用日本日立公司的 U-4100 型紫外可见近红外分光光度计测定样品的光吸收性能。利用上海雷勃生物技术有限公司的 FluoroskanAscentFL 型荧光化学发光检测仪测定样品的荧光强度。
2 表征及分析
2.1 XRD 物相分析
2.1.1 复合比例的影响
图1为不同复合比例下合成的 Ag3PO4/BiPO4的 XRD 图。可知Ag3PO4/BiPO4的XRD 图谱中显示的物相主要为单斜相结构 BiPO4,BiPO4的标准卡片(JCPDS卡号:01-080-0209)与其相对应,其中有部分 Ag3PO4的特征峰与BiPO4的峰重合,所以几乎看不到Ag3PO4的特征峰。随着Ag3PO4含量的增加,独居石相BiPO4含量逐步增加,六方相也在逐步增加,但不同复合比例下仍然是单斜相结构为主。
2.1.2 pH影响
不同pH下合成的Ag3PO4/BiPO4的XRD图谱如图2所示。
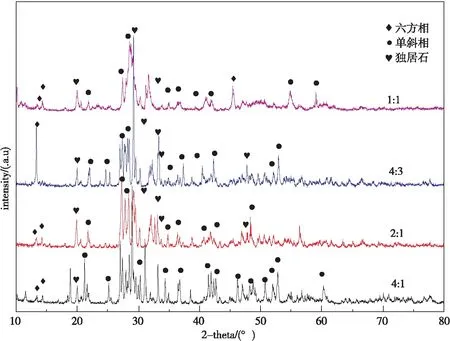
图1 不同复合比例下合成的 Ag3PO4/BiPO4 XRD 图谱
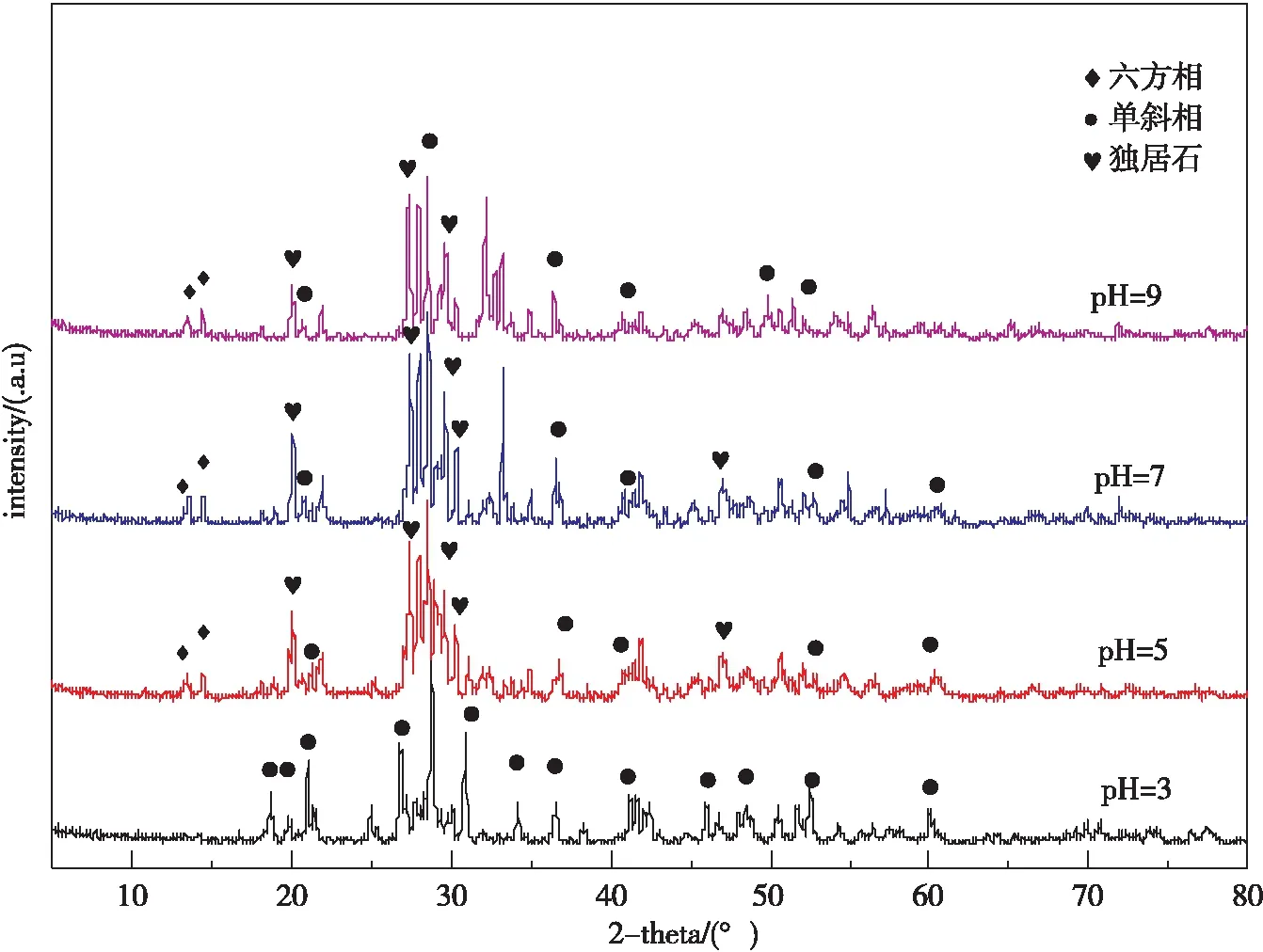
图2 不同pH下合成的 Ag3PO4/BiPO4 XRD 图谱
由图2可以看出:水热合成 pH 为 3 时,图谱中主要是单斜相结构的BiPO4的衍射峰;pH 为5、7、9 时图中BiPO4峰出现独居石和六方相,独居石相BiPO4较单斜相成为单斜相和独居石结构混合结构。随 pH 的增大,衍射峰较多、峰宽变长、峰强变大,表明晶型发生变化,其变为单斜相与单斜相独居石结构的混合结构。随着 pH 的增大,BiPO4的晶型由单斜相变为单斜相与单斜相独居石的混合结构,即单相变为多相晶型。由此说明,前驱液 pH 值对合成 BiPO4的晶型影响比较大,而在pH为7下合成的纯相BiPO4样品XRD 图谱卡片 (PDF#01-089-0278) 基本一致(未列出),衍射峰较少并且比较尖锐,其晶型主要是单斜相结构。
2.2 SEM分析
图3为BiPO4、Ag3PO4和Ag3PO4/BiPO4的扫描电镜图,扫描电镜图是放大 5 000 倍后的 SEM 图。从图3(a) 可以观察到,Ag3PO4为球型结构,其半径大小约为 5~15 μm,形貌与大小均匀。从图3(b)可以观察到,制备的 BiPO4主要呈现出外形比较规则的微米级棒状结构[10],同时也存在一些片状结构。棒状结构长度为(4±2) μm,宽为 1 μm左右,形貌均一。片状结构的大小为5~10 μm。从图 3(c)和(d)可以看出,随着反应物中 Ag 含量增加,复合物的形貌中球状结构增加,通过对比我们明显能看到棒状物相中掺杂着球型物相,表明物相为Ag3PO4和BiPO4共存相[11],复合物的尺寸为 5~15 μm。

图3 BiPO4(a)、Ag3PO4(b)、Ag3PO4/BiPO4(4 ∶3)(c)、Ag3PO4/BiPO4(1 ∶1)(d) 样品的SEM 图
2.3 荧光分析
在光催化反应中,光生电子与空穴的复合影响其光催化性能,而光致发光光谱是检测半导体光学性质的有效方法,能够反映出光生载流子的复合情况。低的荧光发射强度能够表明较低的电子与空穴复合效率,从而对应更高的光催化活性[12]。从图4可以看出:摩尔比为1 ∶1的样品表现出更低的发射强度;Ag 的含量越高,光生电子与空穴复合的效率越低,从而导致其较高的光催化活性,摩尔比为4 ∶3的样品的发射强度较2 ∶1也低出好多,催化活性也较好。
2.4 紫外漫反射 DRS 分析
根据实验处理效果选取Ag3PO4/BiPO4(4 ∶3)紫外进行可见漫反射吸收光谱分析并与BiPO4进行对比,如图5所示。可以看出:纯的 BiPO4的吸收边缘分别是 340 nm, BiPO4对可见光的吸收最弱,而 BiPO4掺杂 Ag3PO4之后对可见光的吸收增加。这说明复合 Ag3PO4之后 BiPO4对可见光的响应增加。

图4 所制备出的Bi与Ag的摩尔比为1 ∶1、4 ∶3、2 ∶1的样品的光致发光光谱
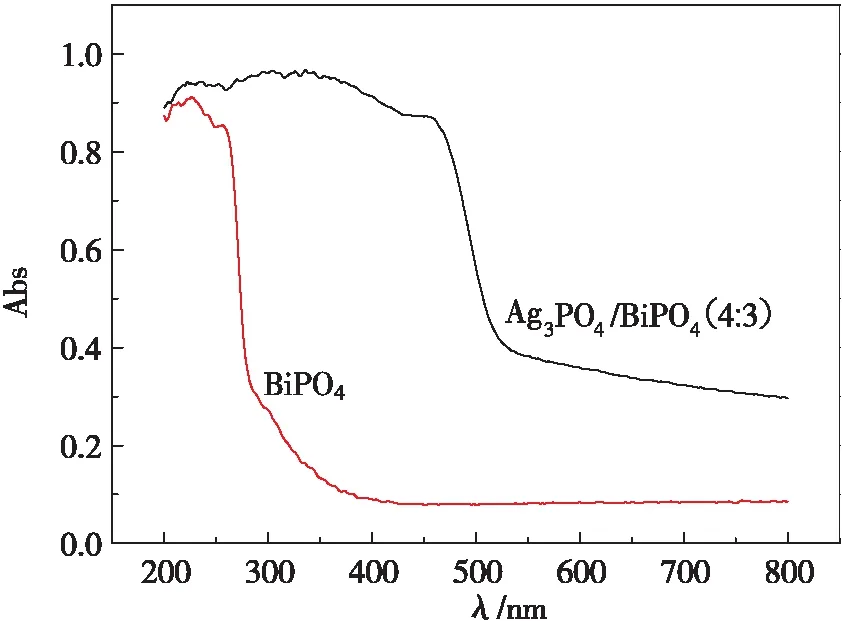
图5 BiPO4和 Ag3PO4/BiPO4(4 ∶3)的紫外-可见漫反射吸收谱图
根据半导体导带公式:αhν=C(hv-Eg)1/2,可知(hv)1/2只与hν成线性关系,能用于估算禁带宽度Eg。
由朗伯-比尔定律可知,A=abc,a是吸光系数,b是比色皿或者薄膜样品厚度,c是浓度。b,c是固定值,a=A/bc=A/K。禁带公式可写成如下形式:
(1)
K值的大小对Eg没有影响,以hv为横坐标,以(Ahν)2为纵坐标,作图6,再做切线,利用直线部分外推至横坐标交点,即可得到禁带宽度值Eg。如图所示可以计算得出BiPO4禁带宽度为4.49 eV,而Ag3PO4/BiPO4(4 ∶3)为 2.73 eV,禁带宽度的降低表明 Ag3PO4/BiPO4(4 ∶3)半导体材料有更合适的能带结构来光催化降解有机污染物[13]。

图6 BiPO4和Ag3PO4/BiPO4(4 ∶3)样品 UV-Vis DRS 谱和光子吸收度(Ahν)2对光子能量(hν)变化的关系图
3 结果与讨论
3.1 pH对光催化性能的影响
图7是 Bi 与Ag在一定的复合比例下,不同 pH 制备条件下合成的 Ag3PO4/BiPO4样品的可见光催化罗丹明B的降解率-时间图。可以看出:pH 值对Ag3PO4/BiPO4的光催化活性影响较大,在 pH=7 时合成的 Ag3PO4/BiPO4样品催化活性最高,3 h 时降解率50%;pH继续增加到9,复合光催化剂活性下降。分析原因:随着 pH 值的增大,由于 BiPO4发生了较大的晶相转变。不同晶型的BiPO4空间结构如图8所示,独居石结构的BiPO4由于PO4四面体的扭曲程度最大,产生的偶极矩最大,因而最有利于电子-空穴的分离,使得光催化活性最高,单斜相次之,六方相最差。
开始主要是单斜相物相,pH升高时,独居石相BiPO4含量增多,独居石较单斜相降解污染物的效率高,主要原因是其电子空穴分离效率高[19]。当pH=9时六方相BiPO4含量增加,单斜相含量减少,而六方相扭曲程度最小,产生的偶极矩小,不利于电子-空穴的分离,从而降低了光催化活性。
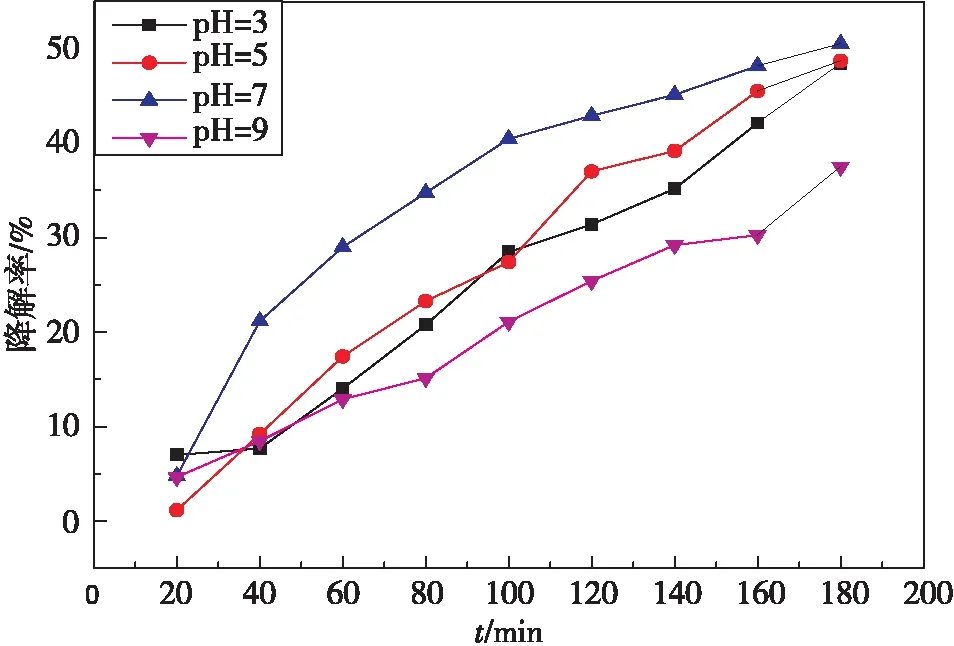
图7 不同 pH 下合成的 Ag3PO4/BiPO4对罗丹明B的可见光催化降解图
3.2 复合比例对光催化性能的影响
图9 为最佳条件 pH 下不同 Ag3PO4复合比例的 BiPO4光催化降解图。可知,复合比例为 1 ∶1时,Ag3PO4/BiPO4的光催化降解效率在各个时段最高。分析原因为:Ag3PO4的催化能力远大于BiPO4,BiPO4的表面复合上 Ag3PO4之后光催化能力得到提高,Ag3PO4/BiPO4光催化性能增强[21],但对比发现,从复合比例4 ∶3到1 ∶1随复合量增加光催化性能提升不是特别明显;因此,选取复合比例为4 ∶3为最优比例。
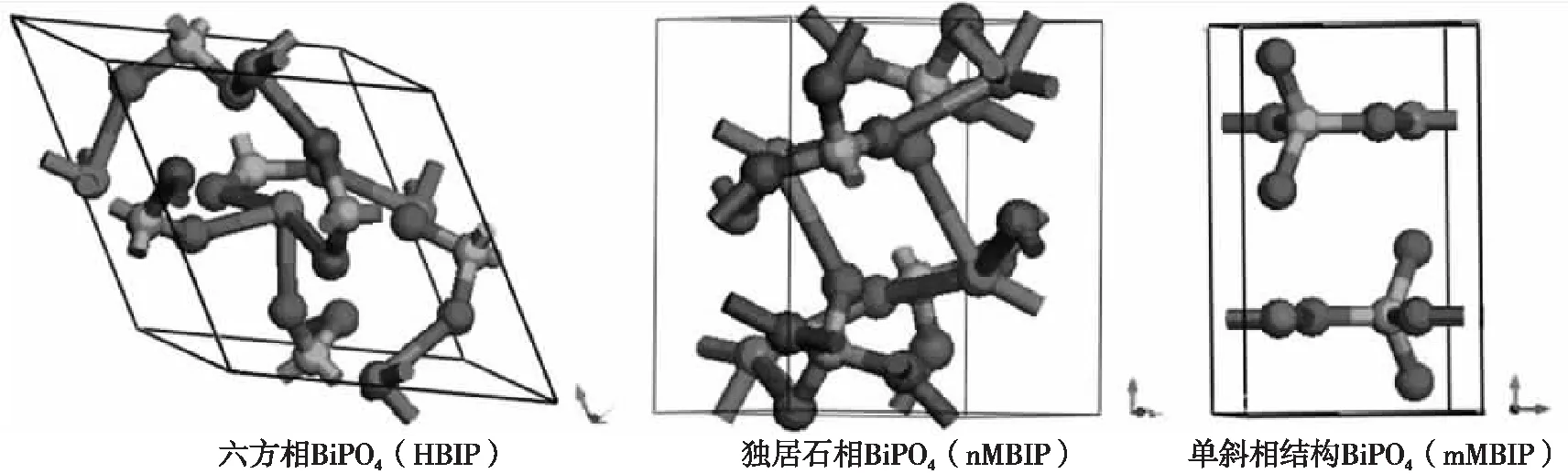
图8 3种BiPO4的晶体结构
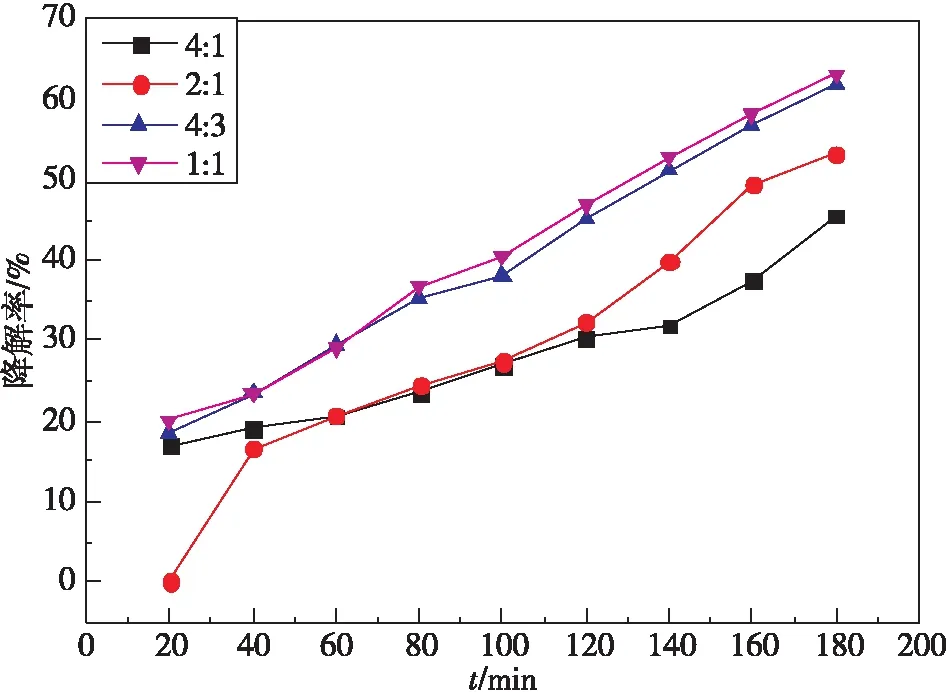
图9 不同复合比例下合成的Ag3PO4/BiPO4对罗丹明B的可见光催化降解图
3.3 光催化性能对比
BiPO4和Ag3PO4/BiPO4对罗丹明B的可见光催化降解对比如图10所示。复合比例为4 ∶3的Ag3PO4/BiPO4光催化降解紫外扫描图如图11所示。
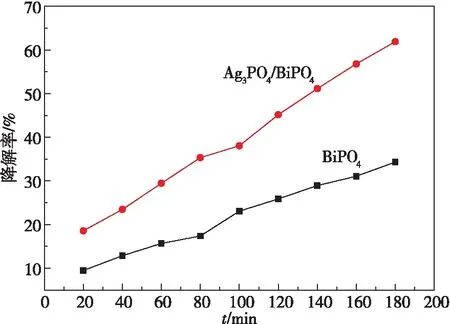
图10 BiPO4和Ag3PO4/BiPO4 对罗丹明B的可见光催化降解图
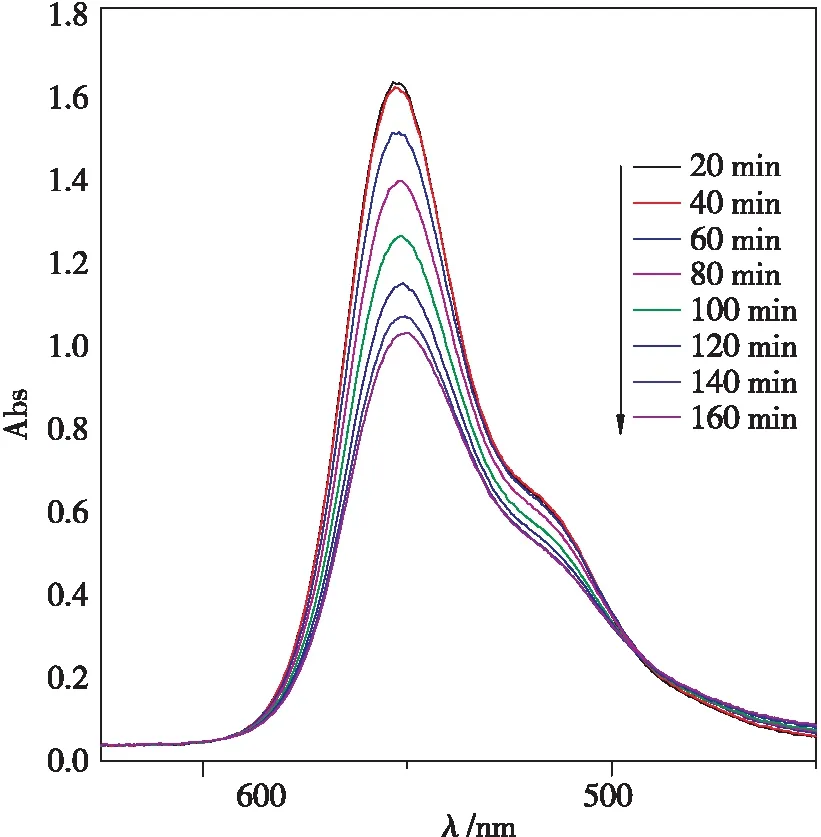
图11 复合比例为4 ∶3的 Ag3PO4/BiPO4光催化降解紫外扫描图
从图11可以明显看出:比例为 4 ∶3的 Ag3PO4/BiPO4在 60 min 时光降解率就达到了30%,而BiPO4对罗丹明B的降解才达到15%;在光降解时间达到 180 min时,Ag3PO4/BiPO4降解罗丹明B达到61%,纯相 BiPO4对罗丹明B的降解仅为 34 %,复合催化剂较纯相 BiPO4光催化效果提升了27%,且复合催化剂在80 min时就达到了纯相BiPO4180 min的降解效果。由此得出结论:复合 Ag3PO4后,从前面表征分析可以看出,复合光催化剂中BiPO4晶型中出现了独居石结构,独居石光催化性能较好,复合光催化剂禁带变宽,电子与空穴复合效率增强,对可见光的响应增加,从而导致催化剂的催化性能大大提高。从图11亦可以看到,复合催化剂对罗丹明B具有较好的降解能力。
4 结论
通过水热法在不同pH和复合比例下制备Ag3PO4/BiPO4复合载体,并进行光催化降解实验。结果表明在pH为7水热合成复合比例Ag3PO4/BiPO4摩尔比为4 ∶3条件下光催化降解效果最好,降解 180 min 后,对罗丹明B的降解达到 61%,较纯相BiPO4提升了27%。
通过XRD和SEM分析证明了复合催化剂中的Ag3PO4和BiPO4的存在,且在最佳条件下合成的复合催化剂中BiPO4存在较多的独居石型BiPO4。
紫外-可见漫反射光谱和荧光分析表明:复合Ag3PO4之后 BiPO4的禁带宽度变窄,对可见光的响应增加,且复合催化剂光生电子与空穴合的效率变低,从而导致其较高的光催化活性。
参 考 文 献
[1] 潘成思. BiPO4含氧酸盐新型光催化剂的可控合成及构效关系研究[D]. 北京:清华大学, 2011.
[2] LIU Y, YAO W, LIU D, et al. Enhancement of visible light mineralization ability and photocatalytic activity of BiPO4/BiOI[J]. Applied Catalysis B-Environmental,2015, 163: 547-553.
[3] ZHU Y, LIU Y, LV Y, et al. Enhancement of photocatalytic activity for BiPO4via phase junction[J]. Journal of Materials Chemistry A, 2014, 2(32): 13041-13048.
[4] LV Y, ZHU Y, ZHU Y. Enhanced photocatalytic performance for the BiPO4-x nanorod induced by surface oxygen vacancy[J]. Journal of Physical Chemistry C,2013, 117(36): 18520-18528.
[5] PAN C, XU J, WANG Y, et al. Dramatic activity of C3N4/BiPO4photocatalyst with core/shell structure formed by self-assembly[J]. Advanced Functional Materials, 2012, 22(7): 1518-1524.
[6] LV T, PAN L, LIU X, et al. Enhanced visible-light photocatalytic degradation of methyl orange by BiPO4-CdS composites synthesized using a microwave-assisted method[J]. Rsc Advances, 2012, 2(33): 12706-12709.
[7] CHEN D, KUANG Z, ZHU Q, et al. Synthesis and characterization of CdS/BiPO4heterojunction phototcatalyst[J]. Materials Research bulletin, 2015, 66: 262-267.
[8] XU H, XU Y, LI H, et al. Synthesis, characterization and photocatalytic property of AgBr/BiPO4heterojunction photocatalyst[J]. Dalton Trans, 2012, 41(12): 3387-3394.
[9] YE H, LIN H, CAO J, et al. Enhanced visible light photocatalytic activity and mechanism of BiPO4nanorods modified with AgI nanoparticles[J]. Journal of Molecular Catalysis A: Chemical,2015, 397: 85-92.
[10] WANG D, YUE L, GUO L, et al. AgBr nanoparticles decorated BiPO4microrod: a novel p-n heterojunction with enhanced photocatalytic activities[J]. Rsc Advances,2015, 5(89): 72830-72840.
[11] SHAN P, NIU C, HUANG D, et al. Facile synthesis of Ag/AgCl/BiPO4plasmonic photocatalyst with significantly enhanced visible photocatalytic activity and high stability[J]. Rsc Advances, 2015, 5(108): 89105-89112.
[12] DUO F, WANG Y, MAO X, et al. A BiPO4/BiOCl heterojunction photocatalyst with enhanced electron-hole separation and excellent photocatalytic performance[J]. Applied Surface Science,2015, 340: 35-42.
[13] WU Z, LIU J, TIAN Q, et al. Efficient visible light formaldehyde oxidation with 2D p-n heterostructure of BiOBr/BiPO4nanosheets at room temperature[J]. Acs Sustainable Chemistry & Engineering,2017, 5(6): 5008-5017.
[14] LIU Y, YAO W, LIU D, et al. Enhancement of visible light mineralization ability and photocatalytic activity of BiPO4/BiOCl[J]. Applied Catalysis B-Environmental,2015, 163: 547-553.
[15] HU Y, JIA Z, LV R, et al. One-pot electrochemical preparation of BiOCl/BiPO4double-layer heterojunction film with efficient photocatalytic performance[J]. Materials Research Bulletin,2017, 94: 222-230.
[16] LIU Q, LIN B, LI P, et al. Preparation of BiPO4/BiVO4composites with high visible-light photocatalytic activity[J]. Chemical Journal of Chinese Universities-chinese,2017, 38(1): 94-100.
[17] ZOU X, DONG Y, ZHANG X, et al. The highly enhanced visible light photocatalytic degradation of gaseous o-dichlorobenzene through fabricating like-flowers BiPO4/BiOBr p-n heterojunction composites[J]. Applied Surface Science,2017, 391(SIB): 525-534.
[18] 刘永红,张馨,李大塘,等. BiPO4/Ag3PO4新型可见光催化剂的制备及其性能研究[J]. 湖南科技大学学报(自然科学版),2013(1): 98-101.
[19] SATO J, KOBAYASHI H, INOUE Y. Photocatalytic activity for water decomposition of indates with octahedrally coordinated (10) configuration. II. Roles of geometric and electronic structures[J]. Journal of Physical Chemistry B, 2003, 107(31): 7970-7975.
[20] PAN C, LI D, MA X, et al. Effects of distortion of PO4tetrahedron on the photocatalytic performances of BiPO4[J]. Catalysis Science & Technology,2011, 1(8): 1399-1405.
[21] GUAN M, SUN J, TAO F, et al. A host crystal for the rare-earth ion dopants: synthesis of pure and Ln-doped urchinlike BiPO4structure and its photoluminescence[J]. Crystal Growth & Design,2008, 8(8): 2694-2697.

