用响应曲面法优化豌豆蛋白酶解条件
李 慧, 王 琪, 王鑫烁, 周泉城*
(1.山东理工大学农业工程与食品科学学院食品科学系,山东 淄博 255049;2.农产品功能化技术山东省高校重点实验室, 山东 淄博 255049)
豌豆(PisumsativumLinn)是我国的主要农作物之一,在我国又被称为青豆、荷兰豆、回鹘豆、国豆和毕豆等。豌豆蛋白含有人体必需的所有氨基酸,属于全价蛋白质。氨基酸比例均衡,其中赖氨酸含量较多,蛋氨酸含量较低,其余的含量均达到FAO/WHO推荐模式值[1]。 目前我国对于豌豆的深加工以淀粉制作粉丝为主,其中的蛋白质随残渣冲走,这不仅造成了极大的资源浪费还污染了环境[2]。研究[3]表明,随着人们生活水平的不断提高,蛋白质的需求量也不断增加,但是却有许多优质的植物蛋白质不能得到有效的利用;因此,急需找到将这部分作为副产物的优质植物蛋白资源加工为高附加值产品的方法[4]。
在豌豆的酶解产物中,存在着大量的生物活性肽。这些活性肽对于人体有着一定的益处,具有相当巨大的开发潜力[5]。豌豆酶解产物中的抗氧化肽、降血压肽、降血脂肽和抑菌肽等作为纯天然的添加剂,可以用于功能性食品的开发,为豌豆蛋白的综合利用提供新的研究方向,提高豌豆蛋白的利用率和使用价值[6-7],使豌豆的应用范围进一步扩大。
本文以含水量为30%的豌豆蛋白为原料,用中性蛋白酶酶解豌豆蛋白,以DPPH和·OH自由基清除率为抗氧化评价指标,通过响应曲面试验优化豌豆蛋白的酶解条件并建立酶解产物自由基清除率预测模型,从而为豌豆的开发利用和加工拓宽思路、提供参考,以提高豌豆的经济附加值。
1 材料与方法
1.1 材料与仪器
豌豆蛋白粉,主要组成为水分4.6%±0.02%,蛋白质73.2%±0.23%,粗脂肪0.22%±0.01%,灰分4.62%±0.03%,购自烟台双塔食品股份有限公司;所用试剂均为分析纯。
RE200型旋转蒸发仪,雅马拓科技贸易(上海)有限公司;FD-C10N型台式冷冻干燥机,冠森生物科技(上海)有限公司;WHZ-2 数显水浴恒温振荡器,常州市万丰仪器制造有限公司。
1.2 实验方法
称取2 kg豌豆蛋白粉加入一定质量的蛋白酶和一定pH值的磷酸盐缓冲溶液,摇匀,置于恒温振荡水浴锅中,振荡酶解3 h,结束后,沸水浴灭酶10 min。冷却后,将蛋白酶解液过滤,取滤液待测[8]。
1.3 豌豆蛋白酶解参数的响应面优化
采用中性蛋白酶酶解豌豆蛋白,测定其抗氧活性,并利用响应曲面法优化其酶解条件。在预实验的基础上,固定酶解时间3 h,选取加酶量(A)、温度(B)、pH值(C)、底物质量分数(D)为变量进行实验设计和分析。以豌豆蛋白酶解物的抗氧化活性(DPPH清除率和·OH清除率)为响应值,设计4因素5水平共26个试验点的响应面分析实验[9]。实验方案、实验条件及结果列于表1中,进而确定最优水平,实验因子及水平见表1。
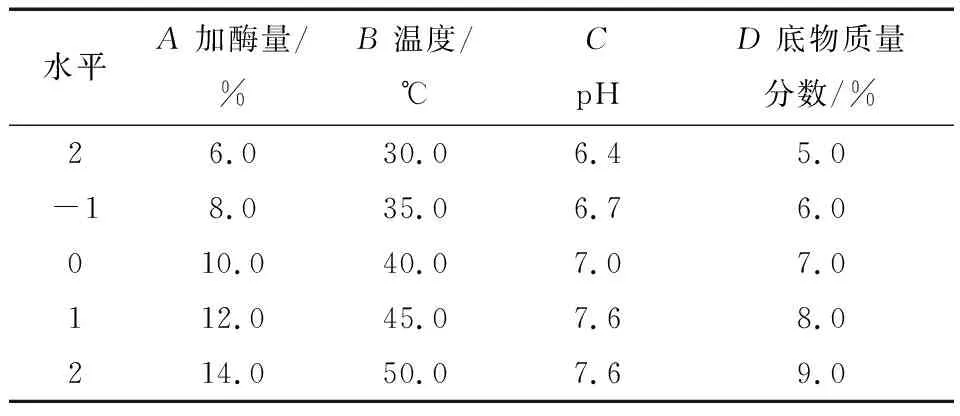
表1 因素水平表
1.4 酶解产物自由基DPPH清除率的测定
实验根据Dike Teng等[10]的方法,加以改动。实验组取滤液1 mL,加入试管中。并加入4 mL浓度为0.1 mmol/L的DPPH溶液,其中DPPH溶液用V95%乙醇∶V蒸馏水=1 ∶1的混合溶液作为溶剂配制。避光静置30 min后,在517 nm下测定吸光度(Asample)。
对照组以1 mL的蒸馏水代替滤液,实验步骤与上述相同(Acontrol)。空白组以V95%乙醇∶V蒸馏水=1 ∶1的混合溶液来代替DPPH溶液,实验步骤与上述相同(Ablank)。参比为1 mL蒸馏水和4 mL的V5%乙醇∶V蒸馏水=1 ∶1的混合溶液。
计算公式如下:
清除率=[1-(Asample-Ablank)/Acontrol]×100%。
1.5 酶解产物自由基·OH清除率的测定
根据邻二氮菲法[11],做适当修改。实验组取2 mL滤液置于试管中,加入2 mL的0.02 mol/L磷酸盐缓冲溶液(pH为7.4),再加入1 mL 1.8 mmol/L的邻二氮菲溶液和1 mL 1.8 mmol/L的FeSO4水溶液,迅速混匀。最后在混合液中加入1 mL质量分数为0.02%的双氧水,于37 ℃下水浴60 min,冷却后在536 nm下测定吸光度,记为As。
对照组以蒸馏水代替滤液,实验步骤与上述相同(Ac)。空白组用蒸馏水代替滤液和双氧水,实验步骤与上述相同(Ab)。参比为5 mL的磷酸盐缓冲溶液与2 mL蒸馏水的混合溶液。
计算公式如下:
清除率%=[(As-Ac)/(Ab-Ac)]×100 %。
1.6 数据分析
每个操作3次平行。利用SAS 9.1软件建立回归模型方程,对数据进行ANOVA分析,Duncan test确定平均值差异。
2 实验结果与分析
2.1 响应面试验结果与分析
在预实验的基础上,选取加酶量(A)、温度(B)、pH(C)、底物质量分数(D)为实验因素,以酶解物的自由基清除率为评判指标,设计4因素5水平共26个试验点的响应分析实验进行二次回归设计实验和分析。实验结果见表2。
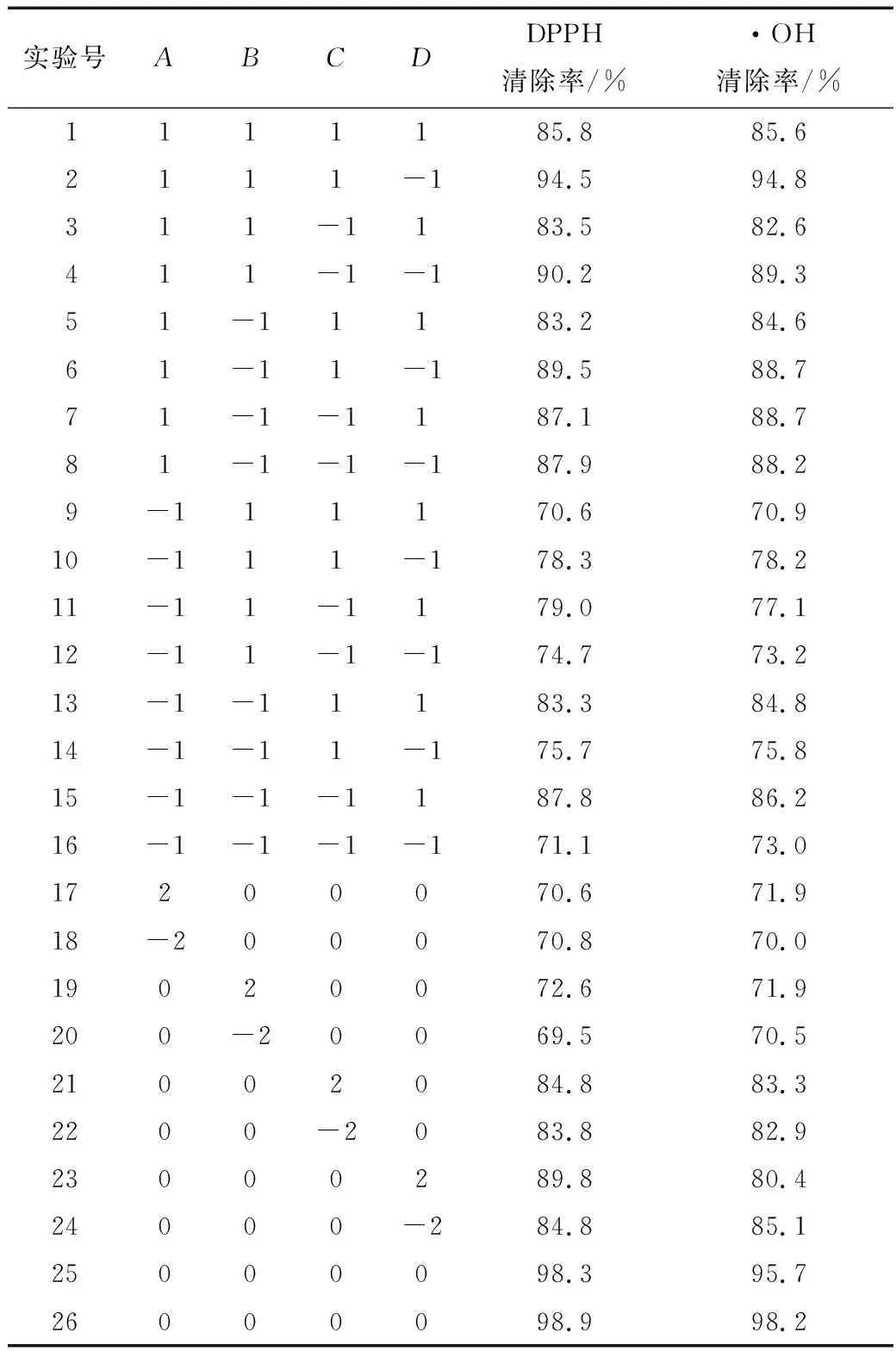
表2 响应面试验设计及结果
以DPPH清除率为响应值,经回归拟合后,中性蛋白酶酶解豌豆蛋白的DPPH清除率的回归方程为:
DPPH清除率=-2472.63366+30.33958·A+469.80509·B+102.95417·C+102.95417·D+0.13519·AB+0.95521·AC-1.35781·AD+0.17625·BC-0.44938·BD-5.93542·CD-1.56237·A2-0.24633·B2-31.75810·C2-2.10698·D2。
中性蛋白酶酶解豌豆蛋白的DPPH清除率的回归方程方差分析如表3所示。
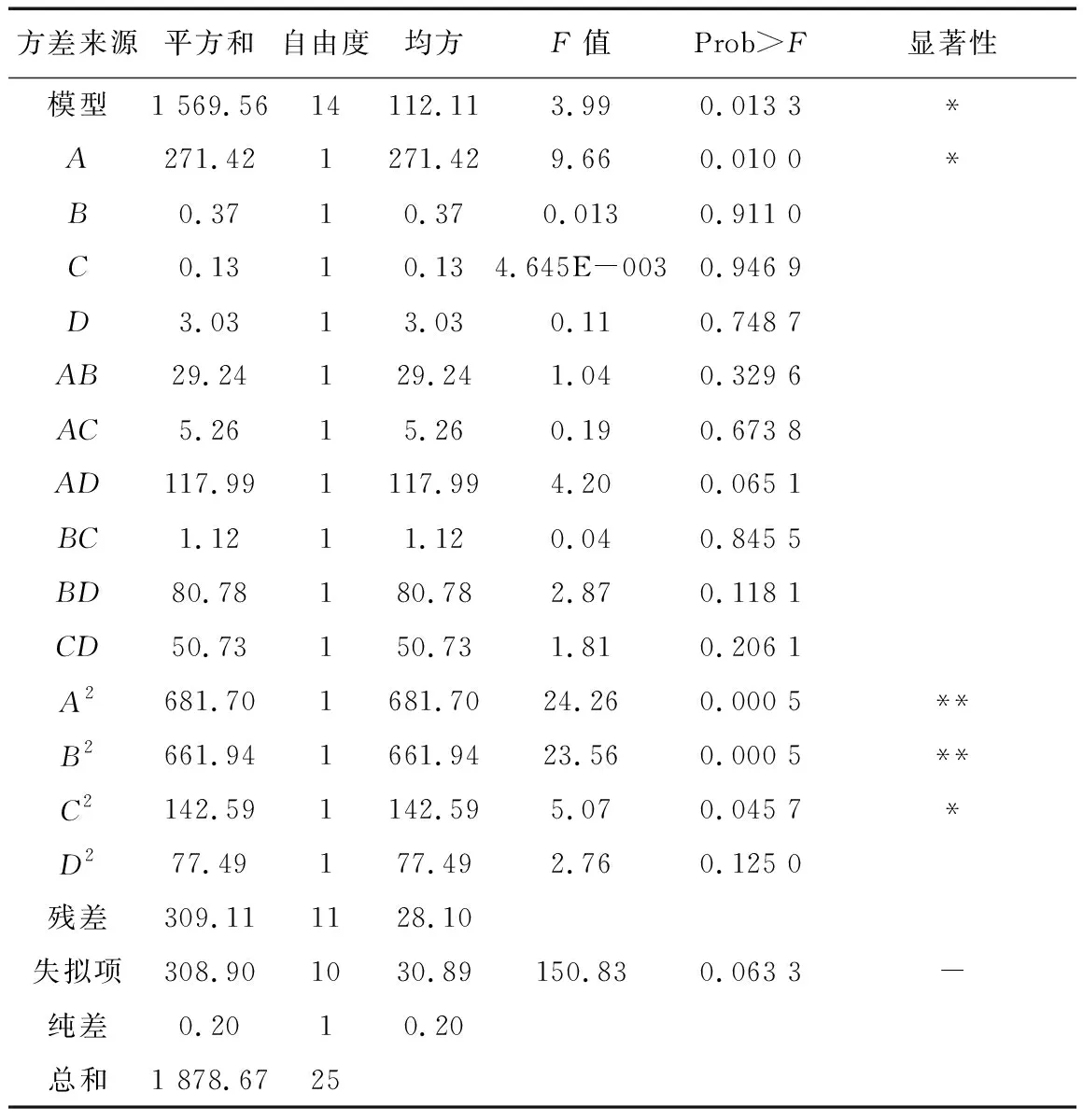
表3 DPPH清除率方差分析
由表3可以得出,所建模型是显著的,失拟项是不显著的,说明无失拟因子存在,该模型与真实测量值拟合良好,且加酶量(A)和pH的二次项(C2)影响显著,加酶量的二次项(A2)、温度的二次项(B2)影响极显著。说明在中性蛋白酶酶解豌豆蛋白过程中,加酶量、pH、加酶量的二次方、温度的二次方对DPPH清除率有显著影响。由F值可知,F越大对豌豆蛋白酶解度的影响就越大,所以各因素对豌豆蛋白酶解液DPPH清除率的影响次序:加酶量(A)>底物质量分数(D)>酶解温度(B)>pH(C)。加酶量和底物质量分数对酶解度的交互作用比其他交互作用更明显。根据回归方程作各因素及其交互作用对DPPH清除率影响的响应曲面图(见图1)。
通过响应曲面图1,可以进一步看出加酶量、pH、温度、底物质量分数,任何两因素对DPPH清除率的交互影响。由上图可以看出4因素值选择合理,验证了实验的准确性。DPPH清除率随着底物质量分数的增加而增加最终趋于平缓;而随着加酶量、pH、温度的升高先升高后降低。
以·OH清除率为响应值,经回归拟合后,中性蛋白酶酶解豌豆蛋白的·OH清除率的回归方程为:
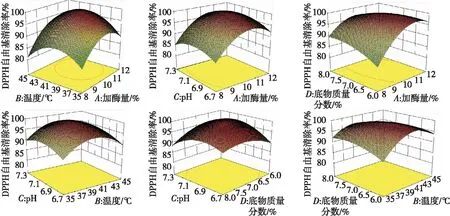
图1 DPPH清除率响应曲面图
·OH清除率=-2247.04903+30.15021·A+17.29758·B+438.60694·C+86.07625·D+0.14113·AB+0.46667·AC-1.19375·AD+0.39500·BC-0.47450·BD-4.67083·CD-1.44422·A2-0.22852·B2-30.39583·C2-1.57437·D2。
中性蛋白酶酶解豌豆蛋白的·OH清除率的回归方程方差分析如表4所示。
由表4可知,所建模型是显著的,失拟项是不显著的,说明该模型与真实测量值拟合良好。且加酶量(A)和加酶量的二次项(C2)影响极显著。由F值可知,各因素对豌豆蛋白酶解液·OH清除率的影响次序:pH(C)>底物质量分数(D)>酶解温度(B)>加酶量(A)。根据回归方程作各因素及其交互作用对·OH清除率影响的响应曲面图见图2。
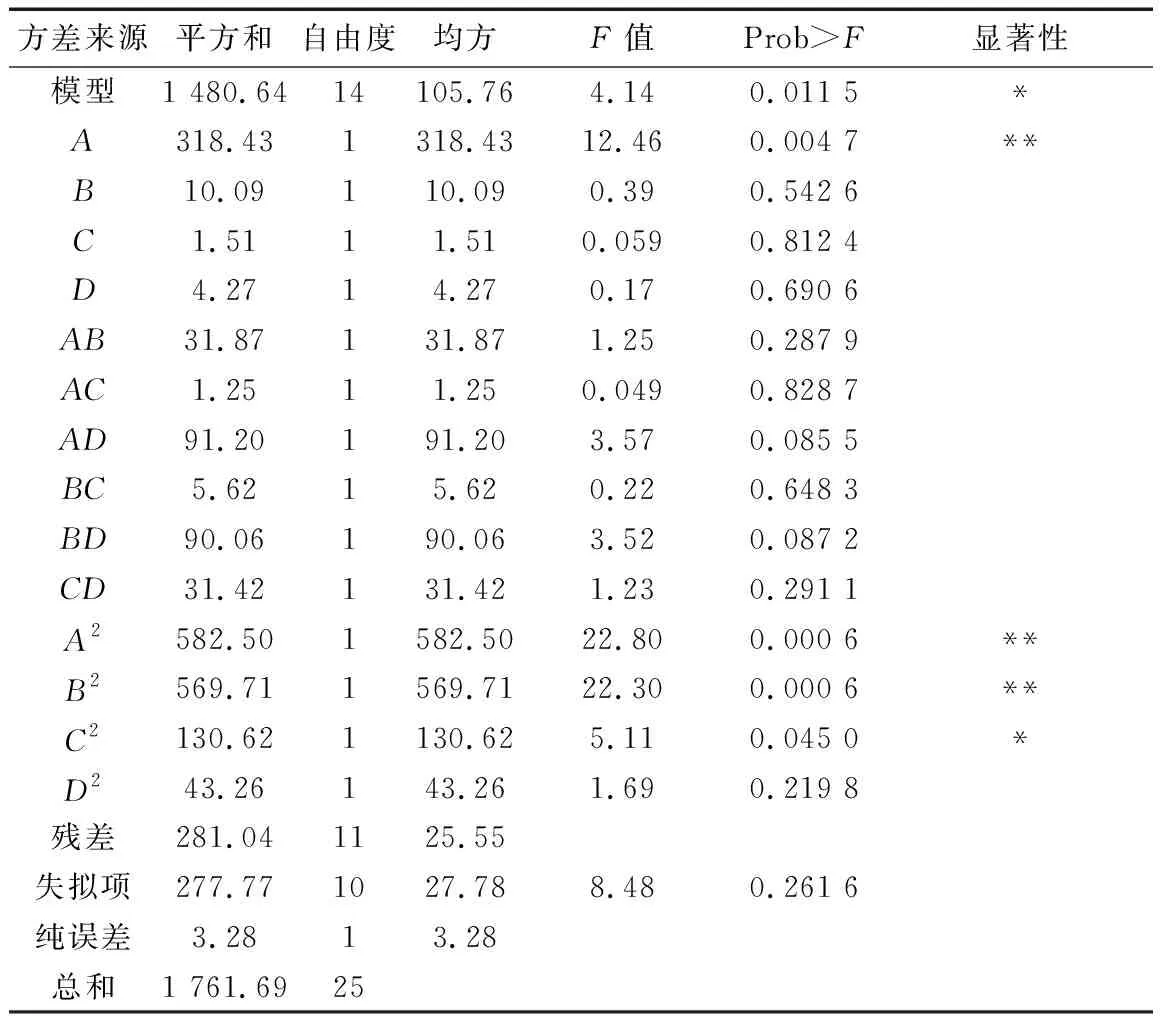
表4 ·OH清除率方差分析
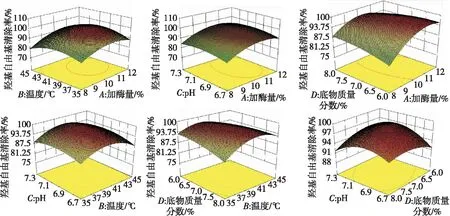
图2 ·OH清除率响应曲面图
由图2可知加酶量、pH、温度、底物质量分数,任何两因素对·OH清除率的交互影响。由图2可以看出4因素值选择合理,验证了实验的准确性。
2.2 最佳DPPH、·OH自由基清除率条件
以DPPH清除率、·OH清除率为评价指标,对回归方程进行偏微分,得出最佳酶解条件:加酶量为10.60%、温度40.30 ℃、pH 7.02、底物质量分数为6.80%。在此条件下,得到最佳DPPH清除率、·OH清除率分别为99.10%、97.60%。
2.3 验证实验
经验证,在此条件下,得到最佳DPPH清除率、·OH清除率分别为97.8%±0.23%、96.2%±0.35%。
3 结论
中性蛋白酶酶解豌豆蛋白挤出物的最佳酶解条件:加酶量为10.60%、温度40.30 ℃、pH 7.02、底物质量分数为6.80%。在此条件下,得到最佳DPPH清除率、·OH清除率分别为99.10%、97.60%。得到了豌豆蛋白酶解产物DPPH、·OH自由基清除率的预测模型,该模型预测准确可靠,可用于生产预测和工艺开发。
参 考 文 献
[1] 郭兴凤, 莫重文. 豌豆蛋白粉的制取研究[J]. 郑州粮食学院学报, 1995, 16(3):70-73.
[2] 郭兴凤. 豌豆蛋白的功能特性研究[J]. 郑州粮食学院学报, 1996, 17(1):69-74.
[3] LIASET B, LIED E, ESPE M. Enzymatic hydrolysis of by-products from the fish-filleting industry; chemical characterisation and nutritional evaluation[J]. Journal of the Science of Food & Agriculture, 2000, 80(5):581-589.
[4] OVISSIPOUR M, SAFARI R, MOTAMEDZADEGAN A, et al. Chemical and biochemical hydrolysis of persian sturgeon ( Acipenser persicus ) visceral protein[J]. Food & Bioprocess Technology, 2012, 5(2):460-465.
[5] 张秋萍. 豌豆分离蛋白酶解产生物活性肽的研究 [D].无锡:江南大学, 2013.
[6] 梁晗妮, 唐传核. 豌豆蛋白的功能特性研究[J]. 现代食品科技, 2012, 28(12):1640-1644.
[7] 李志平, 徐保明. 木瓜蛋白酶水解豌豆蛋白的工艺研究[J]. 食品研究与开发, 2010, 31(10):78-80.
[8] 杜双奎, 魏益民, 张波. 挤压膨化过程中物料组分的变化分析[J]. 中国粮油学报, 2005, 20(3):39-43.
[9] 葛英亮, 马艳秋. 响应曲面法优化蓝莓澄清果汁饮料工艺[J]. 食品科学, 2012, 33(12):52-57.
[10] TENG D, FANG Y, SONG X, et al. Optimization of enzymatic hydrolysis parameters for antioxidant capacity of peptide from goat placenta[J]. Food & Bioproducts Processing, 2011, 89(3):202-208.
[11] LI Y H, JIANG B, ZHANG T, et al. Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate (CPH)[J]. Food Chemistry, 2008, 106(2):444.

