芳香化酶抑制剂来曲唑诱导乳腺癌细胞凋亡实时观测模型的建立*
乳腺癌是女性最常见的恶性肿瘤之一[1]。约75%乳腺癌患者激素受体为阳性,他莫昔芬内分泌治疗是绝经前激素受体阳性乳腺癌患者最常用的内分泌治疗药物[2]。对于绝经后激素受体阳性乳腺癌患者,芳香化酶抑制剂来曲唑疗效因优于他莫昔芬,被用作一线内分泌治疗[3]。绝经后激素受体阳性乳腺癌患者循环血液中虽雌激素水平降低,但芳香化酶(编码基因为CYP19)可将雄激素转化为雌激素,进而促进雌激素受体阳性乳腺癌细胞的生长。研究发现,乳腺癌组织中的雌激素对乳腺癌组织的刺激作用比循环血液中雌激素的刺激作用更明显[4]。因此,阻断雌激素合成的芳香化酶抑制剂是绝经后激素受体阳性乳腺癌患者的重要内分泌治疗方式[5]。研究表明,芳香化酶抑制剂可诱导细胞凋亡[6],因此建立来曲唑诱导乳腺癌细胞凋亡的实时观测模型是研究的基础。本研究旨在通过构建凋亡荧光指示蛋白和芳香化酶过表达乳腺癌细胞系,构建可实时观测通过抑制芳香化酶介导的细胞凋亡模型,为实时观测来曲唑疗效、筛选联合药物、寻找最佳用药方式提供模型基础。
1 材料与方法
1.1 材料
1.1.1 主要药物试剂 雌激素、雄激素、polybrene均购自美国Sigma公司,芳香化酶抑制剂来曲唑购自上海Selleck公司,兔抗人CYP19抗体及鼠抗人β-actin抗体购自英国ABcam公司,逆转录试剂盒及荧光定量PCR试剂盒购自北京全式金生物技术有限公司,嘌呤霉素、Blasticidin均购自美国Invitrogen公司,Eco⁃RI、BamHI、T4连接酶均购自美国Thermo Scientific公司,Trizol试剂购自北京索来宝公司。
1.1.2 细胞系 人胚肾细胞293T和人乳腺癌细胞MCF-7及ZR7530由本实验室冻存。携带凋亡荧光指示蛋白基因的过表达质粒 pCDH-CMV-VC3AI[7]由李兵辉教授实验室获得。人CYP19全长开放阅读框克隆质粒PGEM-CYP19购自北京义翘神州科技有限公司。整合质粒pCMV-dR8.91和包膜质粒pCMVVSV-G及过表达载体PCDH-puro-VECTOR由本实验室冻存。
1.1.3 实时荧光定量PCR引物 引物均由上海金维智公司合成。芳香化酶的上游引物序列为5'-GACCA ATGAATCGGGCTATGT-3',下游引物序列为5'-GATGT CTGGTTTGATGAGGAGAG-3';选取GAPDH作为内参,其上游引物序列为5'-GATTCCACCCATGGCAAATTC-3',下游引物序列为5'-GTGAAGACGCCAGTGGAC-3'。
1.2 方法
1.2.1 细胞培养 293T和MCF-7细胞培养于含10%胎牛血清的DMEM培养液中,ZR7530细胞使用含有10%胎牛血清的RPMI 1640培养基培养。细胞置于37℃、5%CO2孵箱中培养。
1.2.2 芳香化酶过表达质粒构建 以PGEM-CYP19为模板,经PCR扩增含有特异限制性内切酶识别序列的CYP19基因产物,产物由特异性内切酶(EcoRI、BamHI)酶切1 h,经琼脂糖胶跑胶分离后切胶回收,同样的方法切胶回收PCDH-puro-VECTOR载体。两种回收产物与T4连接酶混合,室温连接5 h,经转化、挑菌、酶切鉴定以及测序验证后,芳香化酶过表达质粒PCDH-puro-CYP19构建成功。
1.2.3 细胞系构建 将293T细胞铺于6孔板中,待细胞均匀贴壁且细胞融合度为80%时,使用磷酸钙共沉淀法进行转染。按照载体质粒:整合质粒:包膜质粒为2:1:1比例进行转染。转染5 h后,更换新鲜的DMEM培养液。48 h后,收集培养液,8 000 r/min离心30 min,收集病毒。每1 mL病毒液滴加10 mg/mL的polybrene 1 μL进行细胞感染,12 h后更换新鲜培养液。培养48 h后以Blasticidin筛选稳定过表达VC3AI的细胞,同样的方法,在表达VC3AI的细胞中过表达芳香化酶。使用嘌呤霉素筛选稳定表达芳香化酶的乳腺癌细胞。
1.2.4 实时荧光定量PCR检测 收集嘌呤霉素筛选后的细胞,Trizol法提取细胞总RNA。使用Nanodrop分光光度计进行RNA定量,以逆转录试剂盒进行cD⁃NA合成。选取GAPDH作为内参定量分析目的基因的mRNA水平。
1.2.5 蛋白质印迹法检测 收集过表达芳香化酶和空载体的MCF-7-VC3AI、ZR7530-VC3AI细胞,1 000 r/min,离心5 min,收集细胞沉淀,加入细胞裂解液进行裂解,冰上放置5 min,干式恒温锅内95℃10 min。使用Nanodrop分光光度计进行蛋白定量,按照50 μg/孔蛋白量上样,100 mV电压恒压条件下进行聚丙烯酰胺凝胶电泳。将电泳分离后的条带转移至PVDF膜,5%脱脂牛奶封闭1 h。兔抗人CYP19抗体及鼠抗人β-actin抗体使用TBST稀释,按照1:1 000稀释,4℃过夜,TBST洗膜3次。使用辣根过氧化物酶标记的二抗孵育,洗膜后通过化学发光系统检测细胞中芳香化酶CYP19蛋白的表达,以β-actin为内参。
1.2.6 细胞增殖实验 分别取对数生长期的过表达芳香化酶MCF-7-VC3AI、ZR7530-VC3AI细胞,悬浮在去激素的RPMI 1640培养液中,细胞悬液密度为2×104/mL,按照0.1 mL/孔接种细胞至96孔板中,设5个平行孔。24 h后分别加入不同浓度的雄激素、雌激素,或者不同浓度来曲唑联合100 nmol/L雄激素,均设为实验组;取等量溶剂为对照组。细胞放置于培养箱中继续培养48 h,按照0.2 mL/孔加入浓度为5 mg/mL MTT溶液,37℃孵箱培育。4 h后吸弃旧培养基,加入150 μL/孔DMSO,轻轻震荡10 min,采用自动酶标仪(Bio-Ra)检测490 nm波长处的吸光度,计算平均值以及标准差。定义细胞增殖率=(实验组吸光度-调零孔吸光度)/(对照组吸光度-调零孔吸光度)×100%。
1.2.7 培养细胞拍照 分别取对数生长期的过表达芳香化酶MCF-7-VC3AI、ZR7530-VC3AI细胞,悬浮在去激素的RPMI 1640培养液中,细胞悬液密度为5×104/mL,按照1mL/孔接种细胞至12孔板中,设3个平行孔。24h后分别加入20 μmol/L来曲唑联合100 nmol/L雄激素,并设为实验组,取等量溶剂为对照组。细胞放置于培养箱中继续培养,分别于加药后0、12、24、48 h在EVOS FL荧光显微镜下观察并拍照。
1.3 统计学分析
采用SPSS 19.0软件进行统计学分析。计量资料以±s表示,采用t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 构建芳香化酶过表达细胞模型
过表达芳香化酶MCF-7-VC3AI、ZR7530-VC3AI细胞模型中,实时荧光定量PCR检测结果显示,PCDH-puro-CYP19的CYP19 mRNA水平明显高于过表达空载体PCDH-puro-VECTOR(P<0.01,图1A、B);蛋白质印迹法检测结果显示,过表达PCDH-puro-CYP19的CYP19蛋白水平明显高于过表达空载体PCDH-puro-VECTOR(图1C)。
2.2 雄激素、雌激素对芳香化酶过表达细胞增殖能力的影响
MTT检测结果显示,雄激素、雌激素可促进过表达芳香化酶MCF-7-VC3AI、ZR7530-VC3AI细胞的增殖,其中100 nmol/L雄激素对细胞增殖能力的促进作用最明显。实验组中的100 nmol/L雄激素作用下,过表达芳香化酶MCF-7-VC3AI、ZR7530-VC3AI细胞的增殖率约为对照组的1.2、1.5倍(P<0.01)。高浓度的雄激素对细胞增殖能力的促进作用减弱,甚至出现抑制细胞增殖的作用(图2A、2B)。雌激素可促进细胞增殖,其中促进过表达芳香化酶MCF-7-VC3AI细胞增殖的最佳浓度为1 μmol/L,细胞增殖率约为对照组的1.17倍(P<0.01);而促进过表达芳香化酶ZR7530-VC3AI细胞增殖的最佳浓度为1、10 μmol/L,细胞增殖率约为对照组的1.2倍(P<0.05,图2C、2D)。

图1 芳香化酶过表达细胞模型的鉴定

图2 不同浓度雄激素、雌激素作用48 h对芳香化酶过表达细胞模型增殖能力的影响
2.3 来曲唑对芳香化酶过表达细胞增殖能力的抑制作用
不同浓度来曲唑联合100 nmol/L雄激素作用于过表达芳香化酶MCF-7-VC3AI、ZR7530-VC3AI细胞,细胞增殖能力随来曲唑浓度增加而逐渐降低,来曲唑抑制雄激素促细胞增殖作用(图3)。
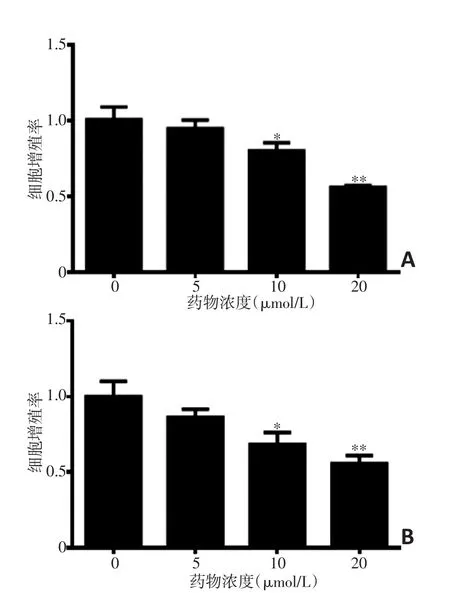
图3 不同浓度来曲唑联合100 nmol/L雄激素作用48 h后对芳香化酶过表达细胞模型增殖能力的影响
2.4 荧光显微镜检测凋亡
选取20 μmol/L来曲唑联合100 nmol/L雄激素作用于过表达芳香化酶MCF-7-VC3AI、ZR7530-VC3AI细胞,48 h后检测绿色荧光(图4)。大多数死亡细胞都能观测到绿色荧光,部分死亡细胞无绿色荧光,说明来曲唑对乳腺癌细胞的细胞毒性作用不只是促进细胞凋亡还有其他非凋亡途径参与。同时,在不同时间点实时持续观测用药后细胞的凋亡情况发现,用药12 h后开始出现凋亡,绿色荧光能较好地反映细胞凋亡情况(图5)。
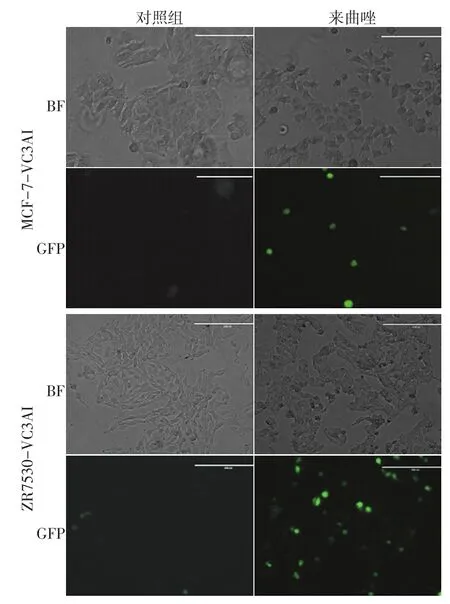
图4 来曲唑促进芳香化酶过表达细胞凋亡模型

图5 实时观测来曲唑对芳香化酶过表达细胞模型的凋亡诱导作用
3 讨论
芳香化酶是将雄激素转化为雌激素的关键代谢酶,是绝经后激素受体阳性乳腺癌患者体内雌激素水平升高的主要原因[8-9]。研究发现,乳腺癌患者的癌组织中芳香化酶表达水平升高且酶活性较高,外周血中雌激素水平升高[10-11]。芳香化酶抑制剂可促进细胞发生凋亡[6]。
目前,实验室普遍采用从乳腺癌患者的癌组织中分离纯化癌细胞进行体外研究,因乳腺癌MCF-7及ZR7530细胞中芳香化酶表达均较低[12-13],限制了在细胞系和分子水平上对芳香化酶抑制剂作用机制的研究。因此在体外研究中模拟芳香化酶抑制剂作用并对其机制进行探索,构建芳香化酶过表达细胞系是关键的环节。本研究通过质粒重组,将芳香化酶基因嵌入pCDH-CMV载体,构建过表达质粒,再通过慢病毒系统在稳定过表达凋亡荧光指示蛋白的MCF-7-VC3AI、ZR7530-VC3AI细胞内过表达芳香化酶。本研究的MTT检测细胞增殖结果表明,雌激素和雄激素都可促进这两种细胞的增殖,体现了芳香化酶将雄激素转化为雌激素的生物学功能,芳香化酶抑制剂来曲唑可浓度依赖性地抑制雄激素对两种细胞增殖的促进作用。
细胞凋亡是caspase家族蛋白酶级联反应过程,其中caspase-3的激活是细胞凋亡蛋白酶级联反应的关键步骤。VC3AI可被caspase-3剪切而发出绿色荧光[7,13]。研究报道,来曲唑可促进乳腺癌细胞凋亡[6]。本研究通过构建VC3AI和CYP19过表达的细胞系,在保持细胞活性的基础上实时、连续观测来曲唑诱导细胞凋亡发生、发展的过程,通过荧光亮度和数目可直观评价细胞凋亡情况,相比于其他观测细胞凋亡的技术过程更简便。因此,本研究的细胞模型可用于筛选与来曲唑联合协同作用的药物,为进一步逆转耐药的研究奠定基础。
研究表明,化疗药物的用药方式、联合药物的用药顺序等均会影响药物疗效和不良反应,合理的化疗药物用药方式可达到最佳疗效并使患者不良反应降为最低[14]。本研究模型可实时、持续观测细胞凋亡发生发展的过程,可用于筛选最佳用药方式及最佳用药时间。
综上所述,基于乳腺癌细胞凋亡实时观测模型的研究,未来将通过构建荧光素酶过表达癌细胞,构建活体成像动物模型,以便实时观测乳腺癌生长转移情况,进一步研究探索抗肿瘤药物的最佳用药方式和用药时间,以期在减少或者不改变既定药量的基础上,探索减毒增效的最佳用药策略。
[1] Gérard C,Brown KA.Obesity and breast cancer-role of estrogens and the molecular underpinnings of aromatase regulation in breast adipose tissue[J].Mol Cell Endocrinol,2018,466:15-30.
[2] Chen MJ,Cheng YM,Chen CC,et al.MiR-148a and miR-152 reduce tamoxifen resistance in ER+breast cancer via downregulating ALCAM[J].Biochem Biophys Res Commun,2017,483(2):840-846.
[3] Tremont A,Lu J,Cole JT.Endocrine therapy for early breast cancer:updated review[J].Ochsner J,2017,17(4):405-411.
[4] Tekmal RR,Ramachandra N,Gubba S,et al.Overexpression of int-5/ammatsse in mammary glands of transgenic mice results in the induction of hyperplasia and nuclear abnormalities[J].Cancer Res,1996,56(14):3l80-3185.
[5] Khosrow-khavar F,Yin H,Barkun A,et al.Aromatase inhibitors and the risk of colorectal cancer in postmenopausal women with breast cancer[J].Ann Oncol,2018,29(3):744-748.
[6] Thiantanawat A,Long BJ,Brodie AM.Signaling pathways of apoptosis activated by aromatase inhibitors and antiestrogens[J].Cancer Res,2003,63(22):8037-8050.
[7] Zhang J,Wang X,Cui W,et al.Visualization of caspase-3-like activity in cells using a genetically encoded fluorescent biosensor activated by protein cleavage[J].Nat Commun,2013,4:2157.
[8] Li Q,Zhao X,Wang S,et al.Letrozole induced low estrogen levels affected the expressions of duodenal and renal calcium-processing gene in laying hens[J].Gen Comp Endocrinol,2018,255:49-55.
[9] Beom SH,Oh J,Kim TY,et al.Efficacy of letrozole as first-line treatment of postmenopausal women with hormone receptor-positive metastatic breast cancer in Korea[J].Cancer Res Treat,2017,49(2):454-463.
[10]Lambeth LS,Morris KR,Wise TG,et al.Transgenic chickens overexpressing aromatase have high estrogen levels but maintain a predominantly male phenotype[J].Endocrinology,2016,157(1):83-90.
[11]Li F,Ye L,Lin SM,et al.Dietary flavones and flavonones display differential effects on aromatase(CYP19)transcription in the breast cancer cells MCF-7[J].Mol Cell Endocrinol,2011,344(1-2):51-58.
[12]Wong C,Chen S.The development,application and limitations of breast cancer cell lines to study tamoxifen and aromatase inhibitor resistance[J].J Steroid Biochem Mol Biol,2012,131(3-5):83-92.
[13]Zhou DJ,Pompon D,Chen SA.Stable expression of human aromatase complementary DNA in mammalian cells:a useful system for aromatase inhibitor screening[J].Cancer Res,1990,50(21):6949-6954.
[14]李建安.药物不同应用方式对肺癌治疗影响分析[J].中国肿瘤临床与康复,2014,(4):460-462.

