CDA基因变异对卡培他滨治疗结直肠癌患者出现手足综合征的影响
李荣振 张思森 杨铁健 季节 沈杰
结直肠癌在中国每年新发病例约为37.5万例,男性发病率明显高于女性,每年死亡病例约为19.1万例[1]。近年来,随着结直肠癌领域分子分型的进一步深入,越来越多的不同作用靶点的药物给结直肠癌患者带来了不同的治疗选择,从而为患者带来了更多的生存获益。贝伐珠单抗开启了晚期结直肠癌靶向治疗的时代[2]。瑞戈非尼的批准上市也为晚期结直肠癌患者带来新的治疗选择[3]。另外,在辅助化疗领域,基于对IDEA研究的认可,2018年NCCN指南(第1版)推荐对于低危的Ⅲ期结肠癌推荐3个月的XELOX辅助化疗方案(卡培他滨联合奥沙利铂)[4]。
作为5-氟尿嘧啶(5-FU)的前体,卡培他滨被广泛用于结直肠癌患者的术后辅助化疗。卡培他滨需要经过三步酶联反应才能转化为5-FU,其中最重要的一步是被胞苷脱氨酶(cytidine deaminase,CDA)和胸苷磷酸化酶代谢成5-FU而发挥细胞毒性作用。5-FU的主要作用靶标为胸苷酸合成酶,被二氢嘧啶脱氢酶灭活[5]。卡培他滨转化为5-FU的过程中具有肿瘤特异性,因此也降低了不良反应发生率。但是仍有30%的患者会出现手足综合征(hand foot syn⁃drome,HFS)。HFS同样也是持续输注5-FU以及其他的细胞毒性药物如阿霉素、阿糖胞苷和多西他赛后出现的不良反应。HFS的具体临床表现是手掌足底泛红、肿胀、感觉麻木,通常会造成剂量下调甚至治疗中止[6]。
遗传药理学的主要目的之一是阐明基因遗传变异对药物不良反应以及疗效的影响[7]。近年来,通过对药物代谢通路上基因的遗传变异分析解释抗肿瘤药物临床反应的个体差异变得越来越重要[8]。在欧美国家及地区的高加索人群中,有研究表明CDA基因的一些多态性位点与卡培他滨引起的HFS有关[9]。但是CDA基因具有较大的种族差异,目前尚缺乏在中国的结直肠癌患者当中探讨CDD基因变异和HFS的相关性研究。因此,本研究旨在探讨卡培他滨代谢通路上CDA基因的多态性和卡培他滨引起的HFS发生的相关性。
1 材料与方法
1.1 病例资料
回顾性分析2014年5月至2017年5月在郑州人民医院接受卡培他滨治疗的结直肠癌患者149例。入组标准:1)根据美国癌症联合会(AJCC)分期确定为Ⅱ期和Ⅲ期的结直肠癌或术后复发的结直肠癌患者;2)治疗过程中接受XELOX或卡培他滨单药方案的患者。本研究得到医院伦理委员会的批准(批号:ZZRMYY-140026-3),所有入组的患者均签署了知情同意书。
1.2 方法
1.12 治疗方案 卡培他滨化疗方案为1 000 mg/m2,2次/d,d1~14,3周为1个治疗周期。部分结直肠癌患者因不耐受调整为800 mg/m2,2次/d,d1~14,3周为1个治疗周期。
HFS的评价为治疗两个周期后,依据国内公认的常见不良反应事件评价标准进行分级。3级HFS定义为出现疼痛干扰到正常功能的皮肤损伤。其他的临床基线资料包括年龄、卡培他滨用药方案、减量次数、肝转移等。
1.2.2 血液样本收集及基因分型 收集149例结直肠癌患者的外周血标本约5 mL提取基因组DNA,按照标准操作规程采用苯酚氯仿法进行DNA的提取,通过飞行时间质谱(美国Sequenom公司)的方法对CDA的-451G>A(rs532545)和-33delC(rs3215400)多态性位点进行分型,5%的样本随机挑选重复验证。
1.2.3 外周血单核细胞及CDA基因mRNA表达分析随机选取入组的91例结直肠癌患者化疗前的外周血标本,保存于EDTA抗凝剂管中用标准操作进行外周血单核细胞(peripheral blood mononuclear cell,PBMC)的提取,用Trizol试剂提取PBMC中的RNA。CDA mRNA表达采用上海罗氏real-time PCR仪检测,反应体系总计20 μL,GAPDH mRNA的表达量作为内参。CDA mRNA用相对定量法2-△△Ct进行计算。
1.3 统计学分析
采用SPSS 19.0软件进行统计学分析。χ2检验分析多态性位点基因分型是否符合哈迪温伯格平衡。在基线临床资料当中,离散型的变量和-451G>A位点不同基因型的分布采用χ2检验,当数据较少时用Fisher精确检验。连续型的变量和该位点不同基因型的分析采用非参检验的Mann-Whitney U(两组间)。CDA基因的多态性位点和HFS的相关性分析采用Logistic回归模型分析,比较低毒性和高毒性两组中不同基因型的基因频率,从而算出风险比(OR)值。野生的纯合子个体作为参考组。采用t检验分析PBMC中不同基因型的CDA mRNA表达情况。所有表达的数据通过对数秩转化。P<0.05为差异具有统计学意义。
2 结果
2.1 患者基线临床资料及CDA基因-451G>A位点基因分型结果
149例患者的基线临床资料中,年龄为25~78岁,中位年龄为54岁,大部分为Ⅲ期的结直肠癌患者(81.21%)。59.73%患者未进行卡培他滨的剂量调整。3级HFS的发生率为34.23%,无4级以上的HFS(表1)。
-451G>A位点的基因分型结果为野生GG型109例(73.15%),GA型 38例(25.50%),AA型 2例(1.36%),最小等位基因频率为0.14,三种基因型分布频率符合哈迪温伯格平衡(P=0.516)。因突变纯合子AA型患者相对较少,后期分析中,将AA和GA型患者合并。该位点不同基因型在基线临床资料中的分布基本均衡。
2.2 -451G>A位点基因型与HFS的关联性分析
AA与GA型患者合并共计40例。在Logistics回归分析中,GA/AA基因型患者的3级HFS发生比例明显高于野生型GG型患者(50.00%vs.28.44%),并具有显著性差异(OR=2.53,P=0.014)。
2.3 CDA基因多态性位点的连锁不平衡及与基因表达水平的关联性分析
本研究通过提取的RNA对CDA的表达情况进行分析,并与-451G>A位点的基因型进行了相关性统计。在91例PBMC标本中,GG型67例,GA型22例,AA型2例,三种基因型分布频率同样符合哈迪温伯格平衡(P=0.903)。将AA/GA型患者合并,共计24例。-451G>A位点GA/AA型患者的CDA mRNA表达水平显著高于野生型GG型的患者(4.01±0.53vs.3.13±0.61,P<0.001,图1)。

表1 149例结直肠癌患者的基线临床资料
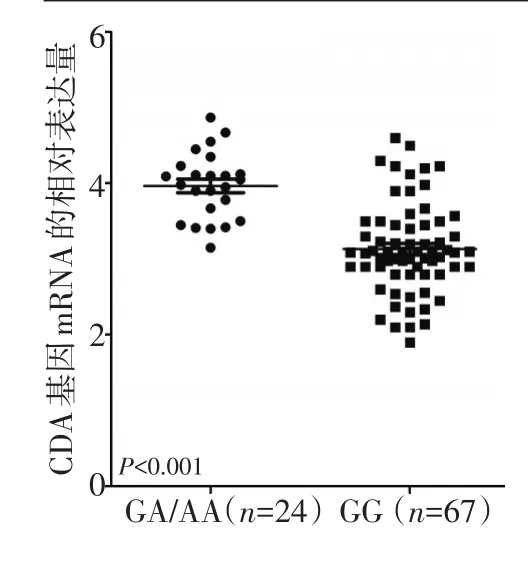
▶图1 CDA基因-451G>A位点不同基因型患者的外周血单核细胞中CDA mRNA的相对表达量
另外,本研究发现位于CDA基因启动子区域的插入变异-33delC和-451C>T呈现高度的连锁不平衡(D'=0.92,R'=0.82,图2)。-33delC位点和3级HFS具有显著的相关性。

图2 CDA基因-451G>A和-33delC位点的连锁不平衡分析
3 讨论
本研究通过分析卡培他滨代谢通路上CDA基因多态性与HFS发生的相关性,结果表明CDA基因上的-451G>A多态性位点和3级HFS呈显著性相关。在PBMC的表达分析中也发现该位点突变基因对CDA mRNA表达具有显著的影响。
CDA参与嘧啶核苷酸补救合成途径,具有不可逆地催化胞苷和脱氧胞苷水解脱氨基的作用[10]。另外,CDA在多数胞嘧啶核苷类似物的抗肿瘤药物的代谢中发挥重要作用,将前体药物转化为5-FU[11]。
CDA基因多态性和胞嘧啶核苷类似物药物的敏感性或毒性具有相关性。Yue等[12]的研究发现位于外显子区域的G208A多态性位点和阿糖胞苷的敏感性相关。Yonemori等[13]的研究纳入接受顺铂吉西他滨治疗的肿瘤患者发现CDA基因208G>A位点和吉西他滨相关的毒性有关,但是样本量较少不足以说明该基因多态性位点的具体影响机制。
本研究与既往Caronia等[9]的研究一致,其纳入了130例接受卡培他滨治疗的晚期乳腺癌和结直肠癌患者,结果发现了CDA基因的rs532545位点和3级HFS的发生显著相关,同时也发现了rs3215400位点和rs532545位点呈现较强的连锁不平衡。但是该研究表明在高加索人群当中rs532545位点的等位基因频率约为0.30,而该位点在本研究中只有0.14的等位基因频率,这说明该位点具有较大的种族差异。另外,上述研究纳入为乳腺癌和结直肠癌的患者,研究人群异质性较大,而本研究仅为结直肠癌患者。本研究发现GA/AA型的患者CDA mRNA表达水平明显较高,这与既住研究结果相反。可能是该位点存在较大的种族差异,不同人群中表达情况不一致造成的。Fitzgerald等[14]的研究报道了包含rs602950与rs532545的单倍型和CDA基因表达的关系,单倍型在本研究的人群发生频率较低(<1%)。另外,本研究基因表达的结果也可以部分解释CDA基因-451G>A多态性位点具有较高3级HFS发生的原因,GA/AA基因型的个体通过引起CDA mRNA的高表达从而在卡培他滨代谢过程中将5'脱氧氟胞苷更多地转化为5'脱氧氟脲苷,进而更多地代谢为5-FU,因此引起了较高的HFS发生率。基于目前本研究结果,假设了一个模型即位于CDA启动子区域的E2F点缺失可以增加CDA的转录。细胞毒性药物还可以增加手掌和脚底皮肤的增生率[15],这样便使得这些部位的皮肤对5-FU的细胞毒性更为敏感,从而诱发了较高级别的HFS[16]。
本研究仍存在一定局限性,首先是研究纳入的样本量较小,还需在更多的样本当中进一步验证。另外,研究为回顾性分析,存在一定偏倚。本研究对-451G>A多态性位点引起3级HFS进行了探讨,同时也从CDA基因mRNA表达层面去揭示了该位点引起3级HFS的部分原因。相信经过大样本的进一步研究验证之后,基于对CDA基因型的分析可为临床结直肠癌患者精准化疗方案的制定提供一定参考,为患者提供更为精准的化疗方案。
[1] Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2] Rosen LS,Jacobs IA,Burkes RL.Bevacizumab in colorectal cancer:current role in treatment and the potential of biosimilars[J].Target Oncol,2017,12(5):599-610.
[3] Li J,Qin S,Xu R,et al.Regorafenib plus best supportive care versus placebo plus best supportive care in Asian patients with previously treated metastatic colorectal cancer(CONCUR):a randomised,doubleblind,placebo-controlled,phase 3 trial[J].Lancet Oncol,2015,16(6):619-629.
[4] Lonardi S,Sobrero A,Rosati G,et al.PhaseⅢtrial comparing 3-6 months of adjuvant FOLFOX4/XELOX in stageⅡ-Ⅲ colon cancer:safety and compliance in the TOSCA trial[J].Ann Oncol,2017,28(12):3110.
[5] 白羽,吴海伟,刘颖,等.二氢嘧啶脱氢酶和亚甲基四氢叶酸还原酶基因多态性与卡培他滨方案治疗结直肠癌患者药物不良反应的相关性[J].中国临床药理学杂志,2017,33(17):1637-1640.
[6] Chen M,Chen J,Peng X,et al.The contribution of keratinocytes in capecitabine-stimulated hand-foot-syndrome[J].Environ Toxicol Pharmacol,2017,49:81-88.
[7] Cacabelos R,Meyyazhagan A,Carril JC,et al.Pharmacogenetics of vascular risk factors in alzheimer's disease[J].J Pers Med,2018,8(1):E3.
[8] Conyers R,Devaraja S,Elliott D.Systematic review of pharmacogenomics and adverse drug reactions in paediatric oncology patients[J].Pediatr Blood Cancer,2017,2018,64(4):1-12.
[9] Caronia D,Martin M,Sastre J,et al.A polymorphism in the cytidine deaminase promoter predicts severe capecitabine-induced hand-foot syndrome[J].Clin Cancer Res,2011,17(7):2006-2013.
[10]Rachar V,Czejka M,Kitzmueller M,et al.Assessment of pharmacokinetic interaction between capecitabine and cetuximab in metastatic colorectal cancer patients[J].Anticancer Res,2016,36(9):4715-4723.
[11]Mu Y,Zelazowska MA,McBride KM.Phosphorylation promotes activation-induced cytidine deaminase activity at the Myc oncogene[J].J Exp Med,2017,214(12):3543-3552.
[12]Yue L,Saikawa Y,Ota K,et al.A functional single-nucleotide polymorphism in the human cytidine deaminase gene contributing to ara-C sensitivity[J].Pharmacogenetics,2003,13(1):29-38.
[13]Yonemori K,Ueno H,Okusaka T,et al.Severe drug toxicity associated with a single-nucleotide polymorphism of the cytidine deaminase gene in a Japanese cancer patient treated with gemcitabine plus cisplatin[J].Clin Cancer Res,2005,11(7):2620-2624.
[14]Fitzgerald SM,Goyal RK,Osborne WR,et al.Identification of functional single nucleotide polymorphism haplotypes in the cytidine deaminase promoter[J].Hum Genet,2006,119(3):276-283.
[15]Nikolaou V,Syrigos K,Saif MW.Incidence and implications of chemotherapy related hand-foot syndrome[J].Expert Opin Drug Saf,2016,15(12):1625-1633.
[16]张莎,陈自平,杜文军,等.DNA修复基因XPDXPCXRCC4基因多态性与结直肠癌易感性的关联性研究[J].中国肿瘤临床,2017,44(8):365-370.

