肿瘤免疫逃逸作用机制及在食管癌中的研究进展
近年来,随着肿瘤免疫学的发展,人们逐渐认识到肿瘤生长过程中会产生免疫抑制环境,促进肿瘤细胞逃逸。2002年Schreiber等[1]首次提出肿瘤免疫编辑理论,将其分为免疫清除、免疫平衡、免疫逃逸三个阶段。免疫逃逸对于肿瘤细胞的存活至关重要。肿瘤细胞可通过募集抑制性免疫细胞及分子,改变肿瘤微环境,进而逃避机体的免疫识别与攻击。食管癌是我国最常见的恶性肿瘤之一,目前标准疗法仍然局限于手术或内镜切除及放化疗,且总体预后较差。充分认识食管癌免疫逃逸的机制是探索高效免疫疗法的关键。本文围绕肿瘤免疫逃逸相关因子作用机制及在食管癌中的研究进展做一综述。
1 髓源性抑制性细胞与免疫逃逸
髓源性抑制性细胞(myeloid-derived suppressor cell,MDSC)是一群骨髓来源的异质性细胞,是树突状细胞、巨噬细胞和(或)粒细胞的前体。正常情况下,能迅速地分化为成熟的树突状细胞、粒细胞、巨噬细胞,并进入相应的器官、组织,发挥正常免疫功能。在病理条件下,MDSC成熟受阻,停留在各个分化阶段,成为具有免疫抑制功能的MDSC。MDSC主要通过细胞表面受体结合或释放短效类可溶性介质,下调机体免疫应答效应,在自身免疫性疾病及肿瘤形成中发挥重要作用[2]。慢性感染、炎症或肿瘤会导致MDSC的聚集。大量细胞因子参与MDSC的激活及扩增,包括IL-1β、IL-6和PGE2等促炎症分子以及VEGF等肿瘤分泌因子。MDSC主要通过以下4种机制抑制抗肿瘤免疫:直接抑制T细胞活化,抑制NK细胞的细胞毒性,消耗精氨酸和半胱氨酸,诱导调节性T细胞形成。通过对动物模型的研究,MDSC的促肿瘤作用得到证实[3]。
Stairs等[4]研究表明,在食管鳞状细胞癌p120-连环素缺陷型小鼠模型中,MDSC大量增殖,并且可以激活成纤维细胞诱导结缔组织形成。研究表明,食管癌患者中MDSC水平升高,并且与疾病的分期、预后和耐药性成正相关[5-6]。但由于MDSC具有异质性,在临床应用中受到限制。为了更好地鉴定出食管癌中驱动MDSC介导的免疫抑制反应的因子,Karakasheva等[7]发现,免疫抑制能力较强的MDSC高表达CD38。人体内试验证实,晚期食管癌患者的外周血中CD38阳性MDSC数量增多;在食管癌小鼠模型体内研究中,使用CD38单抗daratumumab(目前FDA批准用于治疗多发性骨髓瘤)可以使肿瘤细胞生长减慢[7]。所以,对MDSC生物学的进一步研究,可能为食管癌治疗发展指明一定方向。
2 辅助性T细胞17与免疫逃逸
CD4+T细胞是效应性T细胞的重要组成成分,在免疫调节过程中发挥重要作用。根据所产生的细胞因子和效应细胞的生物功能特征,将CD4+T细胞分为Th1、Th2、Treg和Th17辅助性T细胞。辅助性T细胞17(T helper 17 cell,Th17)的分化与增殖可通过一系列细胞因子TGF-β、IL-6、IL-23、IL-1β、IL-21形成的效应因子网络进行调控[8]。Th17细胞以分泌IL-17为主要特征,并通过IL-17上调其他相关因子来调控肿瘤微环境,从而介导炎症、自身免疫和肿瘤等多种疾病的发生。在肿瘤微环境中,Th17细胞能正向调节Th1和NK细胞的功能,介导抗肿瘤免疫反应。研究表明,Th17细胞可以通过CCR6/CCL20途径调节树突状细胞募集,从而发挥抗肿瘤免疫效应[9]。然而有学者指出,当Th17细胞与细胞因子TGF-β和IL-6一起培养时,Th17细胞表达核苷酸酶CD39和CD73,进而释放腺苷,抑制CD8+T细胞功能[10]。同时,Th17细胞具有转化为Treg的能力,进而发挥免疫抑制作用[11]。此外,通过分泌细胞因子,如IL-17、IL-22,Th17细胞活化STAT3通路诱导血管生成并促进肿瘤生长。
研究发现,食管癌患者外周血和肿瘤组织中Th17细胞比例增高,Th17细胞浸润程度与肿瘤分期相关[12-13]。蒋国军等[14]研究表明Th17细胞在食管鳞癌患者外周血中的数量明显增多,其特异性分泌的IL-17在食管鳞癌组织中的表达高于癌旁组织,Th17细胞可能与食管鳞癌的发病有关。Th17细胞通过抗肿瘤免疫来抑制肿瘤生长,还是通过促肿瘤细胞生长增殖、抗凋亡能力及血管生成来促进肿瘤生长,目前尚不清楚。因此,明确需要更深入地了解Th17细胞在食管癌中的作用,以确定其作为治疗靶标的潜力。
3 调节性T细胞与免疫逃逸
调节性T细胞(regulatory T cell,Treg)是一类控制体内自身免疫反应性的异质性的群体。目前已经发现了多种Treg亚群,包括天然产生的自然调节性T细胞(nTreg),诱导产生的适应性调节性T细胞(iTreg)以及抗原特异性CD4+Treg。肿瘤局部Treg可通过多种途径抑制免疫效应细胞的功能,如T细胞、NK细胞和树突状细胞。其主要机制包括以下4个方面:分泌抑制性细胞因子抑制效应细胞的功能,如IL-10、TGF-β;释放颗粒酶和穿孔素杀伤效应细胞;通过干扰细胞代谢影响效应细胞的功能;调控树突状细胞影响Treg的分化和增殖。
研究发现,相对于健康人,食管癌患者的外周血和食管黏膜组织中Treg表达增加[15-16]。Treg浸润程度对食管癌患者预后有一定预测作用,Treg数量越多,肿瘤入侵越深,越易发生转移,与患者疾病严重程度和化疗后生存率降低呈正相关[17-20]。此外,有关食管癌患者接受新辅助放化疗的报道显示,残留肿瘤(治疗后)中的Treg细胞浸润密度与病理应答相关,低密度Treg细胞浸润更易触发组织学应答,此外,Treg细胞浸润密度与患者生存期呈负相关[21]。可见Treg在食管癌的发生发展中发挥着重要作用,大量研究开始着重于干扰Treg分化、募集,试图降低其抑制功能,但如同MDSC一样,Treg也具有异质性,其作用机制较复杂,为临床应用带来了挑战。
4 肿瘤相关巨噬细胞与免疫逃逸
巨噬细胞是机体固有免疫反应的重要组成成分,与上文提到的MDSC与Treg一样,也是一类异质性的细胞群体。组织和炎症中浸润的巨噬细胞来源于骨髓单核细胞前体。这些前体细胞从血管渗透到人体内各个组织,并在不同组织微环境中分化为不同亚型。一般将这些前体细胞分为两种表型:M1型经典活化巨噬细胞和M2型替代活化巨噬细胞[22]。M1型巨噬细胞高表达主要组织相容性复合物(major histocompatibility complex,MHC)Ⅰ类和Ⅱ类分子,负责肿瘤特异性抗原呈递,参与抗肿瘤反应。相反,M2型巨噬细胞主要发挥促肿瘤的效应。M2型巨噬细胞分泌 CC 趋化因子配体 17[chemokine(C-C motif)li⁃gand 17,CCL17]、CCL22、CCL24等,低表达IL-12、高表达IL-10。在荷瘤机体中,浸润在肿瘤中的巨噬细胞通常称为肿瘤相关巨噬细胞(tumor-associated macrophage,TAM),TAM更接近M2型巨噬细胞的功能表型[23]。TAM促肿瘤效应主要通过3方面实现:TAM分泌多种因子(碱性成纤维细胞生长因子、胸苷磷酸化酶、尿激酶型纤溶酶原激活剂等)调控肿瘤血管生成,为肿瘤生长提供营养;TAM通过降解细胞外基质促进肿瘤细胞的侵袭和迁移;巨噬细胞通过分泌一些免疫抑制因子如转化生长因子β(transforming growth factor β,TGF-β)和IL-10等直接或间接地抑制T细胞功能并介导细胞毒性T细胞的凋亡。
Miyashita等[24]发现,在反流性食管炎大鼠模型中,M1型巨噬细胞募集到炎症部位,激活上皮细胞和基质细胞中的STAT3途径,促进M2型巨噬细胞极化,诱导癌细胞的生成。此外,在食管腺癌患者的组织中,肿瘤细胞上调Th2细胞相关因子,如IL-4和IL-13,促进M2型巨噬细胞浸润,这与MDSC介导的免疫抑制相关[25]。在食管鳞癌患者中,肿瘤来源的巨噬细胞趋化蛋白-1(MCP-1)的分泌增加,导致TAM浸润并产生血管生成酶[26]。解瑞玲等[27]研究发现TAM在食管癌组织中具有较高的浸润密度,将癌间质和癌巢分别比较发现癌间质TAM浸润密度明显高于癌巢。此外,癌间质和癌巢TAM浸润密度与生存时间呈负相关。Shigeoka等[28]研究发现,TAM浸润也与食管鳞癌化疗反应耐受及总体预后不良有关。
5 抑制性协同刺激因子与免疫逃逸
T细胞的活化需要抑制性协同刺激因子双信号途径,第一信号途径为抗原递呈细胞上的主要组织相容性复合体与T细胞上的TCR结合,第二信号为抗原递呈细胞上的共刺激分子B7与T细胞上的CD28分子结合。在这两种信号共同作用下,T细胞活化、增殖,具备杀伤肿瘤细胞的能力。在调控第二信号通路众多分子中,存在激活性协同刺激因子受体及抑制性协同刺激因子受体,后者在负性调控T细胞应答方面发挥重要作用[29-30]。程序性死亡受体1(pro⁃grammed death 1,PD-1)和细胞毒性T淋巴细胞相关抗原 4(cytotoxic T-lymphocyte-associated antigen 4,CTLA-4)是目前研究较热的负性共刺激信号分子。PD-1属于CD28免疫球蛋白超家族的Ⅰ型跨膜糖蛋白,主要表达于T细胞、B细胞、单核细胞和骨髓细胞。PD-1具有2个配体,分别是PD-L1和PD-L2。PD-L1在B细胞、T细胞、巨噬细胞和树突细胞上表达,而PD-L2的表达则较局限,只在巨噬细胞、树突状细胞和一些B细胞亚类的膜表面表达,且往往呈低表达状态。故PD-L1成为PD-1阻断T细胞活化及介导肿瘤免疫抑制的主要配体。CTLA-4与CD28同源,都是免疫球蛋白超家族成员,表达于活化的T细胞表面,配体主要表达于淋巴结和脾脏抗原呈递细胞表面的 B7-1(CD80)或B7-2(CD86)。目前针对PD-1、CTLA-4靶点研发的单抗类药物,如nivolum⁃ab、pembrolizumab、pidiluzumab、ipilimumab已经在黑色素瘤、肾癌及非小细胞肺癌患者临床治疗中得以应用,患者的生存期得以延长。
目前有关抑制性协同刺激因子受体在食管癌中的报道开始涌现。在食管鳞癌中的研究中,多数结果显示,PD-1及其配体的表达水平与较差的预后相关[31-33],然而其他研究表明,组织中高表达PD-L1的患者,其生存期较长[34-35]。在食管腺癌的研究中,PD-L1的表达水平与较差的预后相关[36],PD-L2的表达与患者分期、肿瘤大小与分化程度相关,与生存期无关[37]。在食管癌中针对CTLA-4的研究较少,Zhang等[38]通过检测食管鳞状细胞癌手术标本中肿瘤细胞及浸润性淋巴细胞中CTLA-4的表达,发现87%肿瘤细胞表达CTLA-4,在浸润性淋巴细胞中,58%样本为CTLA-4阳性,且双阳性表达者与较差的总生存期相关。虽然目前免疫检查点阻断剂(im⁃mune checkpoint inhibitor)的治疗在食管癌中尚未广泛开展,但其疗效初见端倪。Kudo等[39]研究表明,17%食管鳞癌患者在nivolumab治疗过程中产生应答,显示出抗肿瘤活性。Doi等[40]研究发现,对于标准治疗失败的食管癌患者中,pembrolizumab安全性可控,疗效显著。免疫检查点阻断剂在食管癌中临床试验正在逐步开展(表1),相信随着研究的不断深入,免疫靶向药物也会在食管癌中得以应用,为食管癌的治疗提供新的方法。
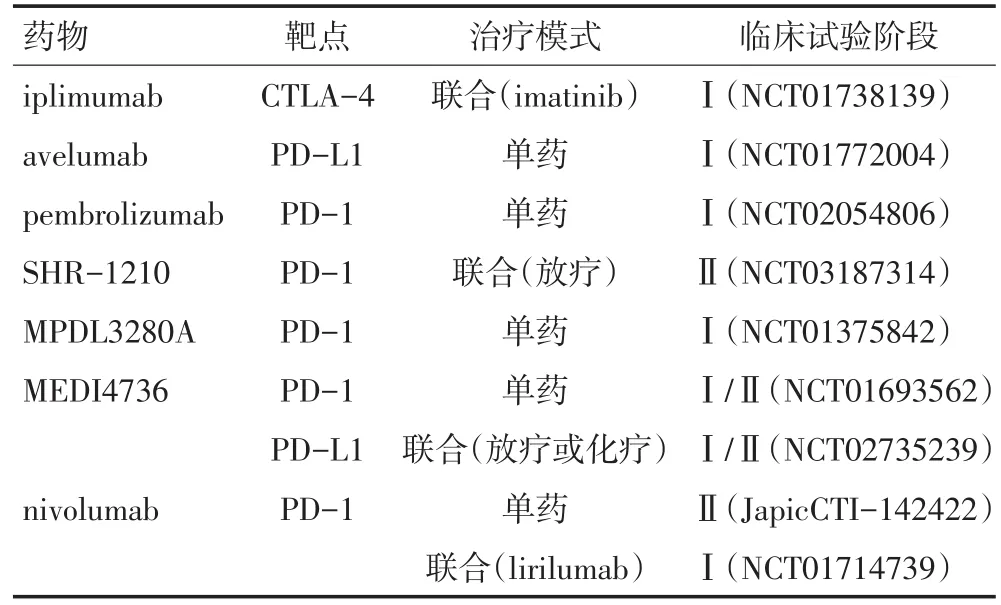
表1 抗CTLA-4、PD-1、PD-L1抗体在食管癌中开展的临床试验
6 小结与展望
本文讨论了抑制性免疫细胞及共刺激因子在肿瘤免疫逃逸中的机制及在食管癌中的研究进展。肿瘤微环境中抑制性免疫细胞及共刺激因子可能导致肿瘤免疫逃逸,促进肿瘤的形成、增殖、浸润和转移,但其作用机制尚不清楚。抑制性免疫细胞从初始发育到具有免疫调节功能的各个阶段错综复杂,尽管这些细胞具有相对的遗传稳定性,但其本质上具有异质性,如何鉴别出这些细胞群体中的促瘤驱动因子,给研究者带来了极大的挑战。免疫逃逸相关因子在食管癌的发生发展起到了一定作用,相信随着对食管癌免疫逃逸机制的探索,有望发现高效的免疫靶向药物,使食管癌患者受益。
[1] Schreiber RD,Old LJ,Smyth MJ,et al.Cancer Immunoediting:Integrating Immunity's Roles in Cancer Suppression and Promotion[J].Science,2011,331(6024):1565-1570.
[2] Waldron TJ,Quatromoni JG,Karakasheva TA,et al.Myeloid derived suppressor cells:targets for therapy[J].Oncoimmunology,2013,2(4):e24117.
[3] Quail DF,Joyce JA.Microenvironmental regulation of tumor progression and metastasis[J].Nat Med,2013,19(11):1423-1437.
[4] Stairs DB,Bayne LJ,Rhoades B,et al.Deletion of p120-catenin results in a tumor microenvironment with inflammation and cancer that establishes it as a tumor suppressor gene[J].Cancer Cell,2011,19(4):470-483.
[5] Chen M,Kuan F,Yen T,et al.IL-6-stimulated CD11b+CD14+HLA-DR-myeloid-derived suppressor cells,are associated with progression and poor prognosis in squamous cell carcinoma of the esophagus[J].Oncotarget,2014,5(18):8716-8728.
[6] Gabitass RF,Annels NE,Stocken DD,et al.Elevated myeloid-derived suppressor cells in pancreatic,esophageal and gastric cancer are an independent prognostic factor and are associated with significant elevation of the Th2 cytokine interleukin-13[J].Cancer Immunol Immunother,2011,60(10):1419-1430.
[7] Karakasheva TA,Waldron TJ,Eruslanov E,et al.CD38-Expressing Myeloid-Derived Suppressor Cells Promote Tumor Growth in a Murine Model of Esophageal Cancer[J].Cancer Res,2015,75(19):4074-4085.
[8] Su X,Ye J,Hsueh EC,et al.Tumor microenvironments direct the recruitment and expansion of human th17 cells[J].J Immunol,2010,184(3):1630-1641.
[9] Kryczek I,Wei S,Szeliga W,et al.Endogenous IL-17 contributes to reduced tumor growth and metastasis[J].Blood,2009,114(2):357-359.
[10]Chalmin F,Mignot G,Bruchard M,et al.Stat3 and Gfi-1 Transcription Factors Control Th17 Cell Immunosuppressive Activity via the Regulation of Ectonucleotidase Expression[J].Immunity,2012,36(3):362-373.
[11]Gomezrodriguez J,Wohlfert EA,Handon R,et al.Itk-mediated integration of T cell receptor and cytokine signaling regulates the balance between Th17 and regulatory T cells[J].J Exp Med,2014,211(3):529-543.
[12]Chen D,Hu Q,Mao C,et al.Increased IL-17-producing CD4+T cells in patients with esophageal cancer.[J].Cell Immunol,2012,272(2):166-174.
[13]Jiao Z,Gao J,Hua S,et al.Correlation between circulating myeloidderived suppressor cells and Th17 cells in esophageal cancer.[J].World J Gastroenterol,2012,18(38):5454-5461.
[14]蒋国军,谈永飞,周健,等.Th17细胞及IL-17蛋白在食管鳞癌患者外周血、肿瘤组织中的表达及意义[J].山东医药,2012,52(10):64-66.
[15]Ihihara F,Kono K,Takahashi A,et al.Increased Populations of Regulatory T Cells in Peripheral Blood and Tumor-Infiltrating Lymphocytes in Patients with Gastric and Esophageal Cancers[J].Clin Cancer Res,2003,9(12):4404-4408.
[16]Kono K,Kawaida H,Takahashi A,et al.CD4+CD25high regulatory T cells increase with tumor stage in patients with gastric and esophageal cancers[J].Cancer Immunol Immunother,2006,55(9):1064-1071.
[17]Nabeki B,Ishigami S,Uchikado Y,et al.Interleukin-32 expression and Treg infiltration in esophageal squamous cell carcinoma[J].Anticancer Res,2015,35(5):2941-2947.
[18]Xia M,Zhao M,Wu K,et al.Investigations on the clinical significance of FOXP3 protein expression in cervical oesophageal cancer and the number of FOXP3+tumour-infiltrating lymphocytes[J].J Int Med Res,2013,41(4):1002-1008.
[19]Osaki T,Saito H,Fukumoto Y,et al.Inverse correlation between NKG2D expression on CD8+T cells and the frequency of CD4+CD25+regulatory T cells in patients with esophageal cancer[J].Dis Esophagus,2009,22(1):49-54.
[20]Xu T,Duan Q,Wang G,et al.CD4+CD25high Regulatory T Cell Numbers and FOXP3 mRNA Expression in Patients with Advanced Esophageal Cancer Before and After Chemotherapy[J].Cell Biochem Biophys,2011,61(2):389-392.
[21]Vacchelli E,Semeraro M,Enot D,et al.Negative prognostic impact of regulatory T cell infiltration in surgically resected esophageal cancer post-radiochemotherapy[J].Oncotarget,2015,6(25):20840-20850.
[22]杨继乐,张莉,王莉.单核-巨噬细胞的分化和功能研究进展[J].细胞与分子免疫学杂志,2014,30(11):1213-1216.
[23]Hao N,Lu M,Fan Y,et al.Macrophages in Tumor Microenvironments and the Progression of Tumors[J].Clin Dev Immunol,2012:948098-948098.
[24]Miyashita T,Tajima H,Shah FA,et al.Impact of inflammation-metaplasia-adenocarcinoma sequence and inflammatory microenvironment in esophageal carcinogenesis using surgical rat models[J].Ann Surg Oncol,2014,21(6):2012-2019.
[25]Gao J,Wu Y,Su Z,et al.Infiltration of Alternatively Activated Macrophages in Cancer Tissue Is Associated with MDSC and Th2 Polarization in Patients with Esophageal Cancer[J].PLoS One,2014,9(8):e104453.
[26]Koide N,Nishio A,Sato T,et al.Significance of macrophage chemoattractant protein-1 expression and macrophage infiltration in squamous cell carcinoma of the esophagus[J].Am J Gastroenterol,2004,99(9):1667-1674.
[27]解瑞玲,董伯升,庞慧,等.肿瘤相关巨噬细胞在食管癌组织浸润及其对预后的影响[J].中国肿瘤临床,2011,38(2):83-86.
[28]Shigeoka M,Urakawa N,Nakamura T,et al.Tumor associated macrophage expressing CD204 is associated with tumor aggressiveness of esophageal squamouscell carcinoma[J].Cancer Sci,2013,104(8):1112-1119.
[29]Sharma P,Wagner KW,Wolchok JD,et al.Novel cancer immunotherapy agents with survival benefit:recent successes and next steps.[J].Nat Rev Cancer,2011,11(11):805-812.
[30]Torphy R J,Schulick R D,Zhu Y.Newly Emerging Immune Checkpoints:Promises for Future Cancer Therapy[J].Int J Mol Sci,2017,18(12):2642.
[31]Ito S,Okano S,Morita M,et al.Expression of PD-L1 and HLA Class I in Esophageal Squamous Cell Carcinoma:Prognostic Factors for Patient Outcome[J].Ann Surg Oncol,2016,23(4):508-515.
[32]Tanaka K,Miyata H,Sugimura K,et al.Negative influence of programmed death-1-ligands on the survival of esophageal cancer patients treated with chemotherapy[J].Cancer Sci,2016,107(6):726-733.
[33]Lim SH,Hong M,Ahn S,et al.Changes in tumour expression of programmed death-ligand 1 after neoadjuvant concurrent chemoradiotherapy in patients with squamous oesophageal cancer[J].Eur J Cancer,2016,52:1-9.
[34]Chen K,Cheng G,Zhang F,et al.Prognostic significance of programmed death-1 and programmed death-ligand 1 expression in patients with esophageal squamous cell carcinoma[J].Oncotarget,2016,7(21):30772-30780.
[35]Hatogai K,Kitano S,Fujii S,et al.Comprehensive immunohistochemical analysis of tumor microenvironment immune status in esophageal squamous cell carcinoma.[J].Oncotarget,2016,7(30):47252-47264.
[36]Loos M,Langer R,Schuster T,et al.Clinical Significance of the Costimulatory Molecule B7-H1 in Barrett Carcinoma[J].Ann Thor Surg,2011,91(4):1025-1031.
[37]Derks S,Nason KS,Liao X,et al.Epithelial PD-L2 expression marks Barrett's esophagus and esophageal adenocarcinoma[J].Cancer immunol Res,2015,3(10):1123-1129.
[38]Zhang XF,Pan K,Weng DS,et al.Cytotoxic T lymphocyte antigen-4 expression in esophageal carcinoma:Implications for prognosis[J].Oncotarget,2016,7(18):26670-26679.
[39]Kudo T,Hamamoto Y,Kato K,et al.Nivolumab treatment for oesophageal squamous-cell carcinoma:an open-label,multicentre,phase 2 trial[J].Lancet Oncol,2017,18(5):631-639.
[40]Doi T,Piha-Paul SA,Jalal SI,et al.Safety and Antitumor Activity of the Anti-Programmed Death-1 Antibody Pembrolizumab in Patients With Advanced Esophageal Carcinoma[J].J Clin Oncol,2018,36(1):61-67.

