CPEB4在非小细胞肺癌中表达及其对预后的预测价值
肺癌是常见的恶性肿瘤之一,目前发病率和死亡率居所有肿瘤的第一位。非小细胞肺癌(nonsmall cell lung cancer,NSCLC)约占所有肺癌患者的85%[1]。尽管近些年手术、放疗、化疗及靶向药物在肺癌中的应用明显提高了NSCLC的5年生存率,然而NSCLC远期预后仍很差[2]。目前认为NSCLC的发生发展涉及一系列分子生物学的变化,其中有研究证明细胞翻译水平变化与NSCLC发生密切相关[3]。胞质多聚腺苷酸化元件结合蛋白(cytoplasmic polyade⁃nylation element binding proteins,CPEB)蛋白家族是具有序列特异性的RNA结合蛋白,含有RNA识别基序和锌指结构。CPEB4是新发现的CPEB家族成员之一。目前发现在调节有丝分裂和减数分裂细胞周期中起重要的作用[4]。有学者发现CPEB4与肿瘤的生长、侵袭和转移,血管形成密切相关。Lu等[5]研究发现CPEB4在乳腺浸润性导管癌组织的高表达,并且发现高表达的CPEB4与低级别的肿瘤分化程度和淋巴结转移密切相关。另有研究发现,在脑膜瘤中发现CPEB4也高表达,并且表达与预后密切相关[6]。在消化道肿瘤中,有学者发现在胃癌中CPEB4基因高表达[7],直肠癌中相比正常组织,CPEB4基因也高表达[8],推测CPEB4可能在肿瘤发生发展中发挥癌基因作用。分子机制方面发现CPEB4在肿瘤发生发展中受miRNA调控,进而引起下游基因变化[9],与肿瘤发生密切相关。然而CPEB4在NSCLC中研究较少,本研究通过检测细胞株及组织中CPEB4 mRNA和蛋白的表达,并结合NSCLC患者CPEB4的表达,探讨CPEB4在NSCLC发生发展及预后中的价值。
1 材料与方法
1.1 一般资料
收集2007年6月至2012年12月在郑州大学附属洛阳市中心医院实施肺癌根治术并具有完整临床病理资料及组织石蜡标本的NSCLC 102例患者的随访记录。患者纳入标准为:1)病理诊断为NSCLC;2)所有患者按照TNM分期(第7版)进行诊断,病理诊断分期为Ⅰ~Ⅲa期;3)术前未接受新辅助放化疗及靶向治疗;4)病理库中存有患者肿瘤组织。为研究CPEB4 mRNA和蛋白在肿瘤组织和正常组织之间差别,选取2017年1月到6月10例Ⅰ~Ⅲa期肺癌手术患者,患者均进行了根治性切除;术后留取肿瘤组织及对应邻近正常组织标本进行分析。
1.2 方法
1.2.1 培养及细胞株mRNA检测 NSCLC细胞株(H322、H1975和A549)和WI-38正常肺细胞株由郑州大学第一附属医院所提供;培养基为RPMI 1640和10%胎牛血清和青、链霉素,细胞系保持在37℃、5%CO2和95%空气环境中。根据试剂盒进行总RNA提取,后进行基因的扩增。CPEB4引物序列为5′-ACAGTGACTTTGTGATGG ATGG-3'and 5′-TTATCATCGCAAGCTCCACA-3';βactin:5′-CCAACCGCGAGAAGATGA-3'and 5′-CCAGA GGCGTACAGGGATAG-3'。结果用ABI PRISM 7500 PCR仪分析,自动生成Ct(2-ΔΔCt)值。
1.2.2 Westem blot检测蛋白表达 总蛋白提取物在10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳凝胶电泳分离,后转至PVDF膜。加入原兔抗人CPEB4(美国Abcam公司),然后对膜进行清洗15 min,3×PBS-T用辣根过氧化物酶(HRP)标记的抗兔免疫球蛋白抗体(1:2 000)在室温下60 min。然后用10 min的免疫复合物PBS-T洗涤3次。利用软件技术测定了凝胶的蛋白条带的强度。以盐酸甘油醛脱氢酶(GAPDH)作为参照。最后计算出蛋白相对表达量。
1.2.3 免疫组织化学阳性判定 常规烤片、脱蜡、水化,加入柠檬酸钠缓冲液抗原修复,用3%过氧化氢阻断内源性过氧化物酶,5%羊血清封闭30 min,CPEB4兔抗人单克隆抗体(美国Abcam公司)室温孵育2 h,之后磷酸缓冲盐溶液(PBS)洗涤,后加入二抗山羊抗兔IgG(美国Sigma公司)室温孵育30 min,PBS充分洗涤,流水冲洗后用苏木素复染,乙醇、二甲苯脱水,最后封片镜检。
免疫组织化学结果由2名专业病理科医生独立进行评估,取光学显微镜400倍的视野下进行观察。阳性细胞占全部细胞的比例并记分:<9%为0分,10%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。按染色强度评分:未着色或与背景一致为0分,浅黄色为1分,棕黄色为2分,黄褐色为3分。采取染色强度和肿瘤细胞阳性率综合评价染色指数。阳性细胞率计分乘以着色强度评分≤3分为表达阴性,>3分为表达阳性[6]。
1.2.4 随访 术后定期复查,第1年每3个月1次,第2年每6个月1次,3年以后每年1次,进行定期随访。随访时进行肿瘤标记物等检测,若怀疑复发和转移,进一步进行CT检测。
1.3 统计学分析
采用SPSS17.0软件进行统计学分析。对连续性变量进行正态分布检测,t检验比较连续性变量之间的表达差异,χ2检验分析蛋白表达与临床病理因素之间的关系,Logistic分析进行相关性多因素分析。Ka⁃plan-Merier生存分析进行单因素分析,Log rank比较组间差异,将单因素有意义的因素纳入Cox回归进行多因素分析。P<0.05为差异具有统计学意义。
2 结果
2.1 NSCLC患者临床病理情况
本研究共纳入102例NSCLC患者,免疫组织化学分析显示CPEB4主要集中于细胞质中(图1),本研究NSCLC石蜡标本中CPEB4阳性表达39例,阳性表达率38.2%,患者其他病理资料见表1。

图1 苏木素染色后CPEB4在NSCLC组织中的表达情况

表1 102例NSCLC患者临床病理基本情况
2.2 CPEB4 mRNA及蛋白的表达
CPEB4 mRNA在NSCLC细胞株H322(0.65±0.13)、H1975(0.52±0.14)和A549(0.59±0.21)表达水平明显高于WI-38正常肺细胞株(0.23±0.09),肺癌组织和正常组织比较差异具有统计学意义(P<0.05)。CPEB4 mRNA在肺癌组织中表达为(0.54±0.17)高于邻近正常肺组织(0.26±0.10),肺癌组织和正常组织比较具有统计学意义(P<0.05,图2)。
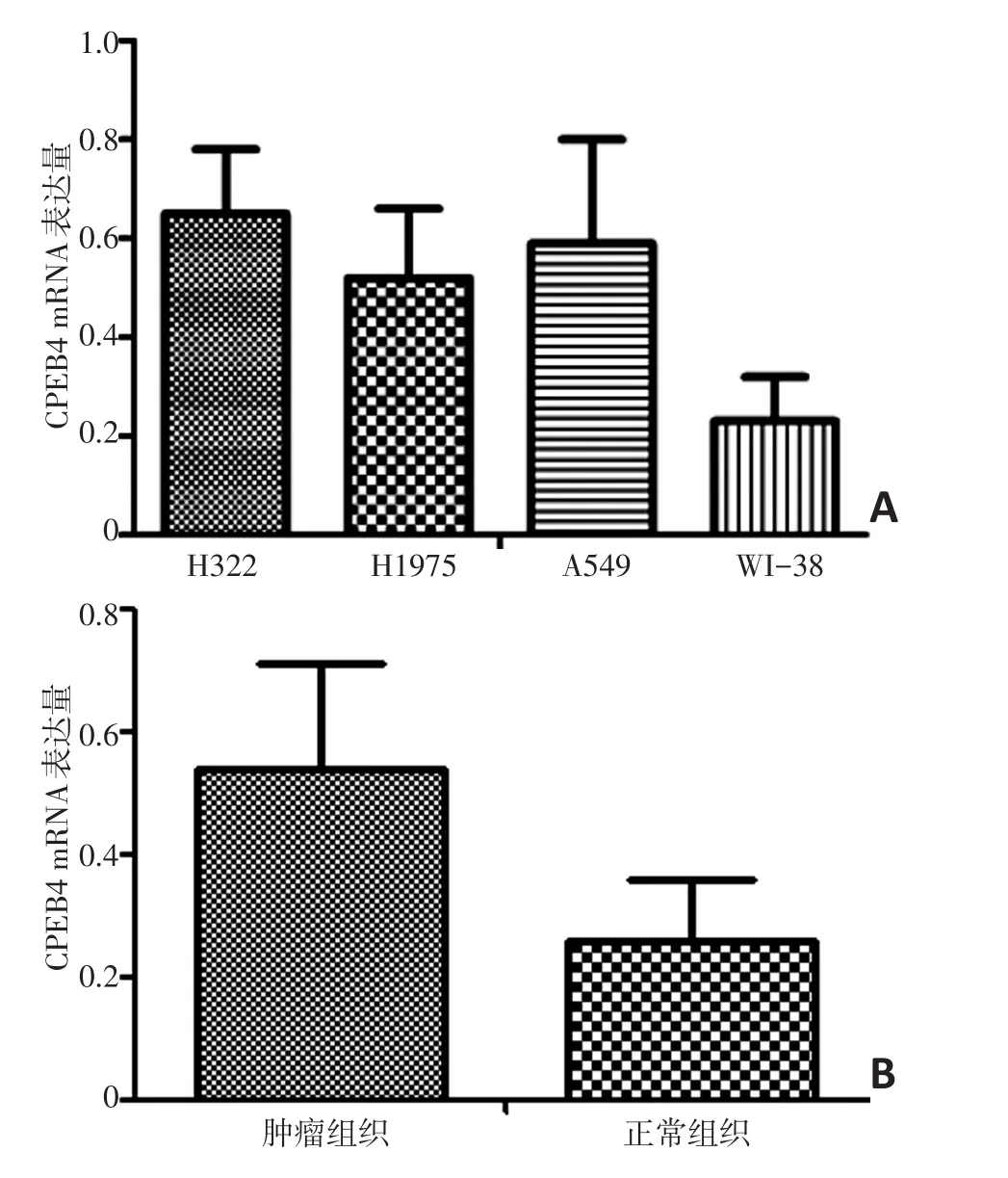
图2 CPEB4 mRNA在NSCLC细胞株、NSCLC肿瘤组织以及正常肺细胞株、正常组织之间的差异
CPEB4蛋白在NSCLC细胞株H322(1.16±0.22)、H1975(0.97±0.32)和A549(1.13±0.40)表达明显高于WI-38正常肺细胞株(0.57±0.12),肺癌组织和正常组织比较(P<0.05)。同时发现CPEB4蛋白在肺癌组织(1.09±0.26)中表达高于邻近正常肺组织(0.54±0.17),肺癌组织和正常组织比较差异具有统计学意义(P<0.05,图3)。
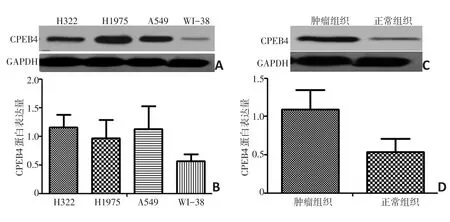
图3 CPEB4蛋白在NSCLC细胞株、NSCLC肿瘤组织以及正常肺细胞株、正常组织之间的表达差异
2.3 CPEB4蛋白与临床病理因素的相关性
χ2相关分析结果显示T分期和N分期与CPEB4表达密切相关,Logistic多因素分析发现N分期HR为1.883,P<0.05)是CPEB4表达独立相关因素,进一步发现淋巴结分期越晚,CPEB4阳性表达越高(表2)。
2.4 预后生存分析
本研究预后单因素分析结果显示,性别、年龄、吸烟史、组织类型、肿瘤位置与肿瘤部位与患者预后无关(P>0.05),而T分期(P<0.05)、N分期(P<0.001)与CPEB4表达(P<0.001)与患者预后相关,CPEB4阳性表达预后生存差于CPEB4阴性表达患者(图4)。将单因素分析有意义的纳入Cox多因素分析,结果显示T分期(HR为1.447,P<0.05)、N分期(HR为1.366,P<0.05)与CPEB4表达(HR为1.804,P<0.05)是患者独立预后因素(表3)。
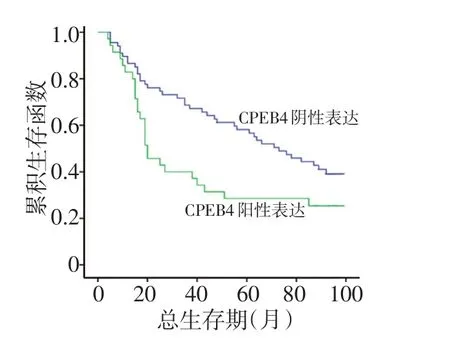
图4 NSCLC患者CPEB4表达的预后生存分析
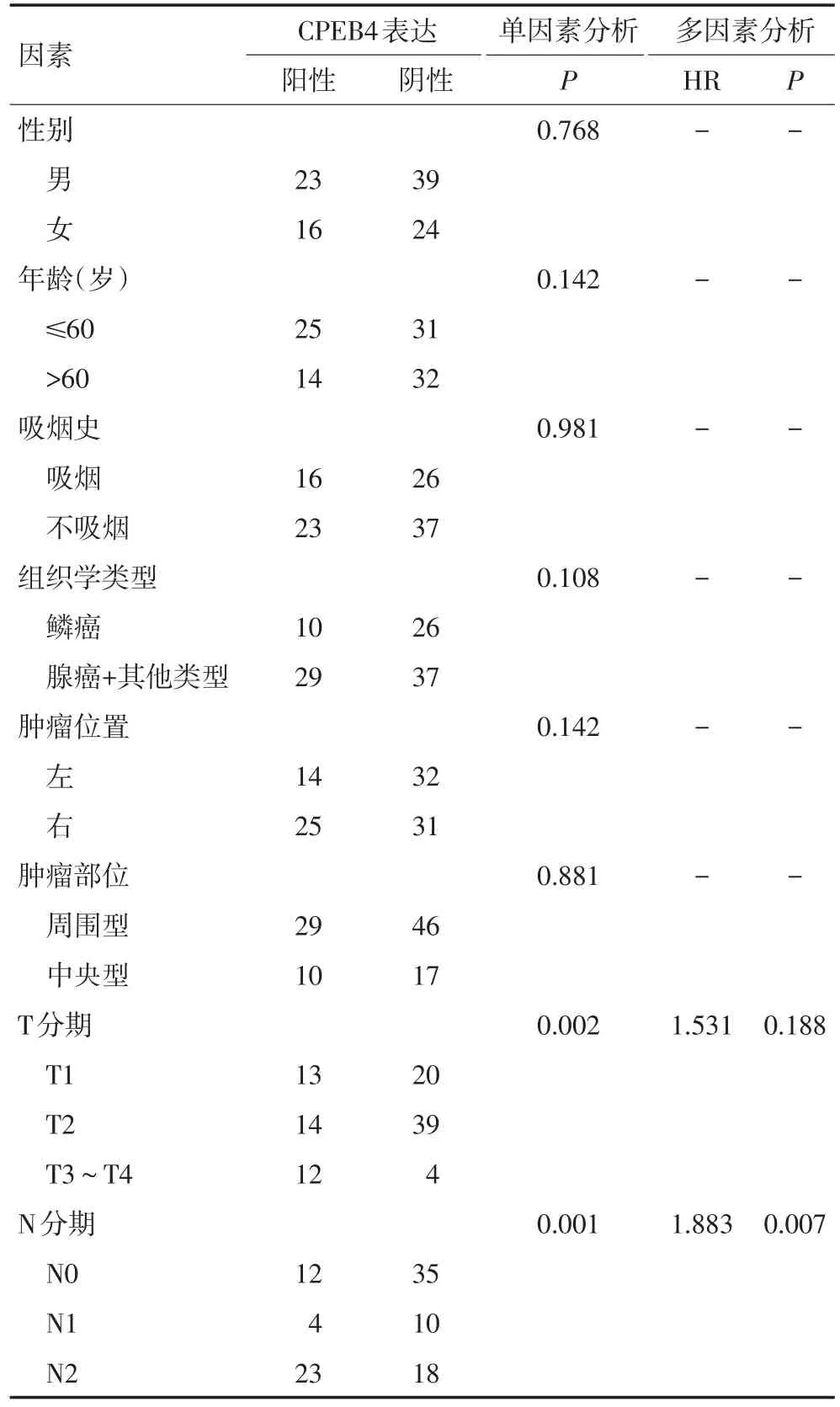
表2 102例NSCLC患者CPEB4表达与临床病理因素相关性分析

表3 NSCLC患者预后生存分析
3 讨论
CPEB家族包含4个成员,所有的CPEB蛋白具有类似的结构,羧基端相对保守,而氨基末端高度变异[4]。目前研究发现CPEBs与生殖细胞的发育、细胞分裂与衰老、突触可塑性以及学习与记忆等密切相关[10]。CPEB4是新发现的胞质多聚腺苷酸化元件结合蛋白家族成员之一。CPEB4与肿瘤的发生密切相关,研究发现CPEB4与mRNA转录及翻译密切相关,CPEB4激活mRNA过程并影响翻译,导致下游因子如细胞信号转导元件、细胞周期蛋白、凋亡相关分子、及细胞迁移相关基因等,进而影响肿瘤的进展[11]。Chang等[12]研究发现CPEB4与接头蛋白相互作用,影响JNK信号通路,进而影响细胞的迁移。CPEB4与多种肿瘤发生发展密切相关。研究发现,CPEB4在脑胶质瘤组织中高表达,差异具有统计学意义;并且CPEB4表达与病理分级、肿瘤大小和颅内高压征等肿瘤特性密切相关[13]。田伟峰等[7]发现CPEB4基因在胃癌组织中高表达,肿瘤大小、肿瘤部位和T分期与CPEB4表达相关。Tsai等[14]发现CPEB4在肝癌细胞中高表达,敲除CPEB4抑制肝癌细胞侵袭转移。预后生存方面,Hansen等[15]研究发现CPEB4高表达是结直肠癌患者预后独立因素,临床上可检测CPEB4表达预测结直肠癌患者预后。同样在胃癌中,CPEB4表达也为预后独立因素。
本研究进一步结合NSCLC患者临床病理资料,研究CPEB4与临床病理因素之间的相关性及探讨其在预后中的价值。首先发现NSCLC细胞株CPEB4 mRNA和蛋白的表达明显高于正常肺细胞株,同时发现NSCLC肿瘤组织中CPEB4 mRNA和蛋白的表达明显高于邻近正常组织,相关性分析发现CPEB4表达与肿瘤淋巴结转移密切相关,进一步分析发现淋巴结分期越晚,CPEB4阳性表达越高。根据这些结果,推测CPEB4可能与NSCLC发生及发展密切相关,可能作为癌基因发挥作用。与Tsai等[14]研究相一致,发现CPEB4与MMP-2和MMP-9密切相关,结合之前研究推测CPEB4与肿瘤转移密切相关。然而本研究尚未就CPEB4对侵袭方面具体机制方面进行探讨,将来通过体内外实验研究进一步研究CPEB4具体机制。生存发现CPEB4表达阳性患者预后差于CPEB4表达阴性患者。预后多因素分析发现CPEB4表达为患者独立预后因素,表明CPEB4高表达患者可能为预后高危人群,CPEB4可作为NSCLC预后预测指标。
本研究发现,CPEB4在NSCLC细胞中高表达,CPEB4表达与淋巴结转移密切相关,CPEB4为预后独立因素,为NSCLC治疗提供潜在靶点。
[1] Siegel R,Naishadham D,Jemal A.Cancer statistics[J].CA Cancer J Clin,2013,63(1):11-30.
[2] Kong F,Gao F,Chen J,et al.Overexpressed LAPTM4B-35 is a risk factor for cancer recurrence and poor prognosis in non-small-cell lung cancer[J].Oncotarget,2016,7(35):56193-56199.
[3] Marshall AL,christiani DC.Genetic susceptibility to lung cancer-light at the end of the tunnel[J]?Carcinogenesis,2013,34(3):487-502.
[4] Lin CL,Evans V,Shen S,et al.The nuclear experience of CPEB:Implications for RNA processing and translational control[J].RNA,2010,16(2):338-348.
[5] Lu R,Zhou Z,Yu W,et al.CPEB4 promotes cell migration and invasion via upregulating Vimentin expression in breast cancer[J].Biochem Biophys Res Commun,2017,489(2):135-141.
[6] Zhijun L,Dapeng W,Hong J,et al.Overexpression of CPEB4 in glioma indicates a poor prognosis by promoting cell migration and invasion[J].Tumour Biol,2017,39(4):1010428317694538.
[7] 田伟峰,郎小梅.CPEB4和VEGF-C在胃癌中的表达及其临床意义[J].临床与病理杂志,2017,37(9):1833-1839.
[8] 万仁辉,温宜清,吕勇,等.CPEB4在结直肠癌组织中表达及其与预后的关系[J].消化肿瘤杂志,2016,8(3):171-175.
[9] Zhong X,Xiao Y,Chen C,et al.MiR-203-mediated posttranscriptional deregulation of CPEB4 contributes to colorectal cancer progression[J].Biochem Biophys Res Commun,2015,466(2):206-213.
[10]Wilczynska A,Git A,Argasinska J,et al.CPEB and miR-15/16 Co-Regulate Translation of Cyclin E1 mRNA during Xenopus Oocyte Maturation[J].PLoS One,2016,11(2):e0146792.
[11]Fernandez-Miranda G,Mendez R.The CPEB-family of proteins,translational control in senescence and cancer[J].Ageing Res Rev,2012,11(4):460-472.
[12]Chang YW,Huang YS.Arsenite-activated JNK signaling enhances CPEB4-Vinexin interaction to facilitate stress granule assembly and cell survival[J].PLoS One,2014,9:e107961.
[13]Shin J,Salameh JS,Richter JD.Impaired neurodevelopment by the low complexity domain of CPEB4 reveals a convergent pathway with neurodegeneration[J].Sci Rep,2016,6:29395.
[14]Tsai LY,Chang YW,Lee MC,et al.Biphasic and Stage-Associated Expression of CPEB4 in Hepatocellular Carcinoma[J].PLoS One,2016,11(5):e0155025.
[15]Hansen CN,Ketabi Z,Rosenstierne MW,et al.Expression of CPEB,GAPDH and U6snRNA in cervical and ovarian tissue during cancer development[J].APMIS,2009,117(1):53-59.

