短小芽孢杆菌AR03挥发性有机物的抑菌活性及其组分分析
王静,曹建敏,陈德鑫,邱军,王晓强,冯超,王文静
短小芽孢杆菌AR03挥发性有机物的抑菌活性及其组分分析
王静,曹建敏,陈德鑫,邱军,王晓强,冯超,王文静
(中国农业科学院烟草研究所,山东青岛 266101)
【目的】对分离自烟草根际土壤中的一株短小芽孢杆菌()AR03菌株产生的挥发性有机物进行抑菌活性测定和组分分析。【方法】采用培养皿对扣熏蒸法和凹玻片孢子萌发法测定挥发性有机物对烟草黑胫病菌(var.)和赤星病菌()菌落、菌丝生长以及孢子萌发的影响,采用离体叶片接种法测定挥发性有机物对烟草黑胫病和赤星病的防治效果;采用顶空加热法收集抑菌挥发性有机物,对其进行气相色谱-质谱(GC-MS)检测,并结合保留指数(retention index,RI)和内标(internal standard,IS)1-十五烯对其组分进行定性和定量分析。【结果】短小芽孢杆菌AR03菌株分泌的挥发性有机物对供试的两种病原真菌均具有一定的抑制作用,表现为经处理后的烟草黑胫病菌菌丝生长稀疏缓慢变粗、分支增多且扭曲、断裂;赤星病菌菌丝生长畸形,其上不产生分生孢子梗,内含物大部分聚集成团导致菌丝干瘪、缢缩。对峙培养2、4、6和8 d时,挥发物对黑胫病菌和赤星病菌菌丝生长的抑制率分别为56.21%和59.23%、64.75%和59.86%、66.13%和61.10%、67.04%和70.00%;对黑胫病菌游动孢子和赤星病菌分生孢子的抑制作用表现为延迟萌发且萌发后的芽管生长缓慢;黑胫病菌产生孢子囊数明显减少,赤星病菌分生孢子各分隔处的细胞畸形肿胀成泡状。离体叶片抗病测定结果显示,挥发性有机物抑制黑胫病菌和赤星病菌病斑在叶片的扩展,对峙熏蒸40 h时,对照叶片黑胫病的发病率为92.50%,圆形坏死病斑直径是25.10 mm,经挥发物处理后叶片发病率为70.83%,病斑直径为9.45 mm,对黑胫病斑扩散的抑制率为62.35%;对峙熏蒸80 h时,对照叶片赤星病的发病率为88.33%,病斑扩散为近圆形的褐色坏死斑,平均直径为8.32 mm,经挥发物处理后赤星病的发病率为60.80%,病斑扩展较慢,平均直径为2.85 mm,挥发物对赤星病斑扩散的抑制率为65.75%。SPME GC-MS分析表明,AR03菌株胞外分泌7种组分挥发性物质,均为C15H24结构的倍半萜烯类化合物,分别是二氢姜黄烯、()--金合欢烯、-姜黄烯、-姜烯、-红没药烯、-倍半萜水芹烯和--红没药烯;AR03培养1 d后,其中-倍半萜水芹烯相对含量最高,为80.64%,其次为()--金合欢烯和-姜烯,相对含量分别为7.20%和6.67%;随着AR03培养时间的延长,各组分种类相同,但相对含量差异较大,除二氢姜黄烯含量保持基本不变外,其他组分含量呈递减趋势,培养至第6天时,各组分含量下降超过50%。【结论】短小芽孢杆菌AR03菌株能够产生具有较强抑菌活性的挥发性有机物,有潜力作为开发抗真菌代谢物和新药物的重要微生物资源。
短小芽孢杆菌AR03; 挥发性有机物;烟草黑胫病菌;烟草赤星病菌;顶空-固相微萃取-气质联用
0 引言
【研究意义】烟草黑胫病(病原菌var.)和赤星病(病原菌)是威胁世界烟草生产的两个重要病害。黑胫病常导致植株萎蔫坏死、根部变黑腐烂,最终整株死亡,每年对世界烟草生产造成百亿美元的损失[1]。目前,黑胫病的防治措施主要包括健康栽培、抗性品种利用、合理轮作及杀菌剂甲霜灵(metalaxyl)的施用。然而,长期大量施用甲霜灵会带来环境问题并产生抗甲霜灵菌株的风险[2]。赤星病是烟草成熟期叶部重要的病害之一,气候适宜往往暴发流行,造成严重经济损失。使用化学杀菌剂是赤星病防治的主要措施,但可能会导致烤后烟叶农残超标。因此,寻找能持续防控此病害和其他作物同类病害的新途径具有重要意义。【前人研究进展】利用有益微生物(生物农药)作为合理而安全的作物管理措施是较有前景的方法[3]。基于拮抗微生物和病原物互作的生物防治被认为是减少化学农药使用和改善植物健康的可替代或补充的方式[4-5]。研究表明,生物防治因子(biological control agents,BCAs)如芽孢杆菌()、假单胞菌()、放线菌()、木霉菌()和酵母菌(yeast)在抑制病原细菌和真菌方面均具有良好的表现[6-10]。生物防治因子的作用机制主要包括抗生作用,定殖位点、营养或矿物质的竞争,寄生和噬菌体[11];其中通过分泌抗真菌代谢物质(antifungal metabolites,AFMs)来发挥对病原真菌的抗生作用是最常见的策略,目前研究较多的抗真菌代谢物质主要有抗生素、酶和挥发物[12]。作为抗真菌代谢物质之一的混合着各种以碳为基础的气相混合物的挥发性有机物(volatile organic compounds,VOCs),由于其小分子,体积小,易扩散到大气和土壤中,是理想的信息素,并且已被应用于昆虫、致病和污染有害菌的生物防治。作为生物防治因子的芽孢杆菌属细菌种类繁多,能够产生大量广谱且具有抗生活性的次生代谢产物,其中环状的脂肽类物质具有抗真菌和细菌等生物学功能[13],在这些抗生物质中,挥发性物质大都是由一组低分子量亲脂类物质组成的混合物,来源于很多微生物的不同生物合成途径,其中的一些挥发性代谢产物可采用气体处理的方式用于生物熏蒸[14]。围绕芽孢杆菌属细菌产生挥发物的抗生活性已展开了广泛的研究,20世纪90年代,Fiddaman等[15]报道了枯草芽孢杆菌()分泌抗真菌挥发性物质过程中培养基质的重要性。近来又相继报道了解淀粉芽孢杆菌()在果实病害防治中的应用,解淀粉芽孢杆菌CPA-8产生的挥发物质抑制甜樱桃采后果实腐烂真菌核果褐腐菌()、美澳型核果褐腐菌()和灰葡萄孢()菌丝的生长,能减轻樱桃采后腐烂程度。通过SPME-GC分析,CPA-8产生的主要挥发物为1,3-戊二烯、3-羟基丁酮和噻吩,各纯品的体外菌丝生长抑制试验和对3种腐烂病菌的EC50测定结果显示,噻吩是挥发物中最有效的成分[16]。在防治植物细菌病害方面,解淀粉芽孢杆菌T-5菌株产生的挥发物能够明显地抑制引起番茄青枯病的青枯雷尔氏菌(),且对该病菌的运动性、根部定殖、生物膜形成及其胞外多糖的产生具有抑制作用[17]。【本研究切入点】分离自贵州烟区黑胫病田块健康烟株根际土壤的短小芽孢杆菌()AR03菌株,对烟草黑胫病菌、赤星病菌、青枯病菌、白粉病菌和炭疽病菌均有较好的拮抗活性,兼具促生作用[18-21]。进一步的研究表明,AR03发酵液(3×108cfu/ml)对上述病原菌具有拮抗活性,但其除菌上清液却无活性。笔者对该拮抗菌株分泌的活性物质进行分析,发现该菌株能够产生挥发性物质且具有拮抗活性。【拟解决的关键问题】分析短小芽孢杆菌AR03菌株产生的挥发性物质对烟草黑胫病菌、赤星病菌的抑菌活性及其组成成分,为该菌株在病害生物防治上的应用提供理论依据。
1 材料与方法
试验于2016年9月至2017年9月在中国农业科学院烟草研究所完成。
1.1 供试菌株、培养基、培养条件与试剂
短小芽孢杆菌AR03(CGMCC No. 4117)分离和鉴定参见文献[18]。常规活化采用NA培养基(酵母提取物5.0 g,蛋白胨5.0 g,氯化钠1.5 g,琼脂13.0 g,蒸馏水1 L,pH 7.3,121℃灭菌20 min),28℃恒温、黑暗条件培养36 h。将AR03接种于NB培养基(配方同NA,不加琼脂)中,120 r/min、28℃振荡培养48 h后获得AR03发酵液,经低温冷冻离心后的菌体经适量ddH2O梯度稀释后,采用分光光度计调整菌体悬浮液浓度为108cfu/mL,备用。
烟草黑胫病菌和烟草赤星病菌为笔者实验室在田间病株采集、分离、鉴定并保存。活化黑胫病菌和赤星病菌培养基分别为燕麦培养基(OA)和马铃薯葡萄糖培养基(PDA),28℃培养5 d后备用。皮氏培养液:硝酸钙0.4 g,磷酸二氢钾0.15 g,硝酸镁0.15 g,氯化钙0.06 g,蒸馏水1 L,121℃ 15 min灭菌,备用。土壤浸出液:称取烟草品种红花大金元根际土壤25 g,溶于50 g蒸馏水中,搅拌均匀后室温静置30 min,经滤纸过滤后的溶液121℃ 15 min灭菌,备用。手动萃取手柄,50/30 µm DVB/CAR/PDMS萃取头,20 mL棕色顶空瓶,购自美国Supelco公司;1-十五烯、正构烷烃(C7-C30)购自北京百灵威公司;二氯甲烷、甲醇均为色谱纯;美国安捷伦7890B-5975C气相色谱质谱仪。
1.2 挥发性有机物对烟草黑胫病菌和赤星病菌体外抑制作用测定
1.2.1 对菌丝生长和形态的影响 接种环粘取活化的AR03菌落后均匀、密集地于NA平板上划线,使该细菌布满平板;另取烟草黑胫病菌和赤星病菌菌碟(Φ=5 mm)分别接种于OA和PDA平板的中央,参照王静等[21]方法在距菌碟1.5 cm处30°倾斜插入灭菌的盖玻片,然后与布满AR03菌体的NA平板对扣,周围用封口膜密封,28℃、黑暗条件下恒温培养,另以空白NA平板为对照,间隔2 d分别观察并测量处理和对照平板菌落直径,一直到对照平板菌丝长满,共调查4次,每处理3次重复。生长抑制率计算公式参照周翠等[22],比较挥发物的拮抗效果。试验重复2次。抑制率计算公式:
抑制率(%)=(单独培养菌落直径-菌落趋向直径)/单独培养菌落直径×100
分别将培养6 d的烟草黑胫病菌和赤星病菌培养皿内附着菌丝的盖玻片置于倒置显微镜下(目镜10倍)观察经挥发物处理后菌丝的形态变化。
1.2.2 对孢子萌发的影响 首先制备烟草黑胫病菌游动孢子悬浮液和赤星病菌分生孢子悬浮液。分别将预先活化的黑胫病菌和赤星病菌菌碟(Φ=5 mm)接种于OA和PDA平板中央28℃培养14 d后,诱导黑胫病菌产生孢子囊和游动孢子悬浮液制备方法如下:在盛有15 mL皮氏培养液无菌培养皿内接入8个黑胫病菌菌碟(Φ=6 mm),然后加入100 µL土壤浸出液,置于28℃恒温箱中黑暗培养3 d后,将培养皿置于4℃搁置2 h,再转到28℃条件培养18 h,在无菌条件下,将培养皿内的菌饼移入盛有适量无菌水的离心管中,轻微振荡后经4层无菌纱布过滤收集游动孢子,载玻片法在光学显微镜下观察,随后通过梯度稀释和血小球计数板计数法将游动孢子悬浮液调整为2×104个/mL备用。赤星病菌孢子悬浮液制备方法如下:倒入适量的无菌水于长满菌丝的平板内,用涂布器涂布平板表面,使得菌丝和孢子悬浮于无菌水中,将此混合液经4层无菌纱布过滤后并收集,按照上述方法在倒置显微镜下观察并调整孢子悬浮液浓度为2×104个/mL,备用。
各取100 µl黑胫病菌游动孢子悬浮液和赤星病菌孢子悬浮液置于灭菌的凹玻片上,同时置于保湿的培养皿内,上面倒扣均匀划满AR03菌体的NA平板,对照为NA培养基,封口膜密封后置于28℃恒温分别黑暗培养6 h后,在倒置显微镜下观察形态变化。每个视野观察10个孢子,共观察5个视野,芽管的长度是孢子的两倍视为孢子萌发。计算各处理抑制游动孢子和分生孢子萌发和生长的抑制率,每处理3次重复。试验重复2次。孢子萌发抑制率计算公式:
孢子萌发抑制率(%)=(对照组孢子萌发数-处理组孢子萌发数)/对照组孢子萌发数×100
1.2.3 挥发性有机物离体叶片的抑菌测定 挥发物抑制烟草黑胫病和赤星病的离体叶片生测接种采用菌饼接种和孢子悬浮液悬滴接种,具体如下:于NA平板(直径15 cm)密集划线接种AR03菌株,对照为空白的NA平板;另外培养皿底部分别放置2片大小适宜的烟草叶片红花大金元(用于黑胫病生测试验)和品种NC89(成熟期,用于赤星病抗病试验),浸湿的棉球包围叶柄保湿,叶片表面无菌水喷雾后,在主脉两侧各选取适宜数量的接种点,针刺制造伤口后,分别接种黑胫病菌碟(Φ=6 mm)和悬滴100 µL赤星病菌孢子悬浮液(浓度为1×107个孢子/mL),每处理10个皿,3次重复。将接种细菌的培养皿与接种叶片的培养皿对扣后Parafilm封口膜密封,30℃黑暗条件下对峙培养40 h和80 h后调查病斑在叶片上扩展情况并计算抑制率。抑制率计算公式:
病斑扩展抑制率(%)=(对照组病斑直径-处理组病斑直径)/对照组病斑直径×100
1.3 挥发性有机物的收集及其组分分析
1.3.1 1-十五烯内标溶液配制 称取20 mg 1-十五烯对照品,纯度不低于98.5%,用甲醇定容于10 mL容量瓶中,得到浓度为2 mg·mL-11-十五烯内标母液,然后取适量1-十五烯内标母液用甲醇稀释400倍,得到浓度为5 µg·mL-11-十五烯内标溶液,备用。
1.3.2 AR03细菌挥发物收集-顶空-固相微萃取法 移液器吸取3 mL尚未冷却的NA培养基(约55℃),倾倒于20 mL灭菌的棕色顶空瓶中,并将瓶体倾斜15°角,待培养基冷却凝固后,取100 μL预先制备好的AR03菌悬液均匀涂布于培养基斜面上,迅速用含有聚四氟内涂层的瓶盖封口,将顶空瓶置于28℃恒温箱中静置、黑暗培养,为了排除培养基释放的挥发物和萃取头涂层流失对细菌挥发物鉴定结果的干扰,设置不涂布AR03菌悬液处理为空白对照,每个样品3个重复。
将培养2 d的顶空瓶置于室温中平衡20 min后,采用50/30 µm DVB/CAR/PDMS萃取头(购于Supelco公司)进行采样,萃取头使用前,需先按照厂家提供的说明书进行老化。采样前首先用5 μL尖头微量注射器向顶空瓶侧壁注入2 μL浓度为5 µg·mL-11-十五烯内标溶液,注意尽量避免接触培养基基质,平衡30 min后,将SPME针管刺入顶空瓶,同时将萃取头推出,置于顶空瓶上部1/3处,采集细菌分泌的挥发性有机物,采样时间为30 min。采集完毕后,将萃取头收起,并将针管拔出样品瓶,样品收集结束。
1.3.3 利用气象色谱-质谱联用(GC-MS)技术分析挥发性物质组分 GC-MS分析条件:色谱柱DB-5MS弹性毛细管色谱柱,规格为30 m×0.25 mm×0.25 μm;进样口250℃:不分流模式;初始温度40℃,以100℃·min-1速率升至250℃,解吸时间5 min;载气为99.999%氦气,流速为1.0 mL·min-1;柱温箱:初始温度40℃,保持2 min,以5℃·min-1速率升至180℃,保持10 min,以10℃·min-1速率升至280℃,保持15 min,总运行时间为55 min;EI离子源,电子能量70 ev;离子源温度230℃,四级杆温度150℃,传输线温度280℃;全扫描模式,扫描范围30—400 m/z。数据采集处理系统,安捷伦MassHunter(B.05.02)软件。
1.3.4 抑菌挥发性有机物成分鉴定 挥发物MS结果经NIST和WILIY谱库自动检索,要求匹配率>80,初步进行识别。对于识别的每种代谢物,根据其相邻正构烷烃的保留时间和碳原子数,计算其保留指数,然后查阅文献报道的该物质在相同色谱柱中的保留指数(retention index,RI),进一步进行确证。保留指数计算公式:
RI=100z+100[TR(x)-TR(z)]/[TR(z+1)-TR(z)](线性程序升温)
式中,TR(x)、TR(z)、TR(z+1)分别代表组分x及碳数为z、z+1正构烷的保留温度。且TR(z)<TR(x)<TR(z+1),由于保留温度和保留时间通常具有高度的相关性,所以用保留时间代替上式中的保留温度来进行计算保留指数。
1.3.5 不同生长期抑菌挥发性有机物组分定量分析 按照1.3.2方法分别将培养1、3、6 d的AR03,按照1.3.2、1.3.3和1.3.4方法收集细菌挥发物进行GC-MS检测,并进行定量分析。抑菌挥发性有机物半定量分析以添加到顶空瓶中的1-十五烯作为内标(internal standard,IS),假设内标与生防菌株AR03挥发物的相对校正因子为1,按下述公式计算目标代谢物的相对含量。
mi= m15×(Ai/A15)
式中,mi为目标代谢物含量(µg);m15为加入1-十五烯的量(µg);Ai为目标代谢物总离子流图峰面积;A15为1-十五烯总离子流图峰面积。
2 结果
2.1 挥发性有机物对供试病原菌菌丝生长的影响
平板对扣法测定结果显示,挥发性有机物对烟草黑胫病菌和赤星病菌菌丝生长的抑制作用较强,对赤星病菌的抑制表现为菌落生长缓慢且培养性状异常;对黑胫病菌的抑制表现为菌丝生长稀疏且菌落生长迟缓,而对照菌落生长正常(图1-A、1-B)。培养6 d的黑胫病菌和赤星病菌菌丝生长速率的测定结果如图2。从图中可以看出,该抑菌挥发物对两种供试病原菌菌丝生长均有不同程度的抑制作用,抑制率随时间的延长而增长,对峙培养8 d时,对黑胫病菌和赤星病菌的菌丝生长抑制率分别为67.04%和70.00%。镜检观察显示,挥发物处理后的黑胫病菌生长缓慢、稀疏,菌丝扭曲、分枝增多且断裂;经挥发物处理的赤星病菌菌丝畸形,其上不产生分生孢子梗,内含物聚集成团导致菌丝粗细不均、缢缩。

图1 挥发性有机物对烟草赤星病菌(A)和黑胫病菌(B)的抑菌活性
2.2 挥发性有机物对供试病原菌孢子萌发的影响
赤星病菌菌分生孢子经抑菌挥发性有机物处理后萌发受到抑制,且延迟萌发后的芽管生长缓慢、短小畸形,大部分分生孢子畸形,表现为各分隔处的细胞肿胀成圆球状泡或其他不规则形,而对照孢子均正常萌发且芽管生长正常。经挥发性有机物处理后的黑胫病菌产生的孢子囊数量明显减少游动孢子萌发延迟,且萌发后芽管比空白对照生长缓慢。
2.3 挥发性有机物抑菌活性的离体叶片测定
挥发性有机物抑菌试验结果如表1和图3,培养至40 h和80 h,对照叶片的病斑扩散迅速,黑胫病发病率为92.50%,病斑表现为水浸状斑块沿接种点向周围扩散为近圆形,病斑直径平均为25.10 mm;经挥发物处理后叶片发病率为70.83%,病斑直径的平均值为9.45 mm,挥发物对黑胫病斑扩散的抑制率为62.35%。对照叶片赤星病的发病率为88.33%,病斑扩散为近圆形的褐色坏死斑,平均直径为8.32 mm;经挥发物处理后赤星病的发病率为60.80%,病斑扩展较慢,平均直径为2.85 mm,挥发物对赤星病斑扩散的抑制率为65.75%。
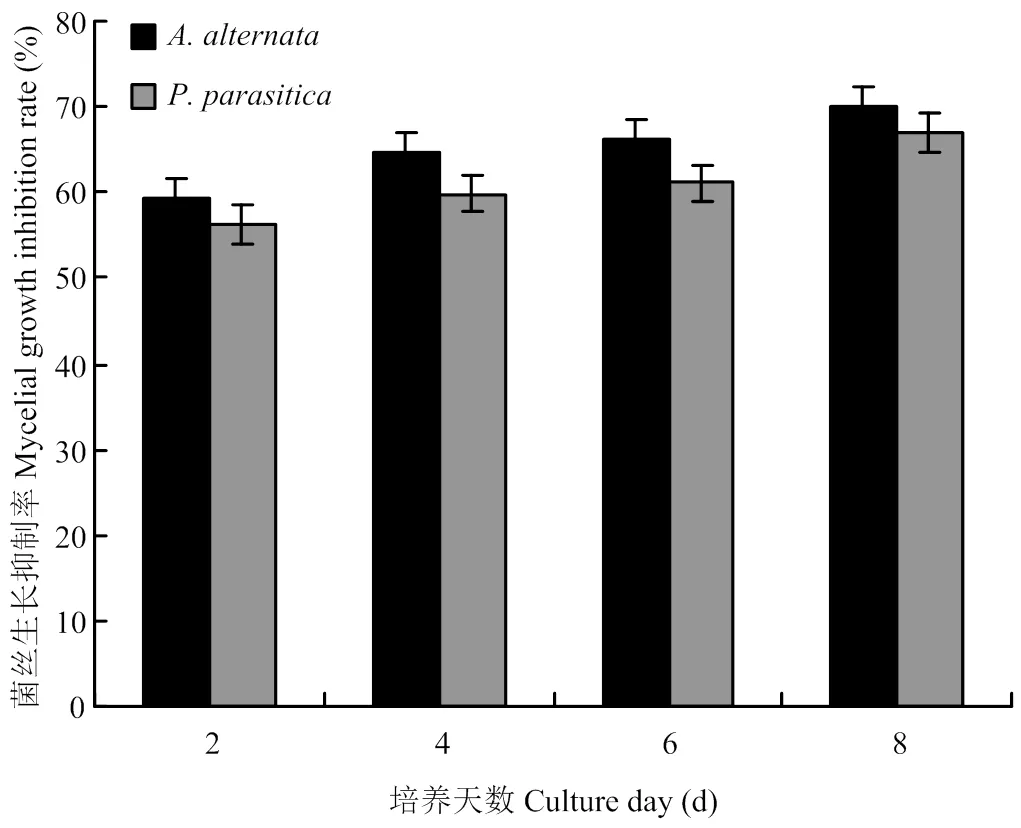
图2 挥发性有机物对烟草赤星病菌和黑胫病菌菌丝生长的影响
2.4 基于SPME GC-MS技术获得AR03抑菌挥发性有机物总离子流图
将上述获得的吸附挥发物的萃取头,在全扫描模式下进行分析,得到正构烷烃(C10-C20)、空白样品挥发物和细菌挥发性有机物的总离子流图(图4-A、4-B、4-C)。根据前期试验结果,初步判定AR03产生的抑菌代谢混合物为倍半萜烯类物质(C15H24),本方法选用结构式相近的1-十五烯为内标物(C15H30),因其属性与目标代谢物相似,在色谱图中出峰时间比较接近,且经检验AR03抑菌挥发代谢物在十五烯的保留时间内,无干扰峰出现(图4-A)。将GC-MS采集的AR03挥发物总离子流图,扣除空白样品挥发物总离子流图中共有色谱峰(图4-B),即为挥发性有机物特征指纹峰(图4-C),该菌体分泌的抑菌挥发性有机物共为7种,色谱峰出现的时间相对集中于22—25 min,主要成分为保留时间24.72 min的一种化合物,相对含量很高,而其他各物质含量相对较低,且各挥发物间不存在重叠性。
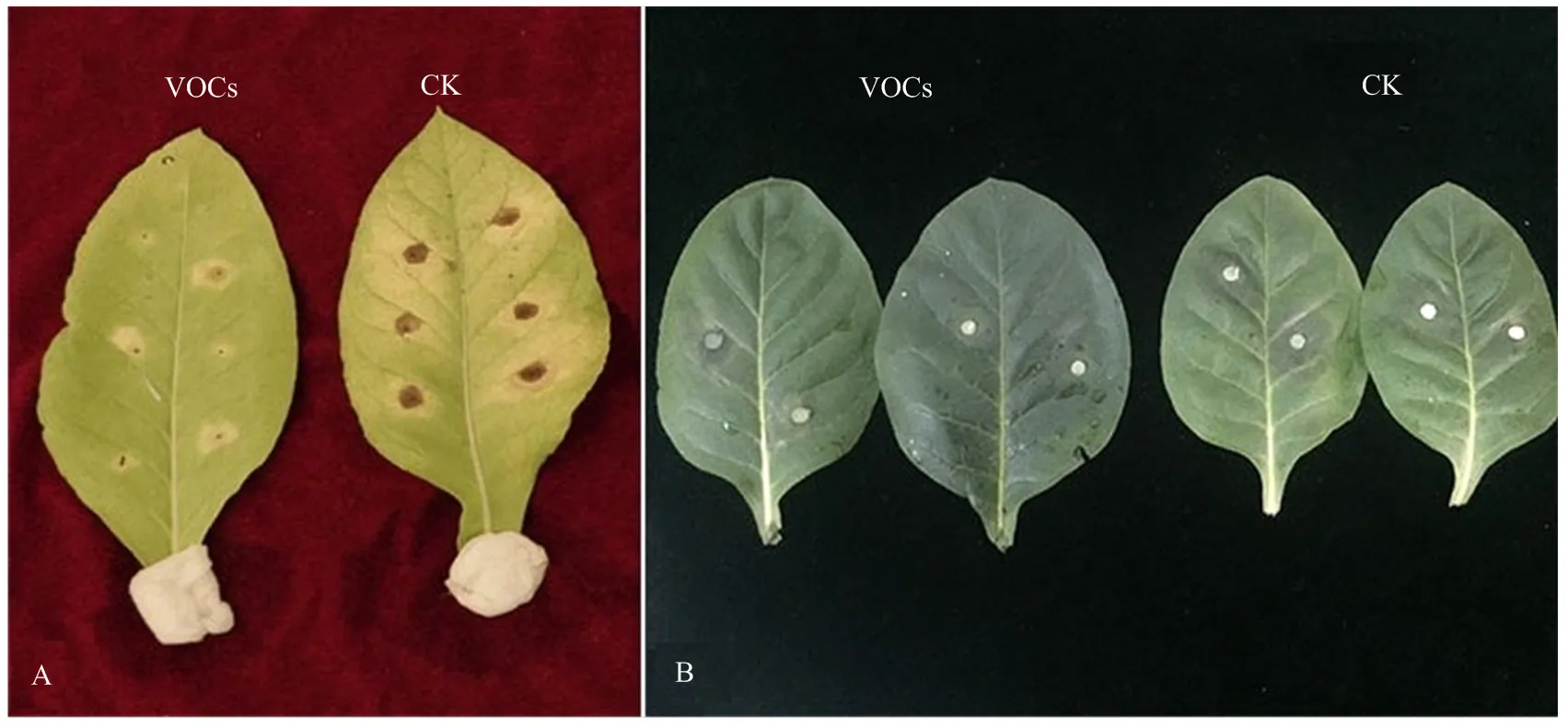
A:对赤星病的抑制效果Inhibition effect on tobacco brown spot;B:对黑胫病的抑制效果Inhibition effect on tobacco black shank
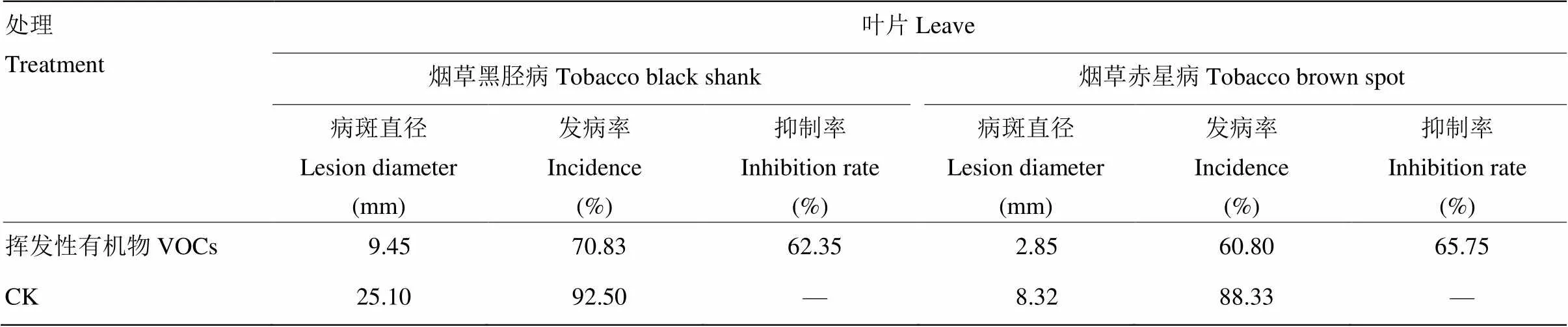
表1 AR03菌株分泌的挥发性有机物对烟草黑胫病和赤星病的防治效果
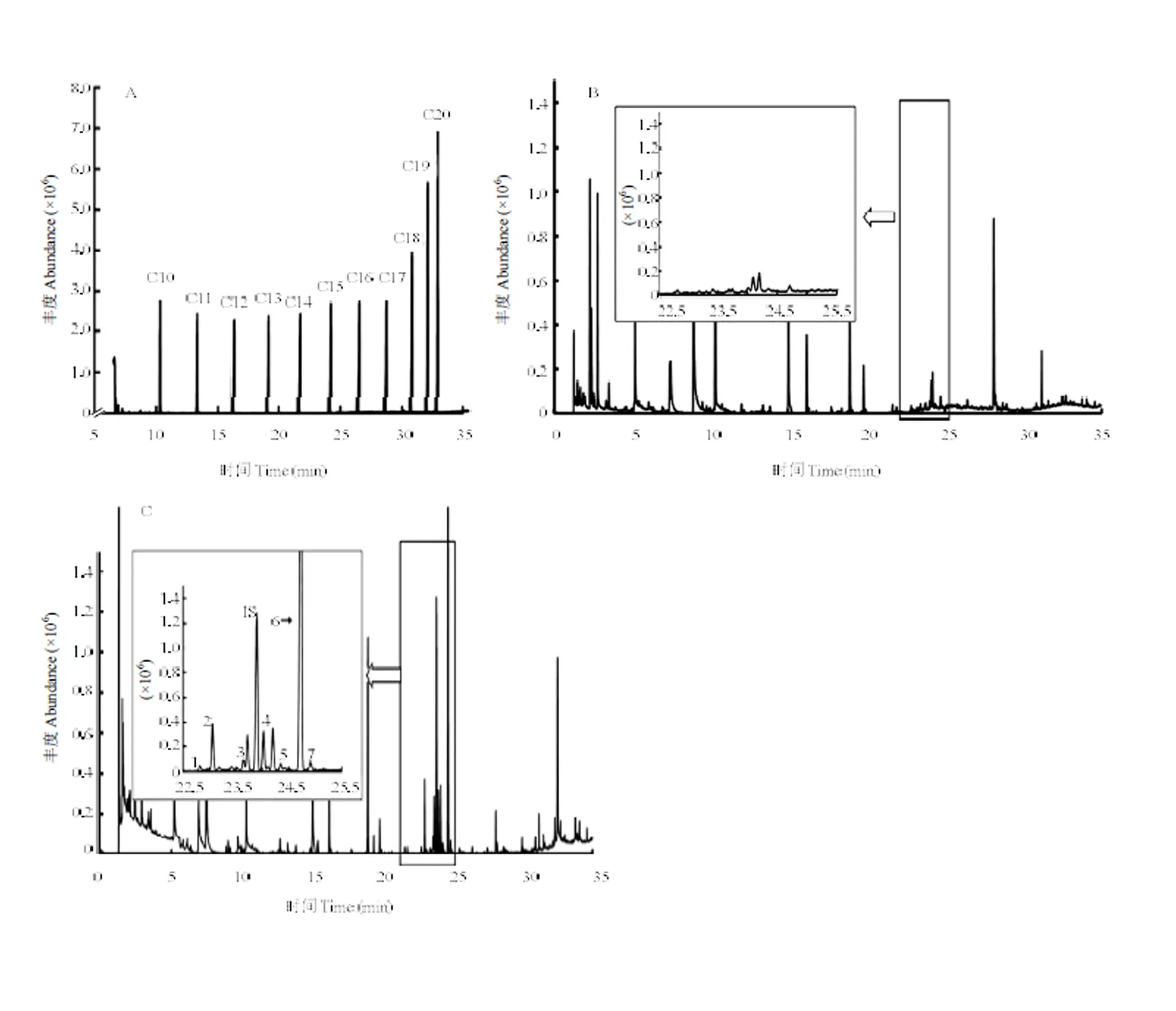
A:正构烷烃(C10-C20)总离子流图Total ion flow diagram of n-alkanes (C10-C20);B:空白基质挥发物总离子流图Total ion flow chart of volatile matter in blank matrix;C:AR03挥发物总离子流图Total ion flow chart of volatile matter in AR03
2.5 挥发性有机物的定性与定量分析
将2.4中获得细菌挥发物总离子流图,扣除空白样品挥发物总离子流图中共有色谱峰,即为AR03菌株释放的挥发性特征指纹峰。计算每个色谱峰的保留指数,结合使用NIST和WILIY谱库,对总离子图中色谱峰进行定性识别,设置匹配度阈值为80,AR03抑菌挥发代谢物定性匹配结果见表2,该菌株分泌的抑菌挥发物共7种且均为C15H24结构的倍半萜烯类化合物,根据色谱峰出现的先后顺序分别为二氢姜黄烯、()--金合欢烯、-姜黄烯、-姜烯、-红没药烯、-倍半萜水芹烯和--红没药烯;内标1-十五烯在色谱图中出峰时间比较接近,且经检验AR03抑菌挥发性有机物在十五烯的保留时间内。
2.6 不同生长期AR03挥发性有机物定量分析
AR03菌株分别培养1、3和6 d后,其分泌的抑菌挥发性有机物相对含量有一定差异(表3),且随着时间的延长呈递减趋势,当细菌培养1 d时,挥发物各组分相对含量最高,尤其是-倍半萜水芹烯的分泌量高达112.01 ng,占总含量的80.64%,其次为()--金合欢烯和-姜烯,相对含量分别为7.20%和6.67%;培养至3 d时,除了二氢姜黄烯含量小幅度升高外,挥发物其他各组分相对含量均逐渐降低,培养至6 d时,相对含量减少50%左右,各组分含量下降较明显。
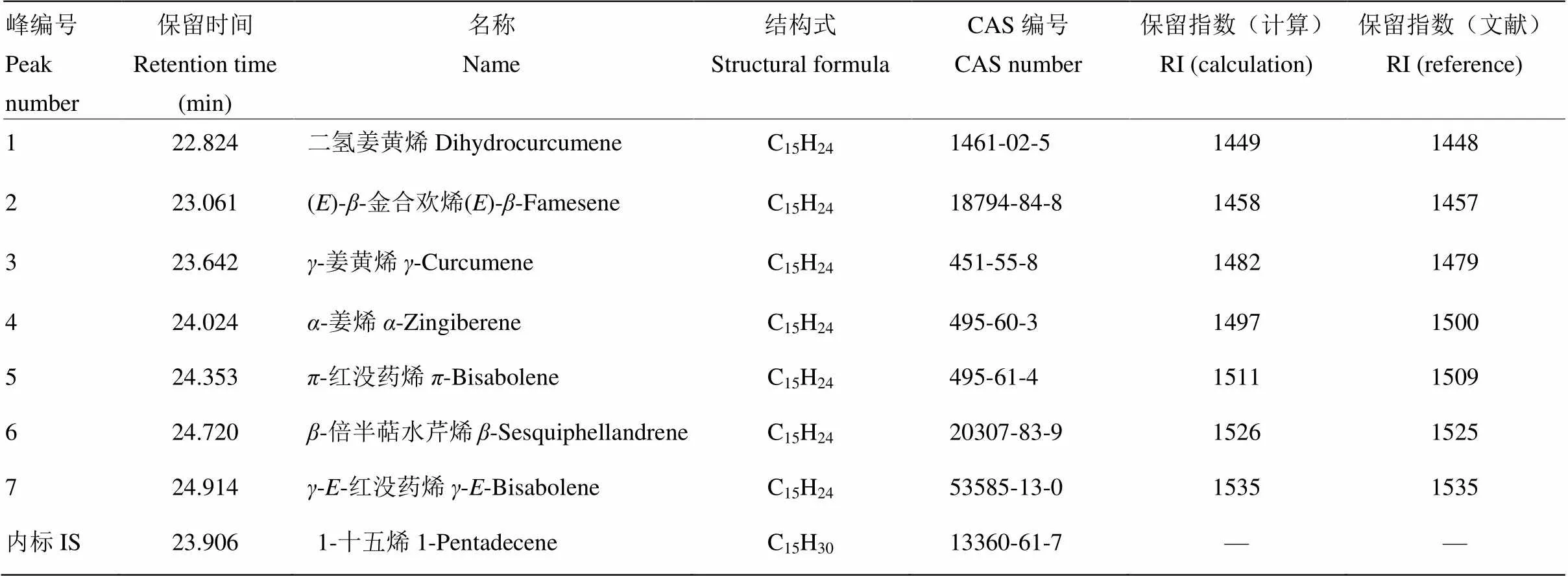
表2 AR03菌株抑菌挥发性有机物的鉴定
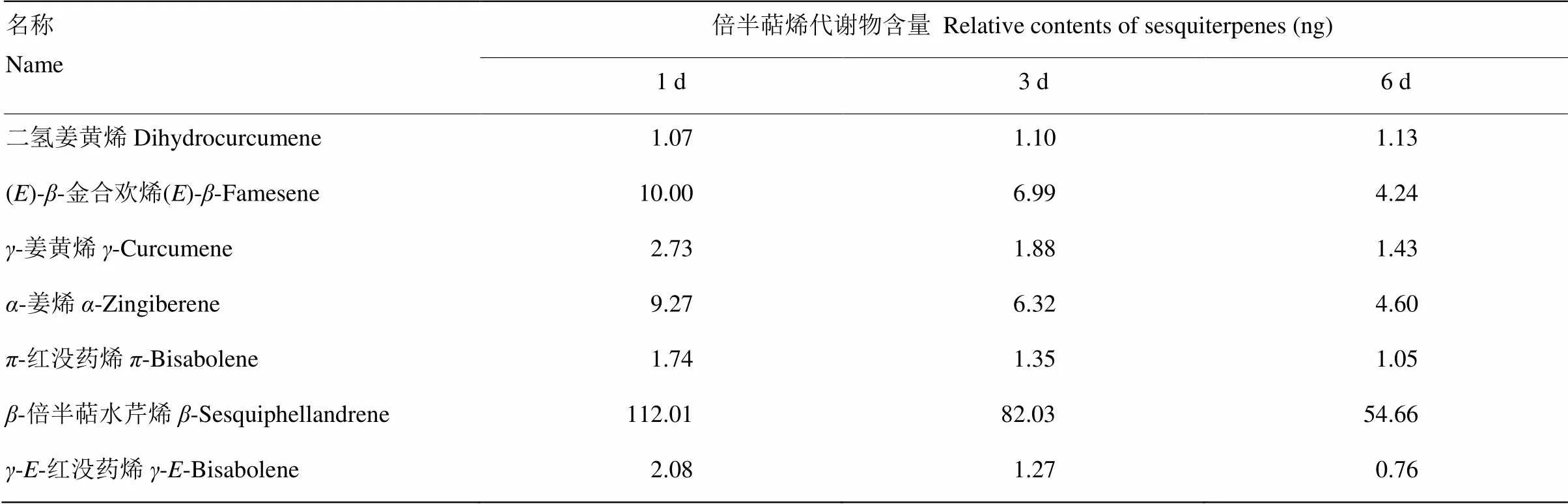
表3 AR03菌株挥发性有机物组分定量分析
3 讨论
能分泌抑菌挥发性有机物的细菌在微生物界普遍存在,Zou等[23]随机选择1 018种细菌中,有328株细菌可以产生抗真菌的挥发性物质。与非挥发性抗菌物质相比,挥发性抑菌物质分子小,更易于在土壤和环境中渗透和扩散,能更全方位地杀灭环境中的病原菌,并能通过调节激素的代谢促进植物生长[24]。在植物病害生物防治中,细菌分泌抗真菌性挥发物质的鉴定及其应用是由Fernando等[25]首次报道,分离自大豆根部的绿针假单胞菌()PA-23挥发物在体外和土壤中能抑制核盘菌()菌丝生长及子囊孢子和菌核的萌发,凹玻片萌发法测定结果显示挥发物对子囊孢子萌发的抑制率为54%—90%;本研究中的短小芽孢杆菌AR03菌株产生的挥发物对烟草黑胫病菌和赤星病菌菌丝、菌落生长和孢子萌发具有不同程度的抑菌和致畸作用,结合AR03菌株先前的研究结果分析其活性物质,该菌株产生胞外抑菌挥发物与其拮抗活性紧密相关,且是该菌株对黑胫病菌和赤星病菌拮抗机制的关键因子。挥发性有机物是很理想的信息化学物质,由于它们的易扩散性,挥发物的活动范围可以从近处的互作扩展到更远的距离[26]。本试验中,AR03菌株分泌的抑菌挥发物利用其扩散的特性,抑制了离体叶片上病斑的扩展,从而减轻病害发生。在烟草生产上,可以将菌株施入土壤或喷施在叶片上,产生的抑菌挥发物在土壤或烟株周围的环境中扩散进而充分保护烟株根部或叶片免受病原菌的侵染。
细菌在代谢过程中产生的挥发性物质种类较多,Kai等[11]通过顶空收集法和GC-MS技术分析了不同细菌产生的挥发性物质,发现不同的细菌能分别产生1—30种不同组分的挥发性化合物。已有很多研究报道了关于挥发性有机物具有抗植物病原真菌的活性,例如三甲胺(trimethylamine)抑制白地霉()菌丝生长和孢子形成[27],Almenar等[28]鉴定了spp.产生的14种不同的挥发物,包括二乙基己醇(2-ethyl-hexanol)、对羟基苯甲醛(4-hydroxybenzaldehyde)和壬酮(2-nonanone)等抗真菌挥发物;Arrebola等[29]采用GC-MS技术检测分析拮抗果实采后病菌青霉()的枯草芽孢杆菌PPCB01和解淀粉芽孢杆菌PPCB04产生挥发性抑菌物质,PPCB01菌株产生21种不同类型的挥发物,而PPCB04菌株产生8种不同的挥发物,其中3-羟基-2-丁酮是主要抑菌成分,含量分别为45.98%和97.52%。在本研究中,采用将AR03菌株产生的挥发性有机物经顶空收集采样并进行GC-MS定性和定量分析,省去了普遍采用有机溶剂萃取的步骤,避免了有机溶剂不能完全萃取到所有挥发物质的缺点。GC-MS分析表明,AR03菌株产生7种C15H24结构的倍半萜烯类物质。相关研究表明,大多数倍半萜烯化合物具有芳香和重要的生物活性,是研究天然产物和开发新药物的重要来源,广泛存在于生姜()[30]、人参()[31]、刺芹属植物[32]及中药假鹰爪()果实[33]等植物体中,本研究报道了来源于微生物次级代谢产物的倍半萜烯类化合物,为挖掘和开发具有药用前景的倍半萜烯提供了新的微生物资源和途径。
天然产物在开发抗癌药物中发挥着重要的作用,约80%的药物来源于天然产物[34]。已有相关文献报道本试验中抑菌挥发物质的一些组分具有重要的生物活性,相对含量为80.64%的-倍半萜水芹烯是一种重要的香料和药理活性物质,1984年首次发现于生长于冰岛的早花百里香的挥发油中[35];还存在于姜、艾草()[36]及美国冷杉()叶片和嫩枝的挥发油中[37]。近期,Tyagi等[38]从姜黄粉的酒精浸提物中分离获得的-倍半萜水芹烯具有抗恶性细胞扩散的活性,能抑制人类白血病细胞、骨髓瘤细胞和结直肠癌细胞的增殖;通过细胞内酯酶活性、质膜完整性和细胞相试验发现,该物质还可以高效地抑制癌细胞克隆形成和诱导细胞凋亡。另外一个相对含量较高的组分()--金合欢烯是一种重要的警报信息素,大多数蚜虫都能产生和利用该种激素,它的挥发释放参与蚜虫间的化学聚集,特别是能干扰蚜虫取食,可用于蚜虫的生物防治[39-40]。AR03菌株挥发物中的-姜烯也具有重要的药理活性,据Bou等[41]研究发现,从林生脚骨脆叶()粗提精油中分离的-姜烯纯品对人宫颈癌HeLa、U-87、Siha和HL60细胞系具有细胞毒素活性,但其抑制中浓度(IC50)比粗提精油高。本研究鉴定的倍半萜烯各组分的药理活性尚需进一步验证。
生物挥发性物质的释放是动态的过程,在细菌生长的过程中,随着时间的变化和培养基的消耗,挥发物质的种类和数量会发生变化[42-43]。本研究通过保留指数和以1-十五烯为内参测定AR03菌株不同培养时间产生挥发物的相对含量,发现随着时间的延长,各组分种类不变,但相对含量呈降低趋势,原因主要包括以下两个方面:其一可能是细菌生长经过对数期、稳定期进入衰亡期,繁殖越来越慢,代谢活动减慢,代谢产物亦随之减少;另一个可能原因是GC-MS分析挥发物除了倍半萜物质外,还含有戊二烯(C5H8),由于戊二烯含有含多种同分异构体(1,3-戊二烯、反式-1,3-戊二烯、1,4-戊二烯、反式-1,4-戊二烯等),这些异构体的质谱图相似度极高,且在DB-5MS色谱柱中保留行为较差,出峰时间较早(在本文报道色谱条件下1.6 min出峰),无法准确确证。因此笔者推测挥发物中的倍半萜烯类物质具有化学不稳定性,随着培养时间的延长,可能降解为单体戊二烯,加上该物质无生物活性,本试验未对其进行分析。另外值得注意的是,先期的研究结果显示,AR03发酵液对烟草赤星病菌分生孢子萌发有很强的抑制效果,经一定浓度含菌发酵液处理的分生孢子几乎不萌发,而本试验结果显示,AR03产生挥发物对供试病原菌分生孢子萌发的抑制和致畸作用比发酵液的抑菌作用弱,因此,挥发物质的抑菌活性可能只是AR03菌株抑菌作用的一部分;另外,挥发物对分生孢子萌发的影响采用的凹玻片萌发法,因为分生孢子分散于无菌水中,挥发物无法直接作用于分生孢子从而不能充分发挥其抑菌活性;AR03菌株分泌的挥发物在密封的培养皿空间内分散后浓度低可能也是影响其抑菌活性的重要因素。
4 结论
经室内培养皿对扣熏蒸法、凹玻片萌发法和离体叶片抗病测定,基本确定短小芽孢杆菌AR03菌株分泌的挥发性有机物对烟草黑胫病菌和赤星病菌菌丝生长具有抑制和致畸作用,抑制黑胫病菌产生孢子囊并延迟游动孢子的萌发;抑制赤星病菌分生孢子的萌发并引致孢子畸形;同时抑制黑胫病菌和赤星病菌病斑在叶片上的扩展。SPME GC-MS分析表明,AR03能分泌二氢姜黄烯、()--金合欢烯、-姜黄烯、-姜烯、-红没药烯、-倍半萜水芹烯和--红没药烯7种C15H24结构的倍半萜烯类物质,其中-倍半萜水芹烯相对含量最高,其次为()--金合欢烯和-姜烯。短小芽孢杆菌AR03菌株有潜力作为开发抗真菌代谢物和新药物的重要微生物资源。
[1] ChacÓn O, HernÁndez I, Portieles R, LÓpez Y, Pujol M, BorrÁs-Hidalgo O. Identification of defense-related genes in tobacco responding to black shank disease., 2009, 177(3): 175-180.
[2] CARTWRIGHT D K, SPURR H W. Biological control ofvar.on tobacco seedlings with non-pathogenic binucleatefungi., 1998, 30(14): 1879-1884.
[3] FRAVEL D R. Commercialization and implementation of biocontrol., 2005, 43: 337-359.
[4] HANDELSMAN J, STABB E V. Biocontrol of soilborne plant pathogens., 1996, 8: 1855-1869.
[5] COMPANT S, DUFFY B, NOWAK J, CLÉMENT C, BARKA E A. Use of plant growth-promoting bacteria for biocontrol of plant diseases: Principles, mechanisms of action, and future prospects., 2005, 71(9): 4951-4959.
[6] RAN L X, LIU C Y, WU G J, VAN LOON L C, BAKKER P A. Suppression of bacterial wilt inby fluorescentspp. in China.,2005, 32: 111-120.
[7] BRESSAN W. Biological control of maize seed pathogenic fungi by use of actinomycetes.,2003, 48: 233-240.
[8] BRUNNER K, ZEILINGER S, CILIENTO R , WOO S L, LORITO M, KUBICEK C P, MACH R L. Improvement of the fungal biocontrol agentsto enhance both antagonism and induction of plant systemic disease resistance., 2005, 71(7): 3959-3965.
[9] HUANG H C, HUANG J, SAINDON G, ERICKSON R S. Effect of allyl alcohol and fermented agricultural wastes on carpogenic germination of sclerotiaofand colonization byspp., 1997, 19(1): 43-46.
[10] PATIñO-VERA M, JIMéNEZ B, Baldreras K, Ortiz M, Allende R, Carrillo A, Galindo E. Pilot-scale production and liquid formulation of, a potential biocontrol agent of mango, anthracnose., 2005, 99: 540-550.
[11] KAI M, EFFMERT U, BERG G, PIECHULLA B. Volatiles of bacterial antagonists inhibit mycelial growth of the plant pathogen., 2007, 187: 351-360.
[12] RAAIJMAKERS J M, VLAMI M, DE SOUZA J T. Antibiotic production by bacterial biocontrol agents., 2002, 81: 537-547.
[13] DIMKIĆ I, BERIĆ T, STEVIĆ T, PAVLOVIĆ S, ŠAVIKIN K, FIRA D, STANKOVIĆ S. Additive and synergistic effects ofspp. isolates and essential oils on the control of phytopathogenic and saprophytic fungi from medicinal plants and marigolds seeds., 2015, 87: 6-13.
[14] MARI M, BAUTISTA-BAŇOS S, SIVAKUMAR D. Decay control in the postharvest system: role of microbial and plant volatile organic compounds., 2016, 122: 70-81.
[15] FIDDAMAN P J, ROSSALL S. Effect of substrate on the production of antifungal volatiles from., 1994, 76(4): 395-405.
[16] GOTOR-VILA A, TEIXIDÓ N, DI FRANCESCO A D, USALL J, UGOLINI L, TORRES R, MARI M. Antifungal effect of volatile organic compounds produced byCPA-8 against fruit pathogen decays of cherry., 2017, 64: 219-225.
[17] RAZA W, WANG J C H, WU Y CH, LING N, WEI Z H, HUANG Q W, SHEN Q R. Effects of volatile organic compounds byon the growth and virulence traits of tomato bacterial wilt pathogen, 2016, 100(17): 7639-7650.
[18] 王静, 赵廷昌, 孔凡玉, 何月秋, 张成省, 刘建华, 刘伟成. 拮抗细菌对烟草青枯病的温室防病及促生效果. 植物保护, 2007, 33(5): 103-106.
WANG J, ZHAO T C, KONG F Y, HE Y Q, ZHANG C S, LIU J H, LIU W C. Disease-preventing and growth-promoting effect of antifungal against tobacco wilt., 2007, 33(5): 103-106. (in Chinese)
[19] 王静, 孔凡玉, 秦西云, 张成省, 张秀玉. 短小芽孢杆菌AR03对烟草黑胫病菌的拮抗活性及其田间防效. 中国烟草学报, 2010, 16(5): 78-81.
WANG J, KONG F Y, QIN X Y, ZHANG C S, ZHANG X Y. Inhibition and bio-control activity ofAR03 against tobacco black shank., 2010, 16(5): 78-81. (in Chinese)
[20] 王静, 孔凡玉, 陈晓红, 田华. 短小芽胞杆菌AR03对烟草炭疽病的抑制作用. 植物保护, 2015, 41(1): 104-107.
WANG J, KONG F Y, CHEN X H, TIAN H. The inhibitory effect ofAR03 against tobacco anthracnose., 2015, 41(1): 104-107. (in Chinese)
[21] 王静, 田华, 孔凡玉, 王贻鸿, 张成省, 冯超. 短小芽孢杆菌AR03对烟草赤星病菌和白粉病菌的防治. 应用生态学报, 2015, 26(10): 3167-3173.
WANG J, TIAN H, KONG F Y, WANG Y H, ZHANG C S, FENG C. Inhibition ofAR03 onandon tobacco., 2015, 26(10): 3167-3173. (in Chinese)
[22] 周翠, 乔鲁芹, 金静, 马跃, 赵相涛, 刘会香. 一株枯草芽孢杆菌挥发性物质的抑菌作用初步研究. 农药学学报, 2011, 13(2): 201-204.
ZHOU C, QIAO L Q, JIN J, MA Y, ZHAO X T, LIU H X. Preliminary study on the inhibitory effect of the volatile substances produced by., 2011, 13(2): 201-204. (in Chinese)
[23] ZOU C S, MO M H, GU Y Q, ZHOU J P, ZHANG K Q. Possible contributions of volatile-producing bacteria to soil fungistasis., 2007, 39(9): 2371-2379.
[24] TAHIR H A S, GU Q, WU H J, RAZA W, HANIF A, WU L M, COLMAN M V, GAO X W. Plant growth promotion by Volatile organic compounds produced bySYST 2., 2017, 8: Article 171.
[25] FERNANDO W G D, RAMARATHNAM R, KRISHNAMOORTHY A S, SAVCHUK S C. Identification and use of potential bacterial organic antifungal volatiles in biocontrol., 2005, 37(5): 955-964.
[26] WHEATLEY R E. The consequences of volatiles organic compound mediated bacterial and fungal interactions., 2002, 81: 357-364.
[27] ROBINSON P M, MCKEE N D, THOMPSON L A A, HARPER D B, HAMILTON J T G. Autoinhibition of germination and growth in.,1989, 93(2): 214-222.
[28] ALMENAR E, AURAS R, WHARTON P S, RUBINO M, HARTE B. Release of acetaldehyde from-cyclodextrins inhibits postharvest decay fungi., 2007, 55(17): 7205-7212.
[29] ARREBOLA E, SIVAKUMAR D, KORSTEN L. Effect of volatile compounds produced bystrains on postharvest decay in citrus., 2010, 53: 122-128.
[30] 孙江伟, 王军. 生姜挥发油研究进展. 中医研究, 2016, 29(2): 75-77.
SUN J W, WANG J. Advances on volatile oil of ginger., 2016, 29(2): 75-77. (in Chinese)
[31] 王慧, 刘再群, 王建辉, 洪哲, 林英杰, 罗旭阳, 孙允秀, 石磊, 王勇. 人参茎叶中挥发油中倍半萜烯化合物的分离与鉴定. 吉林大学自然科学学报, 2001(1): 88-90.
WANG H, LIU Z Q, WANG J H, HONG Z, LIN Y J, LUO X Y, SUN Y X, SHI L, WANG Y. Isolation and identification of sesquiterpenes from the volatile oil in the stems and leaves ofC. A. Mey., 2001(1): 88-90. (in Chinese)
[32] HASHEMABADI D, KAVIANI B. Chemical constituents of essential oils extracted from the leaves and stems ofTrautv. from Iran., 2011, 14(6): 693-698.
[33] 柴玲, 刘布鸣, 林霄, 白懋嘉, 赖茂祥. 假鹰爪果实挥发油化学成分研究. 香料香精化妆品, 2016(2): 13-16.
CHAI L, LIU B M, LIN X, BAI M J, LAI M X. Study on the chemical constituents of volatile oil fromLour. fruit., 2016(2): 13-16. (in Chinese)
[34] NEWMAN D J, CRAGG G M. Natural products as sources of new drugs over the 30 years from 1980 to 2010., 2012, 75: 311-335.
[35] STAHL E. The essential oil fromssp.growing in Iceland., 1984, 50(2): 157-160.
[36] MERCKE P, BENGTSSON M, BOUWMEESTER H J, POSTHUMUS M A, BRODELIUS P E. Molecular cloning, expression, and characterization of amorpha-4, 11-diene synthase, a key enzyme of artemisinin biosynthesis inL., 2000, 381(2): 173-180.
[37] VON RUDLOFF E, HUNT R S. Chemosystematic studies in the genus. Ⅲ. Leaf and twig oil analysis of amabilis fir., 1977, 55: 3087-3092.
[38] TYAGI A K, PRASAD S, YUAN W, LI S Y, AGGARWAL B B. Identification of a novel compounds (-sesquiphellandrene) from turmeric () with anticancer potential: comparison with curcumin., 2015, 33: 1175-1186.
[39] FRANCIS F, MARTIN T, LOGNAY G, HAUBRUGE E. Role of (E)--farnesene in systematic aphid prey location bylarvae (Diptera: Syrphidae)., 2005, 102: 431-436.
[40] QIAO H L, TUCCORI E, HE X L, GAZZANO A, FIELD L, ZHOU J J, PELOSI P. Discrimination of alarm pheromone (E)--famesene by aphid odorant-binding proteins., 2009, 39: 414-419.
[41] BOU D D, LAGO J H G, FIGUEIREDO C R, MATSUO A L, GUADAGNIN R C, SOARES M G, SARTORELLI P. Chemical composition and cytotoxicity evaluation of essential oil from leaves of, its main compound-zingiberene and derivatives., 2013, 18(8): 9477-9487.
[42] 周帅, 马楠, 林副平, 张汝民, 高岩. 樟树花挥发性有机化合物日动态变化分析. 浙江农林大学学报, 2011, 28(6): 986-991.
ZHOU S, MA N, LIN F P, ZHANG R M, GAO Y. Diurnal variation of volatile organic compounds emitted fromflowers., 2011, 28(6): 986-991. (in Chinese)
[43] 李其利, 郭堂勋, 黄穗萍, 黄俊斌, 莫贱友. 细菌产生的挥发性物质及其生物学功能. 微生物学杂志, 2012, 32(5): 74-82.
LI Q L, GUO T X, HUANG S P, HUANG J B, MO J Y. Volatile substances produced by bacteria and their biological functions., 2012, 32(5): 74-82. (in Chinese)
(责任编辑 岳梅)
Antimicrobial effect and components analysis of volatile organic compounds fromAR03
WANG Jing, CAO JianMin, CHEN DeXin, QIU Jun, WANG XiaoQiang, FENG Chao, WANG WenJing
(Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Qingdao 266101, Shandong)
【Objective】 The objective of this study is to determine the antimicrobial activity of volatile organic compounds (VOCs), produced from tobacco rhizosphere soilAR03 strain, and to analyze its main components.【Method】The antifungal effect of VOCs on the colony, mycelium growth and spore germination ofvar.andwas determined by a double Petri dish assay and cavity slide method. The control effect of VOCs on tobacco black shank and brown spot by leaf inoculation was determined. VOCs were collected by head-space solid phase microextraction (HS-SPME) and identified by gas chromatography-mass spectrometry (GC-MS). Retention index (RI) and internal standard (IS) 1-pentadecence were used for qualitative and quantitative analysis.【Result】VOCs released fromAR03 strain had certain inhibitory effect on the two target pathogens, which showed that the mycelium ofgrew slowly and thinned, branches increased and twisted, and broke. The mycelium ofwas deformed and no conidial pedicle was produced on the mycelium. Most of the inclusions gathered together and caused the mycelium to dry and constricted. Growth of exposed fungus colonies was inhibited by VOCs, the inhibition rates of VOCs were 56.21% and 59.23%, 64.75% and 59.86%, 66.13% and 61.10%, 67.04% and 70.00%, respectively, againstandculturedin sealed plates for 2, 4, 6 and 8 dWhen the zoospores ofandascospores ofexposed to these volatile components for 6 h, the germination was delayed and the growth was slow. The number of sporocyst produced byobviously reduced. most conidiophores ofexpanded abnormally as cystic structure, indicating the fungicidal nature of the volatiles. Moreover, VOCs could significantly inhibit the disease severities of tobacco black shank and brown spot on leaves tests. Direct fumigation for 40 h and 80 h, black shank disease incidence was 92.50% on control and 70.83% on leaves treated by VOCs, the inhibitory of spot expansion was 62.35%. Brown spot disease incidence was 88.33% on control and 60.80% on leaves treated by VOCs, lesions expanded slowly and inhibitory rate was 65.75%. SPME GC-MS analysis showed that seven components of the volatiles were identified, all of which are sesquiterpenes with C15H24structure. They are dihydrocurcumene (CAS nO. 1461-02-5), ()--famesene (CAS nO. 18794-84-8),-curcumene (CAS nO. 451-55-8),-zingiberene (CAS nO. 495-60-3),-bisabolene (CAS nO. 495-61-4),-sesquiphellandrene (CAS nO. 20307-83-9) and--bisabolene (CAS nO. 53585-13-0). When AR03 was cultured for 1 d, the relative content of-sesquiphellandrene was the highest (80.64%), followed by ()--famesene and-zingiberene, the relative content was 7.20% and 6.67%, respectively. With the extension of culturing time, the species of each component were the same, but the relative content was different. Except for dihydrocurcumene, the content of other components showed a decreasing trend, when cultured for 6 d, other ingredients decreased more than 50%, besides dihydrocurcumene keeping relatively stable. 【Conclusion】VOCs produced byAR03 could develop an additive antifungal effect against fungal pathogens on tobacco.AR03 has potential as an important microbial resource for developing antifungal metabolites and new drugs.
AR03; volatile organic compounds;var.;; SPME GC-MS
10.3864/j.issn.0578-1752.2018.10.0010
2017-11-03;
2017-12-18
中央级公益性科研院所基本科研业务费专项(1610232016012)、中国烟草总公司四川省公司重点科技项目(SCYC201604)、山东省现代农业产业技术体系烟草产业创新团队(SDAIT-2)
王静,E-mail:wangjing06@caas.cn。曹建敏,E-mail:caojianmin@caas.cn。王静和曹建敏为同等贡献作者。通信作者王静
——青蒿素

