番茄褪绿病毒实时荧光定量PCR检测技术的建立
丁天波,刘晓蓓,李洁,魏可可,褚栋
番茄褪绿病毒实时荧光定量PCR检测技术的建立
丁天波,刘晓蓓,李洁,魏可可,褚栋
(青岛农业大学植物医学学院山东省植物病虫害综合防控重点实验室,山东青岛 266109)
【目的】建立一种实时荧光定量PCR(real-time fluorescent quantitative polymerase chain reaction,RT-qPCR)检测番茄褪绿病毒(,ToCV)的方法,用于测定田间植株样品及其传毒媒介烟粉虱()中ToCV的含量。【方法】首先根据ToCV次要外壳蛋白(minor coat protein,CPm)基因的保守区域序列,运用Primer 3.0在线软件设计ToCV特异性检测引物ToCVqF和ToCVqR,并通过Primer-BLAST进行比对保证检测引物的特异性;其次分别以感染ToCV、番茄黄化曲叶病毒(, TYLCV)、番茄斑萎病毒(, TSWV)的番茄样品为模板,应用该对引物进行ToCV基因片段的克隆鉴定;将阳性克隆样品放入含有氨苄青霉素的LB液体培养基中扩大培养,并提取质粒,获得ToCV质粒标准品,将ToCV质粒标准品按10倍浓度梯度稀释,建立标准曲线;同样以按10倍浓度梯度稀释的ToCV质粒标准品为模板,同时运用RT-qPCR和反转录PCR(reverse transcription-polymerase chain reaction,RT-PCR),比较这两种方法检测ToCV的灵敏度;最后应用该方法对田间采集的8份疑似ToCV感染的番茄样品以及获毒24 h后的单头烟粉虱进行病毒检测,结合扩增曲线、熔解曲线和Ct值对待测样品中的带毒情况和带毒量进行测定。【结果】在感染ToCV的番茄样品和阳性对照中,引物ToCVqF和ToCVqR均能够特异扩增出ToCV CPm基因片段,目的片段大小为230 bp,而在感染TYLCV、TSWV的番茄样品、健康番茄样品和空白对照中,该对引物则无法扩增出特异性目的条带,说明该对引物特异性较强;构建ToCV的RT-qPCR标准曲线结果表明,随着ToCV质粒标准品模板浓度逐渐降低,Ct值出现递增趋势,并且在质粒标准品浓度2.7×103—2.7×109copies/μL范围内,ToCV标准曲线Ct值同质粒标准品浓度之间呈现良好的线性关系,扩增效率为100%,决定系数R=0.9911,直线方程为= -3.32×lg+40.06(代表循环阈值即Ct值,代表质粒初始浓度),该曲线将用于ToCV含量的测定。RT-qPCR灵敏度检测结果表明,该方法能够检测出的ToCV质粒标准品最低浓度为2.7×103copies/μL,而常规RT-PCR仅能够检测出2.7×105copies/μL的病毒样品,通过RT-qPCR法检测ToCV比常规RT-PCR法灵敏100倍。该方法能成功检测出田间植物样品携带ToCV情况,8份疑似ToCV感染的番茄样品中有6份携带ToCV,同常规RT-PCR检测结果一致,结合标准曲线计算出感染ToCV的番茄样品带毒量分别为2.48×105、2.21×105、7.97×104、3.74×107、3.37×107、2.78×106copies/μL;烟粉虱获毒24 h后,携毒率为100%,单头烟粉虱最高带毒量为2.55×104copies/μL,最低为6.46×102copies/μL。【结论】建立的RT-qPCR检测ToCV的方法特异性强、灵敏度高,可以实现植物样品和媒介昆虫携带ToCV情况和病毒含量的检测,可为ToCV的准确、有效监测和预警提供技术支持。
番茄褪绿病毒;实时荧光定量PCR;烟粉虱;检测
0 引言
【研究意义】番茄褪绿病毒(,ToCV)是一种隶属于长线形病毒科()毛形病毒属()的RNA病毒,可侵染番茄、辣椒、烟草等多种作物[1]。ToCV是一种世界性病毒,1998年美国佛罗里达州对该病毒进行了首次报道[2],此后在南美洲、非洲、欧洲、亚洲相继被发现[3-6];国内自2012年ToCV在北京地区辣椒上首次被发现后[7],相继在山东、天津、河南、江苏、内蒙古、广东等多个地区发现其危害,给番茄等蔬菜生产造成了严重的损失[8-14]。作为一种仅能依靠虫媒传播的半持久性病毒,ToCV的迅速扩散离不开其传播媒介——粉虱,而烟粉虱()作为中国番茄产区的主要粉虱种群,有调查研究发现ToCV的扩散同其具有较为密切的关系[8,15]。而目前针对植物病毒病,早期检测、监测和预警是有效防止其蔓延的重要手段之一,因此建立一种可以准确、灵敏、快速检测田间植株样品和媒介昆虫体内ToCV的检测方法,对于该病毒的有效防控具有重要意义。【前人研究进展】目前,针对ToCV的检测,早期有血清学检测方法[16],但其检测灵敏度有限,而分子生物学检测技术能较好弥补这一缺陷。ToCV的分子生物学检测技术比较常见的有反转录PCR(reverse transcription-polymerase chain reaction,RT-PCR)检测法[6,17]和逆转录环介导等温扩增(reverse transcription loop-mediated isothermal amplification,RT-LAMP)检测法[18]等。上述两种方法均能够特异检测出样品中所包含的ToCV,灵敏度相对较高,但对于低丰度病毒样品中ToCV的检测仍然略显不足,并且无法测定样品中病毒含量。而实时荧光定量PCR技术(real-time fluorescent quantitative polymerase chain reaction,RT-qPCR)因其自身高灵敏度、高特异性以及可定量等优点,成为许多现有植物病毒检测的重要技术手段之一[19-20]。针对ToCV的实时荧光定量检测,Orfanidou等[21]运用TaqMan探针法对番茄、龙葵、苦苣菜、反枝苋、藜等寄主植物感染ToCV情况及带毒量进行检测。【本研究切入点】目前有关ToCV的RT-qPCR检测技术报道相对较少,虽然已有TaqMan探针检测ToCV的方法,但其检测成本较高,而基于SYBR Green I荧光染料的RT-qPCR成本较低,因此构建一种准确性好、灵敏度高、可定量并且成本低能够满足高通量应用的RT-qPCR检测技术体系尤为必要。【拟解决的关键问题】选择ToCV基因组特定区域设计特异性强的RT-qPCR检测引物,制备ToCV质粒标准品,建立合格标准曲线,摸索成熟完整的RT-qPCR检测技术体系,实现植物样品中和传毒媒介烟粉虱体内ToCV的准确、有效检测,为ToCV的早期监测、预警提供技术支撑。
1 材料与方法
试验于2015—2016年在青岛农业大学山东省植物病虫害综合防控重点实验室完成。
1.1 供试毒源和虫源
原始感染ToCV番茄毒株系于2014年采自青岛市上马区,并通过实验室内长期饲养的Q烟粉虱(即Q型烟粉虱)进行接种,接种成功后的番茄植株置于人工气候室(温度:(27±1)℃;相对湿度:(60±5)%;光周期:16L﹕8D)内培养,作为供试毒源。
试验所用Q烟粉虱同样长期饲养在人工气候室中(条件同上)。
1.2 主要试剂
Trizol(Thermo Fisher Scientific公司)、反转录试剂盒PrimeScript RT reagent Kit(Perfect real-time)(TaKaRa公司)、rTaq酶(TaKaRa公司)、胶回收试剂盒(TaKaRa Mini BEST Agarose GEL DNA Extraction Kit,TaKaRa公司)、质粒提取试剂盒(TIANprep Mini Plasmid Kit,天根生化科技有限公司)、pMDTM18-T Vector(TaKaRa公司)、感受态细胞(Trans 5,北京全式金生物技术有限公司)。
1.3 引物设计
根据NCBI数据库中ToCV次要外壳蛋白(minor coat protein,CPm)基因(GenBank登录号:AGN91010.1)的保守序列,运用Primer 3.0在线软件(http://bioinfo.ut.ee/primer3-0.4.0/)设计ToCV的实时荧光定量PCR检测特异引物,并通过NCBI中的Primer-BLAST进行比对,保证所设计引物的特异性。上游引物ToCVqF:CTTTCTGGATGGTTTGCGGC;下游引物ToCVqR:TCCCCAACCAATGGTCGTTT。引物由英潍捷基(上海)贸易有限公司进行合成。
1.4 番茄和单头烟粉虱总RNA的提取与RT-PCR
剪取0.05 g番茄叶片置于去除RNase的研钵中,加入液氮充分研磨后,采用Trizol试剂并按照说明书步骤完成番茄叶片总RNA的提取;将单头烟粉虱置于RNase free的1.5 mL离心管中,液氮冷冻后充分研磨,加入200 μL Trizol试剂充分裂解,并按照说明书同比例减少后续所需试剂的用量,最终使用8 μL RNase free溶解单头烟粉虱的总RNA。结合琼脂糖凝胶电泳检测提取RNA样品的完整性,并运用核酸蛋白浓度测定仪检测RNA样品纯度和浓度,选取优质合格的总RNA样品(A260/A280在1.8—2.1)进行后续试验。
取质量合格的总RNA样品,按照反转录试剂盒说明书进行RT-PCR完成第一链cDNA的合成,并置于-20℃保存以备后续试验使用。
1.5 ToCV基因片段克隆与鉴定
将上述RT-PCR获得的cDNA作为模板,进行PCR扩增,总反应体系为25 μL:10×PCR Buffer(Mg2+plus) 2.5 μL、dNTP Mixture 2 μL、ToCVqF和ToCVqR各1 μL、cDNA模板1 μL、r Taq 0.25 μL、ddH2O 17.25 μL。PCR反应程序:94℃预变性3 min;94℃变性30 s,60℃退火30 s,72℃延伸30 s,35个循环;72℃后延伸10 min。
将上述PCR产物进行琼脂糖凝胶电泳后,切下目的条带,采用胶回收试剂盒进行纯化回收,连接至pMDTM18-T Vector,并转化进入感受态细胞Trans 5,37℃过夜培养后经蓝白斑筛选,挑取白色单菌落置于含有氨苄青霉素的LB液体培养基中振荡培养(37℃,220 r/min,6 h)。将菌液经特异引物ToCVqF和ToCVqR检测后,将阳性克隆送至英潍捷基(上海)贸易有限公司进行测序。
1.6 ToCV质粒标准品的制备
选择测序结果中序列完全正确的阳性克隆样品,继续放入含有氨苄青霉素的LB液体培养基中扩大培养(37℃,220 r/min,过夜)后,使用质粒提取试剂盒完成ToCV质粒的提取,使用核酸蛋白浓度测定仪测定质粒浓度后保存至-20℃。运用公式:C = A/B×6.02×1014(其中A代表质粒浓度ng·μL-1,B代表质粒DNA分子量,C代表copies/μL)计算出质粒浓度拷贝数,将其作为ToCV质粒标准品使用。
1.7 标准曲线的建立
将质粒标准品用DNase/RNase free water(购自天根生化科技有限公司)按照10倍梯度进行稀释,获得终浓度为2.7×103—2.7×109copies/μL的7个质粒样品作为模板,在实时荧光定量PCR仪(qTower 2.2 real-time PCR Thermal Cycler,Analytikjena公司)上进行RT-qPCR,每个浓度进行两次技术重复,仪器自动生成标准曲线。反应体系为20 μL:SYBR Premix Ex TaqTMII 10 μL、ToCVqF和ToCVqR各1 μL、模板1 μL、ddH2O 7 μL。
1.8 实时荧光定量PCR的灵敏度检测
将质粒标准品按照10倍梯度稀释成2.7×1010—2.7×103copies/μL的8个样品,并以此作为模板分别进行RT-qPCR和常规RT-PCR,比较这两种方法的检测灵敏度。
1.9 田间番茄样品的ToCV检测
对田间采集的8份疑似ToCV感染的番茄样品进行总RNA提取,通过RT-qPCR进行病毒检测,根据扩增曲线、熔解曲线和Ct值确定其带毒情况,并根据标准曲线计算出病毒感染样品的携毒量。
1.10 单头烟粉虱体内的ToCV毒量测定
用吸虫管吸取45头烟粉虱成虫,分成3组分别用微虫笼夹在ToCV番茄毒株的叶片上,获毒24 h后,从每个微虫笼中随机吸取8头烟粉虱,共计24头,单头分装于RNase free的1.5 mL离心管中,液氮冷冻后用于总RNA提取;同样,将20头烟粉虱置于健康番茄植株上取食24 h后,随机取6头进行总RNA提取,作为阴性对照。通过RT-qPCR方法检测单头烟粉虱体内携带ToCV的情况,并计算携毒量。
2 结果
2.1 ToCV基因片段的克隆与鉴定
将感染ToCV番茄提取总RNA后经RT-PCR合成的第一链cDNA作为模板,运用ToCVqF和ToCVqR进行常规PCR扩增,其中实验室保存ToCV样品的cDNA作为阳性对照,番茄黄化曲叶病毒(,TYLCV)样品的DNA、番茄斑萎病毒(,TSWV)样品的cDNA及健康番茄的cDNA作为阴性对照,ddH2O作为空白对照。PCR扩增产物经1%的琼脂糖凝胶电泳,结果表明(图1),感染ToCV番茄样品出现特异单一条带,位置在230 bp,同阳性对照条带大小一致,而阴性对照和空白对照则无特异条带出现。将目的条带切胶回收,经连接克隆送至英潍捷基(上海)贸易有限公司进行测序,将测序结果分析并在NCBI数据库中进行BLASTn比对,结果证实经ToCVqF和ToCVqR扩增所获序列为ToCV CPm基因片段。

M:2000 bp分子量标准2000 bp DNA Marker;1:感染ToCV的番茄样品ToCV-infected tomato sample;2:阳性对照Positive control;3:感染TYLCV的番茄样品TYLCV-infected tomato sample;4:感染TSWV的番茄样品TSWV-infected tomato sample;5:健康番茄样品Healthy tomato sample;6:空白对照Blank control
图1 常规RT-PCR扩增ToCV目的片段
Fig. 1 The amplification of ToCV fragment by RT-PCR
2.2 标准曲线的建立
以10倍梯度进行稀释的7个质粒样品作为模板,进行RT-qPCR,结果表明(图2),随着阳性质粒模板浓度逐渐降低,Ct值出现递增趋势,并且在质粒标准品浓度2.7×103—2.7×109copies/μL范围内,Ct值同质粒标准品浓度之间线性关系良好,标准曲线斜率为-3.32,决定系数R=0.9911,扩增效率为100%,直线方程为=-3.32×lg+40.06(代表循环阈值即Ct值,代表质粒初始浓度)。该标准曲线将用于ToCV含量的测定。
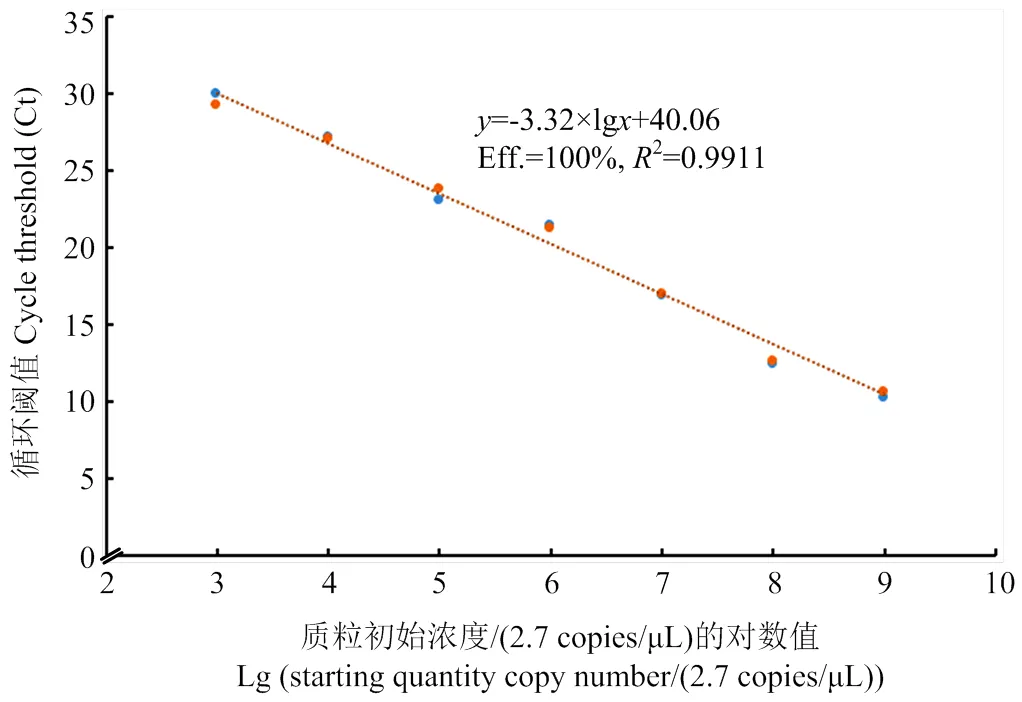
图2 ToCV的RT-qPCR标准曲线图
2.3 实时荧光定量PCR的灵敏度检测
RT-qPCR和常规RT-PCR的灵敏度检测比对结果表明,运用基于RT-qPCR的ToCV检测方法能够最低检测出2.7×103copies/μL的病毒样品(图3),而常规RT-PCR仅能够检测到2.7×105copies/μL的病毒样品(图4),表明RT-qPCR检测ToCV的灵敏度比常规RT-PCR检测提高了100倍。
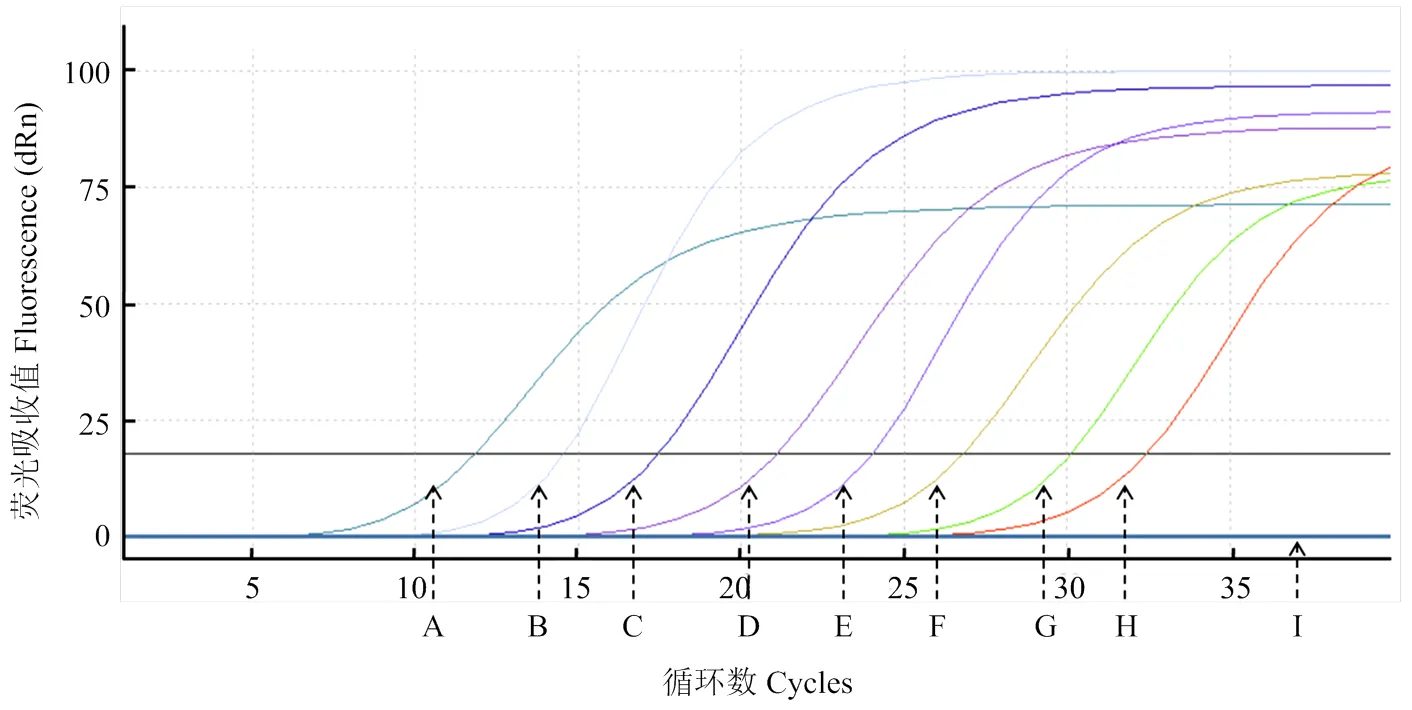
A—H:2.7×1010—2.7×103 copies/μL质粒标准品2.7×1010-2.7×103 copies/μL standard plasmid;I:空白对照Blank control
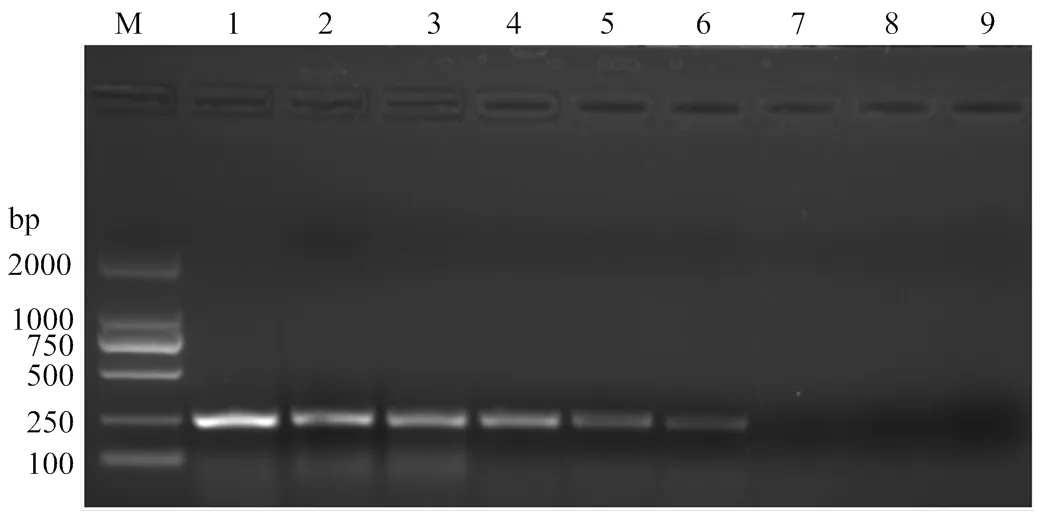
M:2000 bp分子量标准2000 bp DNA Marker;1—8:2.7×1010—2.7×103 copies/μL质粒标准品2.7×1010-2.7×103 copies/μL standard plasmid;9:空白对照 Blank control
2.4 田间番茄样品的ToCV检测
运用RT-qPCR方法对采自田间的8份疑似ToCV感染症状的番茄样品进行检测,结果表明6份田间采集样品(样品1、2、4、5、7、8)均和阳性对照(实验室保存ToCV样品)一样,扩增曲线良好(图5-I);并且此6份田间样品和阳性对照在熔解曲线中均出现单一熔解峰,位置相同(图5-II);而其余两份样品(样品3和6)同阴性对照(健康番茄样品)和空白对照(ddH2O)一样均未出现扩增(图5-I),并且熔解曲线图中无单一峰出现(图5-II)。说明这8份疑似ToCV感染的样品中有6份携带ToCV。
6份感染ToCV样品的Ct值分别为23.58、23.75、25.22、16.35、16.50和20.10,结合ToCV质粒标准品的标准曲线,计算出6份样品中ToCV的含量为2.48×105、2.21×105、7.97×104、3.74×107、3.37×107、2.78×106copies/μL。
此外对上述样品进行常规RT-PCR检测,结果发现样品1、2、4、5、7、8和阳性对照一样,均在相同位置(230 bp)出现了特异单一条带;而样品3和6同阴性对照、空白对照一样,无特异条带出现(图6)。常规RT-PCR进一步证实了RT-qPCR方法的检测结果。
2.5 单头烟粉虱体内的ToCV含量测定
运用RT-qPCR方法对获毒24 h后单头烟粉虱体内的ToCV进行定量检测,试验分3组进行,结果发现(表1),烟粉虱在感染ToCV的番茄毒株上获毒24 h后,带毒率为100%,单头烟粉虱最高携带ToCV量为2.55×104copies/μL,最低为6.46× 102copies/μL。
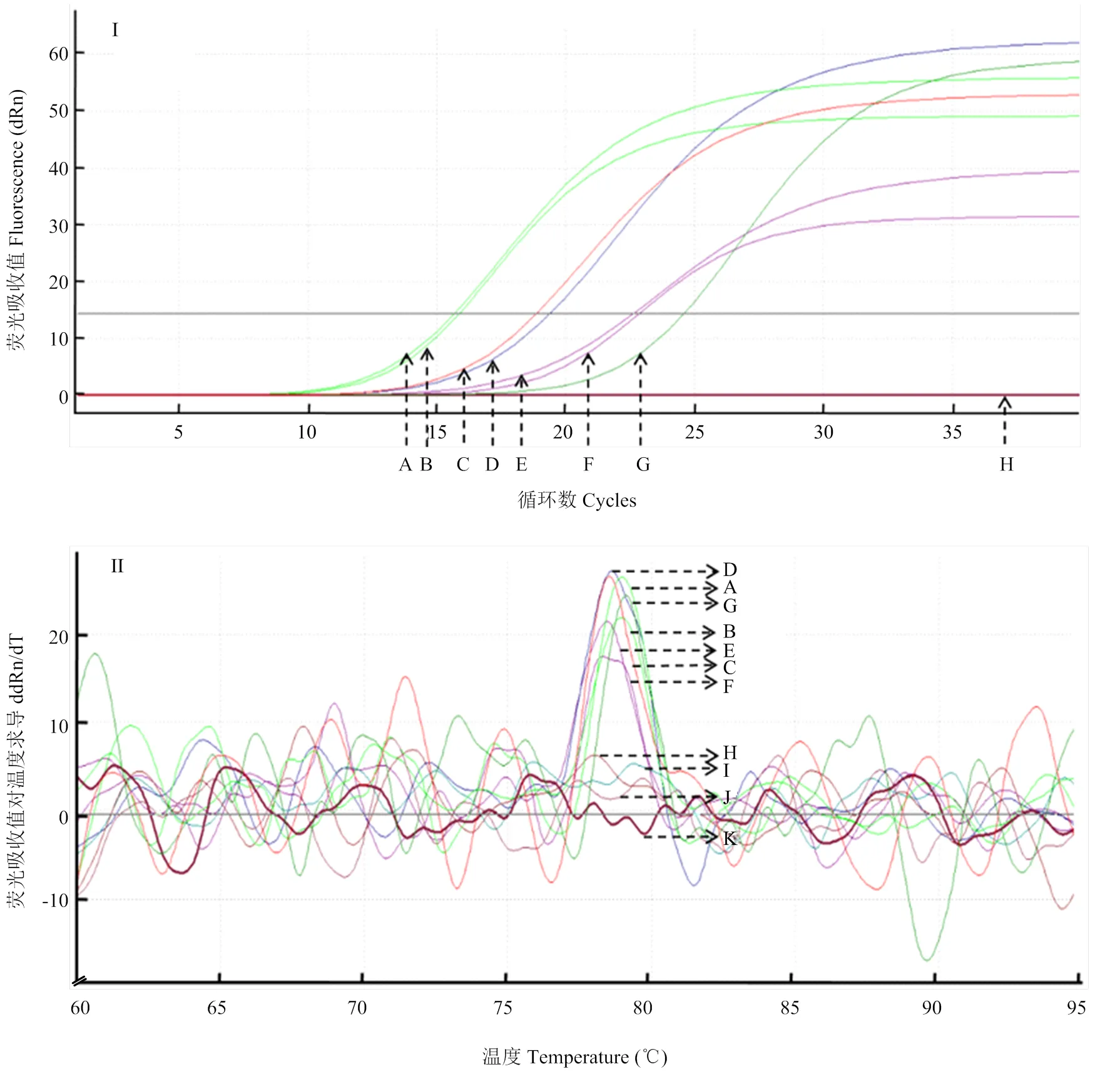
I:A、B、D、E、F、G:感染ToCV样品ToCV-infected samples;C:阳性对照Positive control;H:未感染ToCV样品、阴性对照、空白对照ToCV-uninfected samples, negative control and blank control。II:A、B、D、E、F、G:感染ToCV样品ToCV-infected samples;C:阳性对照Positive control;H—K:未感染ToCV样品、阴性对照、空白对照ToCV-uninfected samples, negative control and blank control
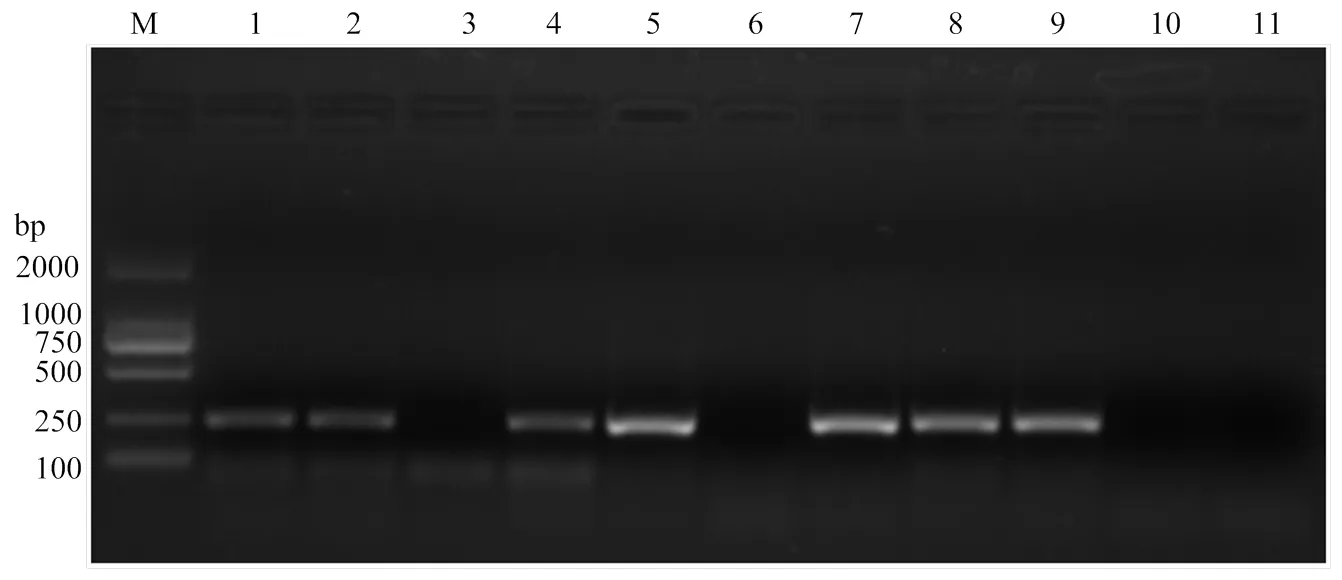
图6 田间样品的常规RT-PCR检测

表1 实时荧光定量PCR检测单头烟粉虱体内ToCV含量
Nc:阴性对照Negative control
3 讨论
ToCV是一种重要的世界性虫传病毒,近年来对于ToCV检测的相关报道也逐渐增多。目前来看,针对ToCV检测使用最为普遍的方法是RT-PCR法,其检测步骤较为繁琐,整体流程耗时较长;Kil等[18]将LAMP法进行改进,建立了一种快速、相对灵敏并有效避免携带污染的ToCV检测方法。但上述两种方法都存在检测灵敏度有限,且不能准确定量的缺点,而RT-qPCR检测方法能够很好地弥补上述缺陷,并广泛应用于多种植物病毒的检测和研究中,例如番茄黄化曲叶病毒[22]、玉米褪绿斑驳病毒(,MCMV)[23]等。故本研究基于SYBR Green I,建立一种准确、灵敏且成本较低的RT-qPCR检测ToCV的方法,能够成功运用于植株样品及媒介昆虫带毒情况及病毒含量检测。
针对ToCV检测引物的设计区域,研究者多集中于外壳蛋白(coat protein,CP)[7,24]和热激蛋白(heat shock protein,HSP)[25],本研究则选取ToCV CPm的保守区域设计出用于ToCV的RT-qPCR检测的特异引物ToCVqF/R,通过常规PCR扩增发现ToCV样品在目的大小处条带单一,并且不能扩增出其他两种番茄常见病毒片段,说明该对引物特异性较强,能够满足后续RT-qPCR验证试验;RT-qPCR结果发现该对引物扩增曲线良好,且具备特异熔解峰,结合本研究摸索的反应体系和条件,能够最大程度保证RT-qPCR过程中ToCV的有效扩增,增强反应特异性。本检测方法涉及样品病毒含量的绝对定量,因此标准品的选择尤为关键,笔者选择纯化的重组质粒DNA作为标准品,较许多体外反转录而成的cRNA标准品,具有稳定易保存,方便标准化等优点[26]。以ToCV重组质粒DNA作为标准品构建而成的标准曲线,质粒标准品中ToCV拷贝数的对数值同Ct值之间呈现良好的线性关系,且技术重复间差异性小,决定系数达0.9911;并且扩增效率为100%,完全满足样品中ToCV含量测定的需求。通过比较常规PCR和RT-qPCR检测ToCV的灵敏度,结果发现RT-qPCR方法能最低检测到2.7×103copies/μL的病毒样品,比常规RT-PCR的检测灵敏度高出100倍,因此对田间低丰度病毒样品以及微小媒介昆虫体内ToCV的准确有效检测成为现实。高利利[27]基于ToCV的HSP70基因保守区建立了ToCV SYBR Green I RT-qPCR检测方法,该方法中同样选取质粒标准品建立标准曲线,扩增效率高达99.8%,进一步暗示了重组化质粒DNA可作为标准品的较优选择;该研究选取瓜类褪绿黄化病毒(,CCYV)、黄瓜花叶病毒(,CMV)、番茄花叶病毒(,ToMV)和TSWV进行特异性试验,均无交叉反应,特异性好,而本研究仅选取TYLCV和TSWV作为阴性对照,尚需在后续验证中扩大检测范围;研究者同样应用该体系进行了大规模感病植株的有效检测,但对于单头媒介昆虫体内ToCV的检测适用性研究尚未涉及。
在本研究中,对田间采集的8份疑似携带ToCV样品进行检测,通过分析扩增曲线、熔解曲线并与阳性、阴性和空白对照进行对比,表明其中有6份样品携带ToCV,结合常规RT-PCR验证,证实了该方法对于植株病毒样品的检测适用性。烟粉虱在中国属于优势粉虱种群,多种病毒的扩散均同其具有密切关系,最为典型的属番茄黄化曲叶病毒[28];并且有调查研究发现ToCV发病株率随烟粉虱种群数量增加而升高[15]。烟粉虱作为ToCV的“收集器”和“注射器”,通过对其携毒情况的检测,对田间ToCV的早期预警以及流行趋势预测具有重要的意义。因此本研究运用该方法对单头烟粉虱体内携毒情况和带毒量进行检测,结果发现,烟粉虱获毒24 h后,带毒率达到100%,携毒量主要集中在103数量级,占据带毒烟粉虱总数的79.17%。褐色橘蚜()同样作为半持久性病毒——柑橘衰退病毒(,CTV)的有效传播媒介之一[29],李玲娣等[30]对单头褐色橘蚜获毒24 h后虫体带毒量进行研究,发现多数带毒量集中在104—105数量级,也暗示不同媒介昆虫获毒能力差异较大。Papayiannis等[31]运用TaqMan探针法对感染ToCV番茄上的烟粉虱和温室白粉虱()体内ToCV进行检测,其Ct值约为25,略低于本研究测定的烟粉虱带毒量的Ct值(26.86—32.16),此二者研究的差异可能由于粉虱来源不同,感染ToCV番茄上的烟粉虱种群获毒时间相对较长,故其带毒量稍大于烟粉虱24 h的获毒量。此外,检测方法的不同也是造成结果差异的原因之一。
4 结论
基于SYBR Green I建立的RT-qPCR检测ToCV的方法,特异性强、灵敏度高,能够满足针对植物样品和媒介昆虫中ToCV的检测和带毒量测定,且成本较低,适用于批量样品的集中、快速检测,该技术体系可用于ToCV的长期监测预警和流行趋势研究。
[1] WINTERMANTEL W M, WISLER G C. Vector specificity, host range, and genetic diversity of., 2006, 90(6): 814-819.
[2] WISLER G C, LI R H, LIU H Y, LOWRY D S, DUFFUS J E.: a new whitefly-transmitted, phloem-limited, bipartite closterovirus of tomato., 1998, 88(5): 402-409.
[3] BARBOSA J C, TEIXEIRA A P M, MOREIRA A G, CAMARGO L E A, BERGAMIN-FILHO A, KITAJIMA E W, REZENDE J A M. First report ofinfecting tomato crops in Brazil., 2008, 92(12): 1709.
[4] FIALLO-OLIVÉ E, HAMED A A, MORIONES E, NAVAS- CASTILLO J. First report ofin infecting tomato in Sudan., 2011, 95(12): 1592.
[5] LOURO D, ACCOTTO G P, VAIRA A M. Occurrence and diagnosis ofin Portugal., 2000, 106(6): 589-592.
[6] TSAI W S, SHIH S L, GREEN S K, HANSON P. First report of the occurrence ofandin Taiwan., 2004, 88(3): 311.
[7] ZHAO R, WANG R, WANG N, FAN Z F, ZHOU T, SHI Y C, CHAI M. First report ofin China., 2013, 97(8): 1123.
[8] 刘永光, 魏家鹏, 乔宁, 李美芹, 刘晓明, 竺晓平. 番茄褪绿病毒在山东暴发及其防治措施. 中国蔬菜, 2014(5): 67-69.
LIU Y G, WEI J P, QIAO N, LI M Q, LIU X M, ZHU X P. The occurrence and management ofin Shandong Province., 2014(5): 67-69. (in Chinese)
[9] 高利利, 孙国珍, 王勇, 高苇, 张春祥, 张安胜, 竺晓平. 天津地区番茄褪绿病毒的分子检测和鉴定. 华北农学报, 2015, 30(3): 211-215.
GAO L L, SUN G Z, WANG Y, GAO W, ZHANG C X, ZHANG A S, ZHU X P. Molecular detection and identification ofin Tianjin., 2015, 30(3): 211-215. (in Chinese)
[10] 胡京昂, 万秀娟, 李自娟, 黄文, 李武高, 应芳卿. 河南番茄褪绿病毒的分子鉴定. 中国蔬菜, 2015(12): 25-28.
HU J A, WAN X J, LI Z J, HUANG W, LI W G, YING F Q. Molecular identification onin Henan Province., 2015(12): 25-28. (in Chinese)
[11] 吴淑华, 李廷芳, 赵文浩, 程兆榜, 郭青云, 赵统敏, 余文贵, 朱叶芹, 季英华. 江苏省番茄黄化曲叶病毒和褪绿病毒复合侵染的分子检测. 园艺学报, 2016, 43(1): 89-99.
WU S H, LI T F, ZHAO W H, CHENG Z B, GUO Q Y, ZHAO T M, YU W G, ZHU Y Q, JI Y H. Molecular identification on mixed infection ofandon tomato in Jiangsu Province., 2016, 43(1): 89-99. (in Chinese)
[12] 郑慧新, 夏吉星, 周小毛, 张友军. 警惕烟粉虱传播的番茄褪绿病毒病在我国快速扩散. 中国蔬菜, 2016(4): 22-26.
ZHENG H X, XIA J X, ZHOU X M, ZHANG Y J. Be on alert of rapid diffusion oftransmitted by whitefly in China., 2016(4): 22-26. (in Chinese)
[13] 汤亚飞, 何自福, 佘小曼, 蓝国兵. 侵染广东番茄的番茄褪绿病毒分子鉴定. 植物保护, 2017, 43(2): 133-137.
TANG Y F, HE Z F, SHE X M, LAN G B. Molecular identification ofinfecting tomato in Guangdong Province., 2017, 43(2): 133-137. (in Chinese)
[14] 魏可可, 李洁, 丁天波, 褚栋. 番茄褪绿病毒在国内外的分布、鉴别方法及粉虱传毒特性的研究进展. 中国蔬菜, 2018(1): 19-24.
WEI K K, LI J, DING T B, CHU D. Research progress on distribution, identification method of(ToCV) and whitefly transmission characteristics., 2018(1): 19-24. (in Chinese)
[15] 代惠洁, 刘永光, 竺晓平, 刘永杰, 赵静. 山东寿光地区Q型烟粉虱对番茄褪绿病毒的传播. 植物保护学报, 2016, 43(1): 162-167.
DAI H J, LIU Y G, ZHU X P, LIU Y J, ZHAO J.(ToCV) transmitted bybiotype Q of Shouguang in Shandong Province., 2016, 43(1): 162-167. (in Chinese)
[16] JACQUEMOND M, VERDIN E, DALMON A, GUILBAUD L, GOGNALONS P. Serological and molecular detection ofandin tomato., 2009, 58(2): 210-220.
[17] KARWITHA M, FENG Z, YAO M, CHEN X J, ZHANG W N, LIU X F, TAO X R. The complete nucleotide sequence of the RNA1 of a Chinese isolate of., 2014, 162(6): 411-415.
[18] KIL E J, KIM S H, LEE Y J, KANG E H, LEE M J, CHO S H, KIM M K, LEE K Y, HEO N Y, CHOI H S, KWON S T, LEE S. Advanced loop-mediated isothermal amplification method for sensitive and specific detection ofusing a uracil DNA glycosylase to control carry-over contamination., 2015, 213: 68-74.
[19] RIZZA S, NOBILE G, TESSITORI M, CATARA A, CONTE E. Real time RT-PCR assay for quantitative detection ofin plant tissues., 2009, 58(1): 181-185.
[20] 刘科宏, 周常勇, 宋震, 周彦, 李中安, 唐科志. 运用实时荧光RT-PCR技术检测柑橘碎叶病毒. 果树学报, 2009, 26(5): 748-751.
LIU K H, ZHOU C Y, SONG Z, ZHOU Y, LI Z A, TANG K Z. Detection of(CTLV) by real-time RT-PCR., 2009, 26(5): 748-751. (in Chinese)
[21] ORFANIDOU C G, PAPPI P G, EFTHIMIOU K E, KATIS N I, MALIOGKA V I. Transmission of(ToCV) bybiotype Q and evaluation of four weed species as viral sources., 2016, 100(10): 2043-2049.
[22] 林铭, 胡鸿, 杜永臣, 高建昌, 王孝宣, 国艳梅. 番茄黄化曲叶病毒的实时荧光定量PCR检测. 中国蔬菜, 2013(2): 20-26.
LIN M, HU H, DU Y C, GAO J C, WANG X X, GUO Y M. Real-time PCR for quantification ofin tomato plants., 2013(2): 20-26. (in Chinese)
[23] 闻伟刚, 张建成, 崔俊霞, 张颖. 玉米褪绿斑驳病毒实时荧光RT-PCR检测方法研究. 植物检疫, 2011, 25(1): 39-42.
WEN W G, ZHANG J C, CUI J X, ZHANG Y. Detection ofby real-time fluorescent RT-PCT., 2011, 25(1): 39-42. (in Chinese)
[24] PANNO S, DAVINO S, RUBIO L, RANGEL E, DAVINO M, GARCÍA-HERNÁNDEZ J, OLMOS A. Simultaneous detection of the seven main tomato-infecting RNA viruses by two multiplex reverse transcription polymerase chain reactions., 2012, 186(1/2): 152-156.
[25] HIROTA T, NATSUAKI T, MURAI T, NISHIGAWA H, NIIBORI K, GOTO K, HARTONO S, SUASTIKA G, OKUDA S. Yellowing disease of tomato caused bynewly recognized in Japan., 2010, 76(2): 168-171.
[26] 胡加谊, 罗志文, 范鸿雁, 李向宏, 刘志昕, 何凡. 菠萝凋萎相关病毒-2实时荧光定量RT-PCR检测方法的建立. 园艺学报, 2014, 41(6): 1257-1266.
HU J Y, LUO Z W, FAN H Y, LI X H, LIU Z X, HE F. Development of a real-time fluorescent quantitative RT-PCR method for the detection of., 2014, 41(6): 1257-1266. (in Chinese)
[27] 高利利. 番茄褪绿病毒的分子鉴定及荧光定量PCR检测体系的建立与应用[D]. 泰安: 山东农业大学, 2016.
GAO L L. Molecular identification ofand development and application of real-time PCR assay[D]. Taian: Shandong Agricultural University, 2016. (in Chinese)
[28] 李廷刚, 李长松. 番茄黄化曲叶病毒研究进展. 中国农学通报, 2011, 27(2): 90-94.
LI T G, LI C S. Advances in research of., 2011, 27(2): 90-94. (in Chinese)
[29] Rocha-Pena M A, Lee R F, Lastra R, Niblett C L, Ochoa-Corona F M, Garnsey S M, Yokomi R K.and its aphid vector: threats to citrus production in the carribean and central and North America., 1995, 79(5): 437-445.
[30] 李玲娣, 周常勇, 李中安, 田晓, 王永江, 唐科志, 周彦, 刘金香. 褐色橘蚜中柑橘衰退病毒实时荧光定量RT-PCR检测方法的建立与应用. 中国农业科学, 2013, 46(3): 525-533.
LI L D, ZHOU C Y, LI Z A, TIAN X, WANG Y J, TANG K Z, ZHOU Y, LIU J X. Development and application of a real-time RT-PCR approach for quantification of CTV in., 2013, 46(3): 525-533. (in Chinese)
[31] PAPAYIANNIS L C, HARKOU I S, MARKOU Y M, DEMETRIOU C N, KATIS N I. Rapid discrimination of,and co-amplification of plant internal control using real-time RT-PCR., 2011, 176(1/2): 53-59.
(责任编辑 岳梅)
Development of a Real-time Fluorescent Quantitative PCR Method for the Detection ofand its application
DING TianBo, LIU XiaoBei, LI Jie, WEI KeKe, CHU Dong
(Key Laboratory of Integrated Crop Pest Management of Shandong Province, College of Plant Health and Medicine, Qingdao Agricultural University, Qingdao 266109, Shandong)
【Objective】The objective of this study is to develop a real-time fluorescent quantitative PCR (RT-qPCR) method to detect the(ToCV) and its concentration in plant and the vector.【Method】Firstly, the special primers ToCVqF/R were designed using Primer 3.0 for RT-qPCR based on the highly conserved region of the minor coat protein (CPm). The primers specificity was evaluated by Primer-BLAST. Secondly, the fragment was amplified using the primers ToCVqF/R by PCR within the ToCV-infected,(TYLCV)-infected, and(TSWV)-infected tomato samples, and cloned into pMDTM18-T Vector. The positive clone was selected and multiplied in LB liquid medium containing ampicillin. Furthermore, the recombinant plasmid was extracted from the clone and served as the ToCV standard. Then, the standard curve was generated for quantitative analysis using the ten-fold dilution of the recombinant plasmid. In addition, the detection sensitivity of RT-qPCR was also evaluated and compared to that of reverse transcription-polymerase chain reaction (RT-PCR). Finally, this method was used to detect and quantify ToCV in eight tomato samples with suspected ToCV infection and singleafter acquiring ToCV for 24 h, according to the amplification curves, melting curves and Ct values.【Result】The purpose strips could be successfully amplified with the primers ToCVqF/R only in the ToCV-infected tomato sample and positive control, which indicated that the primers was highly specific. Additionally, the sequencing result of the fragment was in according with the target gene CPm. The ToCV standard curve showed that the Ct values gradually increased as the concentration of recombinant plasmid decreased. Among the concentration range of 2.7×103-2.7×109copies/μL, the standard curve showed a good linear relationship between Ct values and plasmid concentration. The correlation coefficient of the standard curve was 0.9911, and the amplification efficiency was 100%. The Straight-line equation is=-3.32×lg+40.06 (andrepresent the Ct value and plasmid concentration, respectively). The sensitivity of RT-qPCR was 100 times higher than regular RT-PCR. The minimum detectable concentration of ToCV plasmid standard in RT-qPCR assay is 2.7×103copies/μL, while that in RT-PCR assay is 2.7×105copies/μL. This method could successfully detect the ToCV within tomato samples, and the result was consistent with RT-PCR assay. Six of eight tomato samples were infected by ToCV, the viral titers of which were 2.48×105, 2.21×105, 7.97×104, 3.74×107, 3.37×107and 2.78×106copies/μL, respectively. After 24 h feeding on ToCV infected tomato plants, 100% of theacquired this virus successfully, and the virus concentration in single whitefly ranged from 6.46×102to 2.55×104copies/μL.【Conclusion】The RT-qPCR method is applicable for accurate and sensitive detection of ToCV both in plants and vector insects, which will provide a technical support for the monitoring and early warning of this virus.
(ToCV); real-time fluorescent quantitative PCR (RT-qPCR);; detection
10.3864/j.issn.0578-1752.2018.10.020
2017-11-29;
2018-01-25
国家自然科学基金青年科学基金(31501707)、泰山学者建设工程专项经费、山东省农业科学院农业科技创新工程(CXGC2016B11)、 青岛农业大学高层次人才科研基金(6631115033)
丁天波,E-mail:tianboding@126.com。通信作者褚栋,Tel:0532-88030319;E-mail:chinachudong@sina.com

