PLAGL2与结肠癌侵袭能力的相关性研究
丁秀杰 王永鹏 马思平 张睿 王燕 张庆彤 张昊 李鹏雷 林涛 李岩溪 陈玉泽 刘放
结直肠癌(colorectal cancer,CRC)是世界范围内最常见的恶性肿瘤之一,目前其死亡率在所有恶性肿瘤中已经上升到第2位[1]。2015年美国全年新发结直肠癌病例约132 700例,同年死亡病例约49 700例[2]。结直肠癌的发展过程中,约有50%的患者最终出现肝转移,20~30%患者出现肺转移,浸润和转移是结直肠癌患者致死的主要因素[3]。结直肠癌发生与发展是一个多基因参与、多因素相互作用、经过多个阶段最终形成的、极其复杂的生物学现象[4-5]。上皮——间质转化(epithelialmesenchymal transition,EMT)目前被认为是肿瘤侵袭的主要机制而被广泛研究。它是一种潜在的类似胚胎发育的过程,包括上皮标志丢失,同时伴随着许多间质性标志表达增加,如神经钙粘附素、波形蛋白等。其在肿瘤进展过程中可以异常再激活,为细胞提供侵袭性和运动性的能力,通常被视为转移传播的一个主要的驱动力[6]。良好的肿瘤标志物监测肿瘤细胞播散转移对我们了解病人病理事件的发生顺序显得尤为重要。
多形性腺瘤基因样因子2(pleomorphic adenoma gene-like 2,PLAGL2)是一类来源于PLAG基因家族的锌指蛋白,其分子结构式的N端含7个C2H2锌指蛋白结构域。目前已证实,人和鼠PLAGL2基因的DNA序列有92%同源性,人类PLAGL2基因在胎儿期表达丰富,小鼠肺,脾和睾丸组织中的表达水平最高[7]。临床上PLAGL2与恶性肿瘤的关系首先在急性髓性白血病和肺癌中被人研究,从其与肺良性疾病的研究中延伸而来,逐渐引起人的重视。本文拟从组织学水平以及细胞实验探讨PLAGL2蛋白表达与结肠癌发生发展及侵袭的关系及机制。
资料与方法
一、研究对象
选取2015年10月15日至2015年12月10日期间辽宁省肿瘤医院结直肠外科收治的结肠癌患者40例,纳入研究对象如下:(1)初诊为结肠癌患者,未经过术前放化疗或者其他生物免疫治疗;(2)无合并其他恶性肿瘤;(3)入组患者年龄:51~87岁;(4)根据医学伦理学原则,研究前应对研究对象进行告知,确保所有研究对象充分了解相关信息,并签署知情同意书。
二、免疫组化
从福尔马林固定的组织中切取4~6 μm厚切片,进行石蜡包埋,然后在二甲苯和一系列浓度的乙醇中进行脱蜡。组织切片在0.3%过氧化氢溶液内孵育12 min,以阻止内源性过氧化物酶活性。切片在蒸汽压力锅里煮沸的柠檬酸缓冲液(pH值6)中孵育以提取抗原。然后样本与山羊血清在室温孵育30 min。阻断特异性抗体后,样本与抗PLAGL2多克隆抗体(Abcam公司,美国)在1:200稀释浓度下在4 ℃培养过夜。然后滴加适量生物素标记的二抗,37 ℃孵育20 min。PBS冲洗3 次,每次5 min。最后滴加适量的HRP标记链霉亲和素,37 ℃孵育30 min。PBS 冲洗3次,每次5 min。显色剂显色10 min。自来水冲洗,苏木素复染色,脱水,透明,封片。观察PLAGL2蛋白的表达情况。
三、细胞实验
(一)pcDNA3.1-PLAGL2质粒构建
(1)基因扩增:建立PCR反应体系,进行目的基因片段PCR扩增,电泳检测扩增情况。利用多功能DNA纯化回收试剂盒提取纯化的目的基因片段;(2)TA克隆:将得到的目的基因与pUM-T simple vector连接,经过系列反应以后,形成单菌落。挑选白色菌落,PCR鉴定插入片段长度,选取阳性克隆,标记为T-PLAGL2,测序;(3)质粒提取:利用质粒大量制备试剂盒提取目的质粒(T-PLAGL2,pcDNA3.1);(4)基因重组:根据实验设计的酶切位点对T-PLAGL2,pcDNA3.1质粒进行双酶切,回收酶切片段,将得到的目的基因与pcDNA3.1连接。挑选菌落,PCR鉴定插入片段长度,选取阳性克隆,标记为pcDNA3.1-PLAGL2,测序。
(二)细胞培养、转染及筛选
SW480细胞贴壁生长于含10%胎牛血清、青霉素100 u/mL、链霉素100 ug/mL的IMDM培养液中,在37 ℃、5%CO2及饱和湿度的恒温密闭培养箱内传代培养,培养SW480细胞至密度为90%左右,在6孔板中利用转染试剂脂质体2000进行转染PLAGL2质粒及空载体Vector质粒。转染24 h后,6孔板内每孔加入含有200 μg/mL G418的DMEM完全培养基进行筛选。筛选后的细胞株经传代后,与未转染的SW480细胞分三组:SW480、Vector和 PLAGL2,应用 Western-blot方法在蛋白水平进行检测,检验转染效率及稳定性。
(三)Transwell细胞侵袭实验
首先将Matrigel胶包被到小室膜上,建立Transwell小室模型。将SW480、Vector、PLAGL2各组细胞培养至密度为90%左右,胰酶消化后制成细胞悬浮溶液放入上室,下室放入含20%FBS培养液。培养24小时固定染色,显微镜下观察、计数。
(四)Western-blot
分SW480、Vector和PLAGL2三组细胞进行实验,每组至少5个单独样本检测。先对检验的样本进行总蛋白抽提,蛋白质定量。然后按实验分组进行聚丙烯酰胺凝胶电泳(SDS-PAGE),转印至PVDF膜,然后封闭。选择相关目的基因抗体孵育一抗,用羊抗兔IgG-HRP进行二抗孵育,待ECL底物发光,图像保存。内参用β-actin,实验步骤一致。条带的光密度通过Gel-Pro分析仪(Media Cybernetics公司,美国)进行数据分析,以目的蛋白与β-actin光密度的比值进行统计学比较。
四、统计学分析
本文所有数据资料均使用SPSS for Windows 20.0软件处理。结果以均数±标准差(SD)表示,计量资料采用两样本t检验或单因素方差分析(One-Way ANOVA)比较组间均数,计数资料采用χ2检验、χ2连续校正或者Fisher确切概率法进行分类资料分析,以双侧检验P<0. 05为差异有统计学意义。
结 果
一、PLAGL2在结肠癌组织中的表达情况
免疫组化染色结果需要两位病理科医生通过半定量方法进行评估。细胞阳性染色强度评分:分为无色0,淡黄色1、棕黄色2和暗褐色3;每高倍视野计数100个细胞,判断阳性细胞比例:分为无阳性细胞0,阳性细胞<15%为1,15~50%为2,51~75%为3,>75%为4。细胞阳性染色强度与阳性细胞比例乘积为免疫反应评分(immunoreactivity score,IS):0为阴性、1~4为弱阳性、5~8为中阳性,9~12为强阳性,阴性和弱阳性定义为低表达,反之则为高表达(图1)。
40例免疫组化标本中,14例为Ⅰ~Ⅱ期结肠癌组织,26例为Ⅲ~Ⅳ期,同时配对40例癌旁组织。比较免疫反应评分(IS值),PLAGL2蛋白在Ⅲ~Ⅳ期结肠癌组织中表达明显高于Ⅰ~Ⅱ期结肠癌组织,更高于癌旁组织,分别为8.120±2.997、5.710±2.494、2.170±0.984。三组之间比较以及两两比较差异均有统计学意义(表1)。
二、PLAGL2的表达与临床病理因素的关系
按照IS评分,阴性和弱阳性(0~4分)为低表达,中阳性和强阳性(5~12分)为高表达,将40例病例按照PLAGL2的表达水平分为高低两组,进行对照分析。卡方检验结果提示PLAGL2表达增高的患者临床分期较晚(χ2=5.700,P=0.017)、肿瘤较大(χ2=8.174,P=0.008)以及更易发生远隔脏器转移(χ2=13.610,P<0.001)(表2)。
三、pcDNA3.1-PLAGL2质粒的成功构建
对构建好的pcDNA3.1- PLAGL2质粒进行电泳及鉴定测序,泳道1(M)为D2000 marker,泳道2(质粒)为重组质粒pcDNA3.1-PLAGL2,泳道3(单酶切)为用BamHI对质粒pcDNA3.1-PLAGL2进行单酶切,泳道4(双酶切)为用BamHI/EcoRI对质粒pcDNA3.1-PLAGL2进行双酶切(图2)。PLAGL2目的基因片段大小约为1 900 bp,测序结果与Genebank上公布的序列基本吻合。
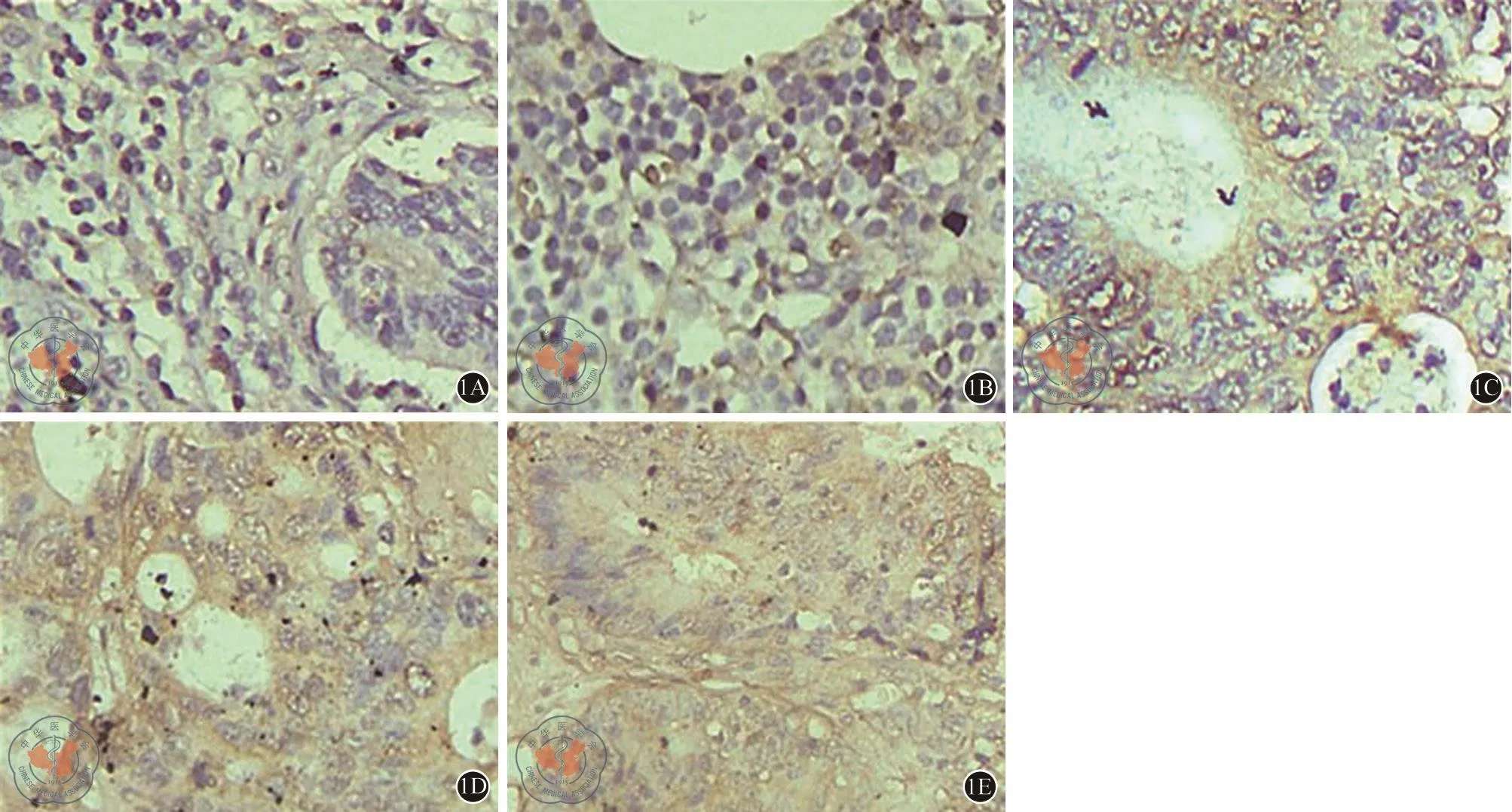
图1 PLAGL2在不同分期结肠癌和癌旁组织中的表达情况(400×):1A图为癌旁组织、1B~E图为Ⅰ~Ⅳ期结肠癌组织,PLAGL2表达依次升高且表达位置主要在细胞浆中

表1 结肠癌组织和癌旁组织中IS值的比较
四、PLAGL2高表达稳转SW480细胞系的建立
质粒pcDNA3.1-PLAGL2转染至SW480结肠癌细胞株,经过稳定生长、传代、冻存、复苏之后,通过Western-blot检测PLAGL2的表达情况,结果显示PLAGL2组细胞株PLAGL2蛋白表达明显高于SW480组和Vector组,证明转染成功(图3)。同样分SW480、Vector、PLAGL2三组进行细胞培养并观察,细胞为单层贴壁生长,同样呈上皮细胞形态,三组细胞形态无显著变化,观察7日内的细胞增殖变化,PLAGL2组比SW480、Vector两组略高,但差异尚无统计学意义(P>0.05)(图4)。

表2 PLAGL2与临床病理因素的相关性
五、Transwell侵袭实验结果
用倒置显微镜观察侵袭的细胞,并分组计算细胞个数的平均值,SW480、Vector和PLAGL2三组分别为84.60、81.00和122.60,经两两比较,PLAGL2组与另两组差异有显著统计学意义(F=27.997,P<0.01)(图5)。

图2 酶切片段电泳结果(泳道1为D2000 marker;泳道2为重组质粒pcDNA3.1-ILE1;泳道3为用BamHI对质粒pcDNA3.1-ILE1进行单酶切;泳道4为用BamHI/EcoRI对质粒pcDNA3.1-ILE1进行双酶切)
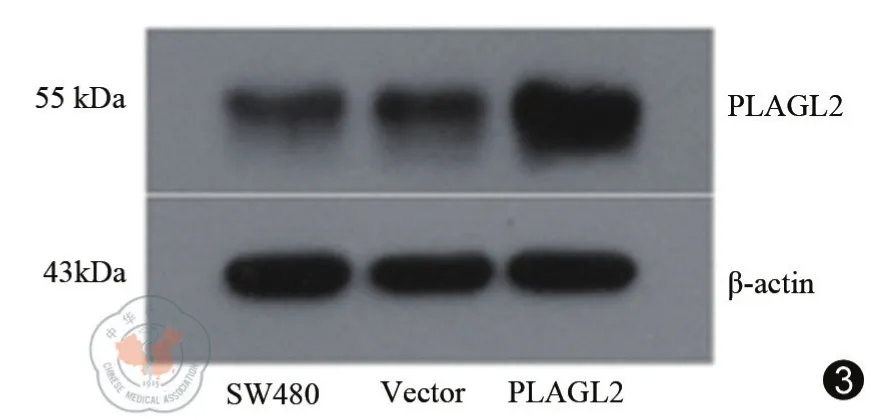
图3 稳转后SW480细胞行Western-blot结果

图4 细胞增殖曲线

图5 Transwell法观察三组细胞的侵袭能力:上图为迁移至微孔膜下层的细胞情况,由左到右依次为SW480、Vector和PLAGL2(200×);下图为穿透细胞个数比较(**P<0.01)
六、EMT标志物的表达情况
应用Western-blot对SW480、Vector和PLAGL2三组细胞进行5次独立样本实验,计算目的蛋白E-cadherin、vimentin和MMP-7与β-actin的灰度比值(均数±标准差)进行统计学分析,E-cadherin表达显著下降(F=38.461,P<0.01)而vimentin(F=28.741,P<0.01)和MMP-7(F=24.520,P<0.01)均有升高,表达差异有显著统计学意义(图6)。
讨 论
PLAGL2是多形性腺瘤基因锌指蛋白家族成员之一,其他成员包括PLAGl和PLAGLl。PLAG蛋白家族作为细胞核转录调控因子,在多种基因表达中起到重要调控作用,比如细胞的生理性增殖以及病理性的肿瘤发生。Zheng H等[8]通过在神经干细胞(neural stem cell,NSC)和神经胶质瘤启动细胞(GIC)细胞株中增强PLAGL2表达,发现PLAGL2基因能够强烈抑制细胞分化,增强其自我更新的能力,并赋予恶性肿瘤细胞某些干细胞的特性,具体机制可能与通过调节Wnt信号通路而阻碍细胞分化有关。PLAGL2蛋白与结直肠癌相关的研究文献不多,Liu等[9]通过对225例临床结直肠癌标本以及66例癌旁组织进行检测,同时回顾性分析225例患者的临床病理学特征,发现结直肠中PLAGL2的表达水平明显高于癌旁正常组织,且与肿瘤浸润深度密切相关。除此之外,还有很多研究已经阐明PLAGL2是作为一个转录因子,其过表达可能会促进肿瘤的进展[10-12]。在我们的研究中,我们首先通过40例患者的病例资料及组织学标本进行检测。免疫组化结果证明随着结肠癌临床分期增加,PLAGL2 的表达显著增加,晚期癌患者的上调尤为明显。分析PLAGL2的表达与临床病理因素之间的关系,与肿瘤分期、肿瘤大小以及有无转移密切相关,而与组织学类型并无关系。以上结果,从病理学检测以及临床病理因素的回顾性分析两个层面说明PLAGL2在结肠癌的细胞增殖、侵袭及转移等方面起到重要作用,但与结肠癌细胞本身生物学恶性程度关系不大。PLAGL2很可能会成为新的判断结肠癌分期及预后的标记物,同时也进一步确认和验证了之前文献对PLAGL2的研究结果[9]。
接着我们的研究从组织水平进入到细胞实验,经过稳转高表达PLAGL2的SW480细胞株成功建立并稳定传代,为后续实验提供了技术支持。Transwell侵袭实验非常直观的说明PLAGL2表达上调的结肠癌细胞的迁移和侵袭能力明显增强,这很可能与诱发EMT机制相关。近年来,EMT机制广泛应用于肿瘤学的研究,而越来越被人所重视。2002年法国肿瘤学家Thiery[13]提出肿瘤发展是一个复杂的、多基因参与的多阶段过程,其中上皮间质转化是个非常重要的步骤。Tiwari N等[14]通过研究表明,从良性腺瘤到恶性癌、以及癌的侵袭和转移的过渡过程中,上皮性肿瘤细胞获得去分化,迁移行为和侵袭的特征与EMT相关。而且EMT过程伴随着细胞形态的巨大变化,同时伴随细胞与细胞之间、细胞与基质之间连接物质的丢失和重塑,使得肿瘤细胞获得迁移和侵袭的能力。Gu G等[15]通过对散发性结直肠癌和Lynch综合症的侵袭转移能力进行对比分析,发现Lynch综合症侵袭能力弱于散发性结直肠癌,主要就是跟EMT机制强弱相关,其中EMT机制的发生包括上皮标志丢失,如黏附蛋白E-cadherin、β-catenin以及细胞角蛋白的丢失,同时伴随着许多间质性标志表达增加,如N-cadherin、Vimentin以及MMP家族蛋白等。

图6 Western-blot检测三组细胞株的E-cadherin、vimentin和MMP-7的表达情况及光密度比值的对比分析(**P<0.01)
由于经费有限,我们只选择了与EMT相关的三个分子E-cadherin、Vimentin以及MMP-7从上皮细胞、间质、细胞外基质三方面进行研究。E-cadherin对细胞与细胞及细胞与基质之间的粘附及组织结构的维持起到重要作用。多种恶性肿瘤的分化程度降低、侵袭转移能力增强以及预后不良和E-cadherin的表达缺失密切相关[16-19]。Vimentin是细胞支架的重要成分,能够固定细胞器的位置,保持细胞的完整性[20]。在结直肠癌中vimentin常以甲基化形式存在,并且已被证实是结肠癌的生物标志物,同时也是EMT的标志物之一[21]。MMP-7是MMP家族中结构最小的成员,除了与MMP家族成员一样能降解细胞外基质,还可以调节细胞凋亡、促进细胞生长、浸润和转移[22]。正常机体极少表达MMP-7,而主要在病理或生理过程中表达,如炎症愈合、胚胎发育等等[23]。Sun等[24]通过对17个研究的2 985例结直肠癌患者进行荟萃分析,总结了MMP-7表达增高提示不良的总生存期和无病生存期,同时降低5年生存率。因此,MMP-7是结直肠癌患者预后不良和高复反风险的重要指标。我们的研究结果证实,PLAGL2高表达的SW480细胞株侵袭能力增强,EMT相关的上皮标志物E-cadherin表达显著下降,间质标志物Vimentin以及细胞外基质标志物MMP-7表达明显升高,尤其在MMP-7的表达中可以看到,SW480和Vector两组表达很低,说明PLAGL2能够促进MMP-7分子的转录并发挥生物学作用促进EMT形成。
综上所述,本研究揭示了PLAGL2的表达上调与结肠癌的发生、发展密切相关,并且能够提高结肠癌细胞的侵袭能力,故认为PLAGL2是结肠癌细胞EMT形成的重要调节因子,其表达上调以后影响EMT相关分子的表达。但目前确切的作用机制、所涉及的信号传导通路等问题将在我们的课题中进一步研究。
[1]Siegel R, Desantis C, Jemal A. Colorectal cancer statistics [J]. CA Cancer J Clin, 2014, 64(2): 104-117.
[2]El-Shami K, Oeffinger KC, Erb NL, et al. American Cancer Society Colorectal Cancer Survivorship Care Guidelines [J]. CA Cancer J Clin, 2015, 65(6): 428-455.
[3]Viganò L, Capussotti L, Lapointe R, et al. Early recurrence after liver resection for colorectal metastases: risk factors, prognosis, and treatment. A LiverMetSurvey-based study of 6, 025 patients [J]. Ann Surg Oncol, 2014, 21(4): 1276-1286.
[4]Cawkwell L, Lewis FA, Quirke P. Frequency of allele loss of DCC,p53, RBI, WT1, NF1, NM23 and APC/MCC in colorectal cancer assayed by fluorescent multiplex polymerase chain reaction [J]. Br J Cancer, 1994, 70(5): 813-818.
[5]Ioana M, Angelescu C, Burada F, et al. MMR gene expression pattern in sporadic colorectal cancer [J]. J Gastrointestin Liver Dis,2010, 19(2): 155-159.
[6]Matsuzaki S, Darcha C, Pouly JL, et al. Effects of matrix stiffness on epithelial to mesenchymal transition-like processes of endometrial epithelial cells: Implications for the pathogenesis of endometriosis [J].Sci Rep, 2017, 7:44616.
[7]Furukawa T, Adachi Y, Fujisawa J, et al. Involvement of PLAGL2 in activation of iron deficient- and hypoxia-induced gene expression in mouse cell lines [J]. Oncogene, 2001, 20(34): 4718-4727.
[8]Zheng H, Ying H, Wiedemeyer R, et al. PLAGL2 regulates Wnt signaling to impede differentiation in neural stem cells and gliomas [J].Cancer Cell, 2010, 17(5): 497-509.
[9]Liu B, Lu C, Song YX, et al. The role of pleomorphic adenoma gene-like 2 in gastrointestinal cancer development, progression, and prognosis [J]. Int J Clin Exp Pathol, 2014, 7(6): 3089-3100.
[10]Van Dyck F, Delvaux EL, Van de Ven WJ, et al. Repression of the transactivating capacity of the oncoprotein PLAG1 by SUMOylation [J].J Biol Chem, 2004, 279(34): 36121-36131.
[11]Lanzara C, Ficarella R, Totaro A, et al. Congenital dyserythropoietic anemia type II: Exclusion of seven candidate genes [J]. Blood Cells Mol Dis, 2003, 30(1): 22-29.
[12]Kas K, Voz ML, Röijer E, et al. Promoter swapping between the genes for a novel zinc finger protein and beta-catenin in pleiomorphic adenomas with t(3;8)(p21;q12) translocations [J]. Nat Genet, 1997, 15(4): 170-174.
[13]Thiery JP. Epithelial-mesenchymal transitions in tumour progression [J].Nat Rev Cancer, 2002, 2(6): 442-454.
[14]Tiwari N, Gheldof A, Tatari M, et al. EMT as the ultimate survival mechanism of cancer cells [J]. Seminars in Cancer Biology, 2012,22(3): 194-207.
[15]Gu GL, Zhu XQ, Wei XM, et al. Epithelial-mesenchymal transition in colorectal cancer tissue of patients with Lynch syndrome [J].World J Gastroenterol, 2014, 20(1): 250-257.
[16]Khare V, Lang M, Dammann K, et al. Modulation of N-glycosylation by mesalamine facilitates membranous E-cadherin expression in colon epithelial cells [J]. Biochem Pharmacol, 2014, 87(2): 312-320.[17]Roylance R, Droufakou S, Gorman P, et al. The role of E-cadherin in low-grade ductal breast tumourigenesis [J]. J Pathol, 2003, 200(1):53-58.
[18]Lv H, Liu R, Fu J, et al. Epithelial cell-derived periostin functions as a tumor suppressor in gastric cancer through stabilizing p53 and E-cadherin proteins via the Rb/E2F1/p14ARF/Mdm2 signaling pathway [J]. Cell Cycle, 2014, 13(18): 2962-2974.
[19]Kim CH, Park SY, Yoo J. Expression of Transforming Growth Factor β1 and E-Cadherin Proteins in Pulmonary Adenocarcinoma:Its Significance in Tumor Progression [J]. Cancer Res Treat, 2013,45(2): 118-125.
[20]Calangiu CM, Simionescu CE, Stepan AE, et al. The expression of CK19, vimentin and E-cadherin in differentiated thyroid carcinomas [J].Rom J Morphol Embryol, 2014, 55(3): 919-925.
[21]Shirahata A, Sakata M, Sakuraba K, et al. Vimentin methylation as a marker for advanced colorectal carcinoma [J]. Anticancer Res, 2009,29(1): 279-281.
[22]Miyake T, Yasukawa K, Inouye K. Analysis of the mechanism of inhibition of human matrix metalloproteinase 7 (MMP-7) activity by green tea catechins [J]. Biosci Biotechnol Biochem, 2011, 75(8):1564-1569.
[23]Letra A, Ghaneh G, Zhao M, et al. MMP-7 and TIMP-1, new targets in predicting poor wound healing in apical periodontitis [J]. J Endod,2013, 39(9): 1141-1146.
[24]Sun DW, Zhang YY, Qi Y, et al. Prognostic significance of MMP-7 expression in colorectal cancer: A meta-analysis [J]. Cancer Epidemiol, 2015, 39(2): 135-142.
——一道江苏高考题的奥秘解读和拓展

