胃癌组织中Notch1、Notch2、COX-2的表达及其与临床病理学参数的关系
刘 敏,任 茜,李 强,叶玉伟,陈兆峰
1.兰州大学第一医院消化内科,甘肃 兰州730000;2.甘肃省胃肠病重点实验室
在中国,胃癌是最常见的消化道恶性肿瘤,每年新增36~40万胃癌患者,死亡率占我国肿瘤死因的第二位,而甘肃省为胃癌高发区,死亡率位居全国首位[1]。环氧合酶-2(COX-2)是一种诱导型表达蛋白,催化花生四烯酸生成前列腺素,参与炎症、肿瘤血管形成及肿瘤侵袭、转移等多种病理生理过程。
1 材料与方法
1.1材料收集2010年4月至2012年6月于甘肃省武威市肿瘤医院接受胃癌根治手术的65例患者的手术切除标本,男40例,年龄(25~75)岁(中位年龄54岁),女25例,年龄(28~76)岁(中位年龄55岁)。纳入及排除标准:纳入本研究患者均为武威地区常驻人口,术前均未接受过放、化疗,无严重心、肺功能衰竭等疾病,既往无胃手术史。分别采集胃癌及其其癌旁组织,于-80 ℃长期保存。所有患者收集完整的临床及病理资料,包括姓名、性别、年龄、病变部位、组织学类型、分化程度、浸润深度、TNM分期及有无远处转移等。
1.2试剂Total RNAiso Plus、SYBP®Premix Ex TaqTM Ⅱ、PrimeScript®RT Master Mix Perfect Real Time、引物合成均来自TaKaRa公司。BCA蛋白定量试剂盒购自Bioworld公司、RIPA蛋白裂解液(强)与PMSF购自碧云天生物公司,Super ECL Plus超敏发光液购自北京普利莱公司。Anti-Notch1 intracell μLar domain antibody、Anti-Notch2 intracell μLar domain antibody 、Anti-COX-2 antibody均购自Abcam公司、Anti-GAPDH antibody购自杭州贤至生物。其余qPCR、Western blotting试剂与仪器均来自甘肃省胃肠病重点实验室。
1.3实时荧光定量PCR核酸/蛋白定量检测仪进行总RNA定量检测,所提取的胃癌及其癌旁组织的OD260/OD280比值为1.8~2.2。按照5×PrimeScript RT Master Mix试剂盒说明书反转录为cDNA,按照SYBP®Premix Ex TaqTMⅡ说明书,应用LightCycler®480扩增仪采用两步法进行反应。反应步骤:95 ℃ 5 s、60 ℃ 20 s,共40个循环。采用相对定量2-△△Ct公式比较目的基因在不同样本中的差异。每个标本重复3次。所使用的引物序列如表1所示。

表1 PCR引物Tab 1 PCR primers
1.4Westernblotting检测配制分离胶、浓缩胶灌入并插入梳子,浓缩胶凝固后拔出。取20 μl变性后蛋白样品与上样缓冲液混匀,取15 μl加入上样孔中。80 V恒压电泳半小时进入,待溴酚蓝分离胶后,120 V恒压电泳1 h,以300 mA恒流转膜2 h。室温封闭2 h后移至一抗溶液(COX-2 1∶1 000,Notch1 1∶500,Notch2 1∶1 000,GAPDH 1∶1 000)4 ℃过夜。室温下将清洗3次后移至二抗稀释液(1∶2 000)中2 h。清洗后将膜放入暗盒并滴入发光液,曝光后将胶片置于显影液及定影液中。以Image J软件分析目标条带的平均光密度值。

2 结果
2.1Notch1、Notch2、COX-2mRNA在胃癌及癌旁组织中的表达胃癌组织中,Notch1 mRNA的表达量低于相应癌旁组织(0.45±0.3)倍,Notch2 mRNA高于相应癌旁组织(3.35±1.4)倍,差异均有统计学意义(P<0.05)。COX-2 mRNA的表达在癌组织中高于癌旁组织(3.06±1.8)倍,差异有统计学意义(P=0.00)(见图1)。
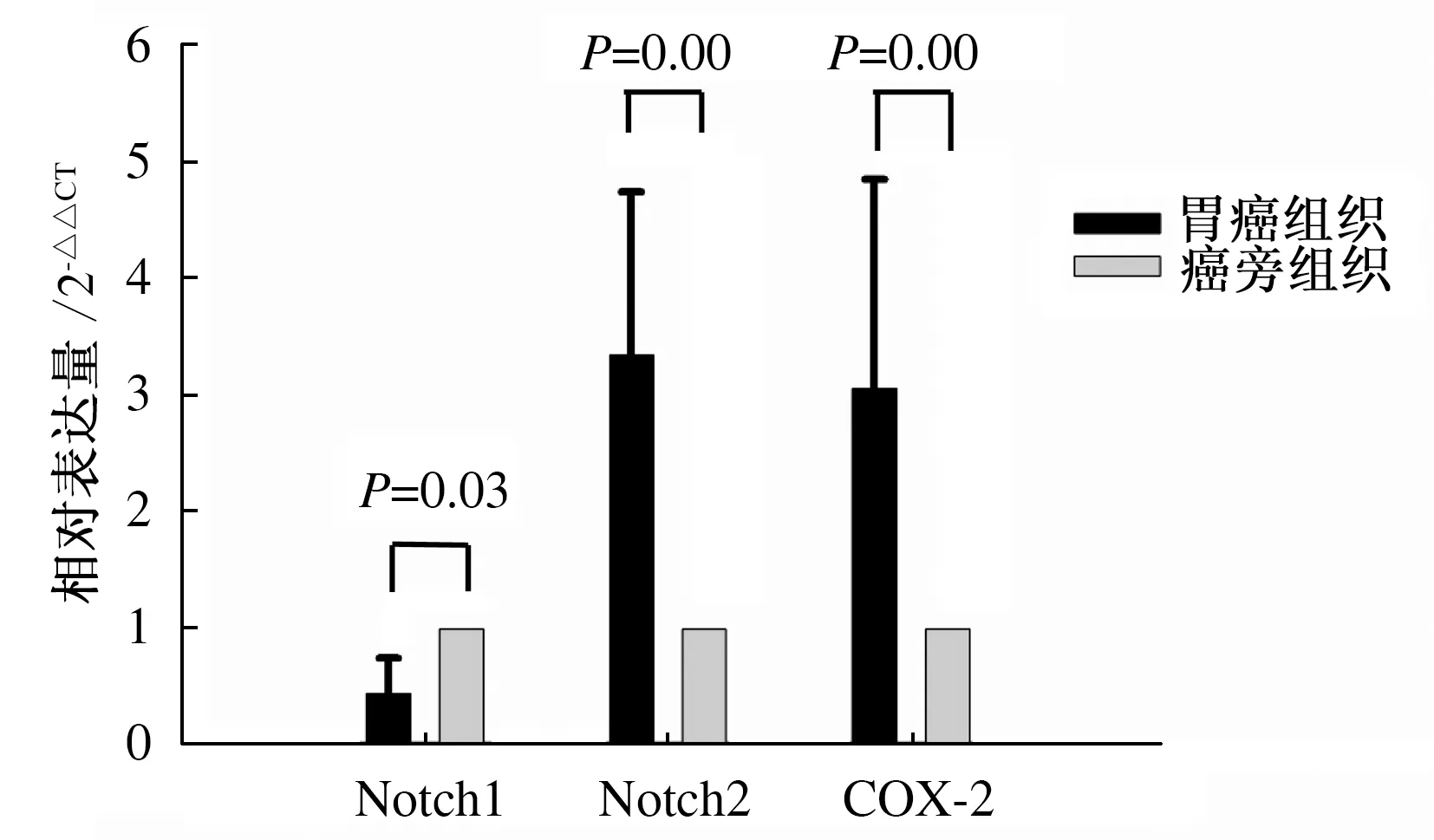
图1 Notch1、Notch2、COX-2 mRNA在胃癌及其癌旁组织中的表达Fig 1 The mRNA expression of Notch1, Notch2,COX-2 in gastric cancer tissues and paracancerous tissues
2.2N1IC、N2IC、COX-2蛋白在胃癌及癌旁组织中的表达及与临床病理学参数的关系胃癌组织中Notch1胞内段(N1IC)的表达(0.26±0.4)明显低于相应的癌旁组织(0.91±1.1),差异有统计学意义(P=0.00)。N1IC的表达与浸润深度、TNM分期有相关性(P<0.05)。Notch2 胞内段(N2IC)在胃癌组织中(1.74±1.9)显著高于相应癌旁组织(0.98±1.4),差异有统计学意义(P=0.000)。胃癌中N2IC的表达与浸润深度及远处转移有相关性(P<0.05)。COX-2在胃癌组织中的表达(3.04±2.4)高于相应癌旁组织(0.79±0.9),差异有统计学意义(P=0.001)。胃癌组织中COX-2的表达与胃癌分化程度、浸润深度有相关性(P<0.05)(见图2、表2)。
2.3Notch1、Notch2、COX-2胃癌中表达的相关性分析Notch1、Notch2在胞内分别以其活化形式N1IC、N2IC发挥转录因子作用。N1IC与COX-2在胃癌中呈负相关,但差异无统计学意义(r=-0.246,P=0.125)。N2IC与COX-2在胃癌中呈正相关且有统计学意义(r=0.33,P=0.037)。
3 讨论
Notch信号通路广泛存在于无脊椎动物和脊椎动物中,主要通过调控细胞的增殖、凋亡及分化影响组织和器官的正常发育;在遗传进化的过程中高度保守,与其他多个转导通路一起构筑起生物发展的信号骨架[2]。Notch信号不仅在胚胎正常发育的过程中广泛表达,决定细胞分化的方向,在组织形成、个体发育、肿瘤的发生与发展等生理病理过程中也具有举足轻重的作用[3]。
近年的研究显示,Notch信号通路除了与多种实体瘤的发生和发展有关;Notch信号通路的异常激活与多种恶性肿瘤的发生、发展及侵袭、转移密切相关[4];表明Notch信号在消化系统肿瘤的形成中也起到十分关键的作用,并在同一种肿瘤的不同类型或不同发展阶段中扮演着不同的角色,既可表现为致瘤性,又可表现为抑癌性[5-8]。大量研究[9-10]显示,Notch1对肿瘤的发生、发展在不同组织中可以起完全相反的作用,在肿瘤细胞的不同时期所起作用也可能不同。研究[11]发现,Notch1在宫颈癌发生早期阶段为促癌作用,而晚期则表现为抑癌作用。本研究结果提示Notch1在胃癌中低表达,虽与COX-2呈反向表达但差异无统计学意义,可能与样本量较小有关。Notch1是抑癌基因还是促癌基因由组织和细胞所处的体内微环境所决定,这些微环境因素包括:细胞种类、Notch1活化程度、Notch1与其他信号通路交叉级联等[12]。研究[13]显示,Notch1及Notch2能够在体内及体外参与小鼠胃黏膜上皮的干细胞及祖细胞的增殖、胃黏膜上皮细胞的分化。胃癌组织中Notch1、Notch2及Jagged1的高表达与肿瘤的迁移有关[14-15]。也有研究[16]发现,Notch1和Notch2在胃癌癌前病变组织及胃癌中均有更高的表达,其高表达量预示胃癌形成的高风险。
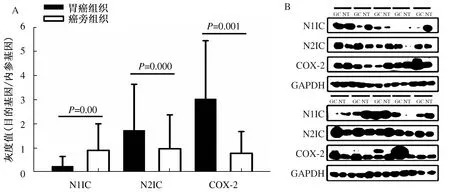
图2 N1IC、N2IC、COX-2蛋白在胃癌及癌旁组织中的表达 A:灰度值;B:电泳条带图Fig 2 The protein expression of N1IC, N2IC, COX-2 in gastric cancer tissues and paracancerous tissues A: grey level;B: the diagram of electrophoretic strip
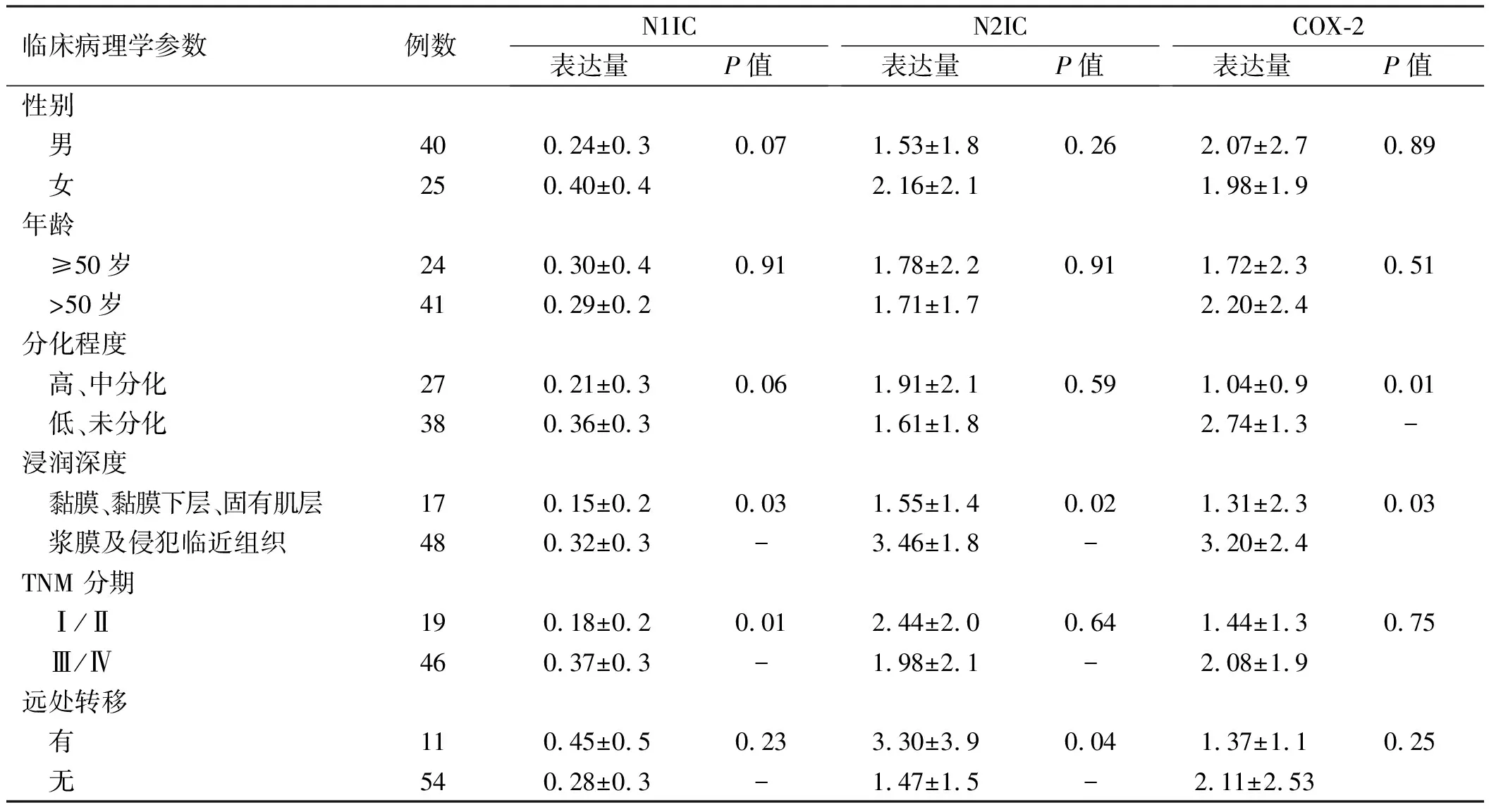
表2 N1IC、N2IC、COX-2与胃癌临床病理学关系Tab 2 The relationship with N1IC, N2IC, COX-2 and gastric cancer clinical pathology
本研究使用实时荧光定量qPCR法及Western blotting法检测了胃癌组织中Notch1、Notch2及COX-2的表达水平后发现,胃癌中Notch1的转录与活化水平均显现降低趋势,提示在胃癌中Notch1可能是低表达的,可能为Notch1在不同类型肿瘤及肿瘤不同阶段存在差异表达的可能性提供佐证;COX-2作为致癌因子参与肿瘤包括胃癌的发生发展已经得到很多研究的证实[17-19]。在本研究中也发现COX-2升高可能与肿瘤的分化及浸润深度有关。同时Notch2与COX-2同向高表达,提示Notch2可能通过调控COX-2的表达参与胃癌的发生、发展。非甾体类消炎药可以通过抑制COX-2/Notch的表达选择性减少结肠癌肿瘤干细胞的数量。N2IC可能与COX-2启动子结合从而促进胃癌的上皮-间质转化。总的来说,目前对于COX-2与Notch信号通路关系的相关研究相对仍较少,其调控关系相对复杂,有待更多的研究进一步证实,并为胃癌的临床治疗与研究提供新的分子治疗的靶点。
[1] ZHOU Y, ZHANG Z, ZHANG Z, et al. A rising trend of gastric cardia cancer in Gansu Province of China [J]. Cancer Lett, 2008, 269(1): 18-25. DOI: 10.1016/j.canlet.2008.04.013.
[2] 李大川, 胡彦华, 吴德全. Notch信号通路与恶性肿瘤侵袭、转移关系的研究进展[J]. 胃肠病学和肝病学杂志, 2015, 24(12): 1531-1534. DOI: 10.3969/j.issn.1006-5709.2015.12.033.
LI D C, HU Y H, WU D Q. Research progress of the relationship between Notch signaling pathway and invasion and metastasis of malignant tumor [J]. Chin J Gastroenterol Hepatol, 2015, 24(12): 1531-1534. DOI: 10.3969/j.issn.1006-5709.2015.12.033.
[3] EHEBAUER M, HAYWARD P, ARIAS A M, et al. Notch, a universal arbiter of cell fate decisions [J]. Science, 2006, 314(5804): 1414-1415. DOI: 10.1126/science.1134042.
[4] HU Y Y, ZHENG M H, ZHANG R, et al. Notch signaling pathway and cancer metastasis [J]. Adv Exp Med Biol, 2012, 727: 186-198. DOI: 10.1007/978-1-4614-0899-4_14.
[5] CHEN Y, DE MARCO M A, GRAZIANI I, et al. Oxygen concentration determines the biological effects of NOTCH-1 signaling in adenocarcinoma of the lung [J]. Cancer Res, 2007, 67(17): 7954-7959. DOI: 10.1158/0008-5472.CAN-07-1229.
[6] NAKAYAMA K, NAKAYAMA N, JINAWATH N, et al. Amplicon profiles in ovarian serous carcinomas [J]. Int J Cancer, 2007, 120(12): 2613-2617. DOI: 10.1002/ijc.22609.
[7] LEONG K G, GAO W Q. The Notch pathway in prostate development and cancer [J]. Differentiation, 2008, 76(6): 699-716. DOI: 10.1111/j.1432-0436.2008.00288.x.
[8] FAN X, KHAKI L, ZHU T S, et al. NOTCH pathway blockade depletes CD133-positive glioblastoma cells and inhibits growth of tumor neurospheres and xenografts [J]. Stem Cells, 2010, 28(1): 5-16. DOI: 10.1002/stem.254.
[9] MA Y C, SHI C, ZHANG Y N, et al. The tyrosine kinase c-Src directly mediates growth factor-induced Notch-1 and Furin interaction and Notch-1 activation in pancreatic cancer cells [J]. PLoS One, 2012, 7(3): e33414. DOI: 10.1371/journal.pone.0033414.
[10] XIE M, ZHANG L, HE C S, et al. Activation of Notch-1 enhances epithelial-mesenchymal transition in gefitinib-acquired resistant lung cancer cells [J]. J Cell Biochem, 2012, 113(5): 1501-1513. DOI: 10.1002/jcb.24019.
[11] ZAGOURAS P, STIFANI S, BLAUMUELLER C M, et al. Alterations in Notch signaling in neoplastic lesions of the human cervix [J]. Proc Natl Acad Sci U S A, 1995, 92(14): 6414-6418.
[12] HUANG T, ZHOU Y, CHENG A S, et al. NOTCH receptors in gastric and other gastrointestinal cancers: oncogenes or tumor suppressors? [J]. Mol Cancer, 2016, 15(1): 80. DOI:10.1186/s12943-016-0566-7.
[13] GIFFORD G B, DEMITRACK E S, KEELEY T M, et al. Notch1 and Notch2 receptors regulate mouse and human gastric antral epithelial cell homoeostasis [J]. Gut, 2017, 66(6): 1001-1011. DOI: 10.1136/gutjnl-2015-310811.
[14] BAUER L, TAKACS A, SLOTTA-HUSPENINA J, et al. Clinical significance of NOTCH1 and NOTCH2 expression in gastric carcinomas: an immunohistochemical study [J]. Front Oncol, 2015, 5: 94. DOI: 10.3389/fonc.2015.00094.eCollection2015.
[15] CHEN H F, WU K J. Endothelial transdifferentiation of tumor cells triggered by the Twist1-Jagged1-KLF4 axis: relationship between cancer stemness and angiogenesis [J]. Stem Cells Int, 2016, 2016: 6439864. DOI: 10.1155/2016/6439864.
[16] ZHANG H, WANG X, XU J, et al. Notch1 activation is a poor prognostic factor in patients with gastric cancer [J]. Br J Cancer, 2014, 110(9): 2283-2290. DOI: 10.1038/bjc.2014.135.
[17] SU H J, ZHANG Y, ZHANG L, et al. Methylation status of COX-2 in blood leukocyte DNA and risk of gastric cancer in a high-risk Chinese population [J]. BMC Cancer, 2015, 15: 979. DOI: 10.1186/s12885-015-1962-x.
[18] TARGOSZ A, BRZOZOWSKI T, PIERZCHALSKI P, et al. Helicobacter pylori promotes apoptosis, activates cyclooxygenase (COX)-2 and inhibits heat shock protein HSP70 in gastric cancer epithelial cells [J]. Inflamm Res, 2012, 61(9): 955-966. DOI: 10.1007/s00011-012-0487-x.
[19] WANG Z, CHEN J Q, LIU J L, et al. COX-2 inhibitors and gastric cancer [J]. Gastroenterol Res Pract, 2014, 2014: 132320. DOI: 10.1155/2014/132320.

